Похожие презентации:
Амфотерные оксиды и гидроксиды
1.
Амфотерные оксиды игидроксиды
2.
3.
4.
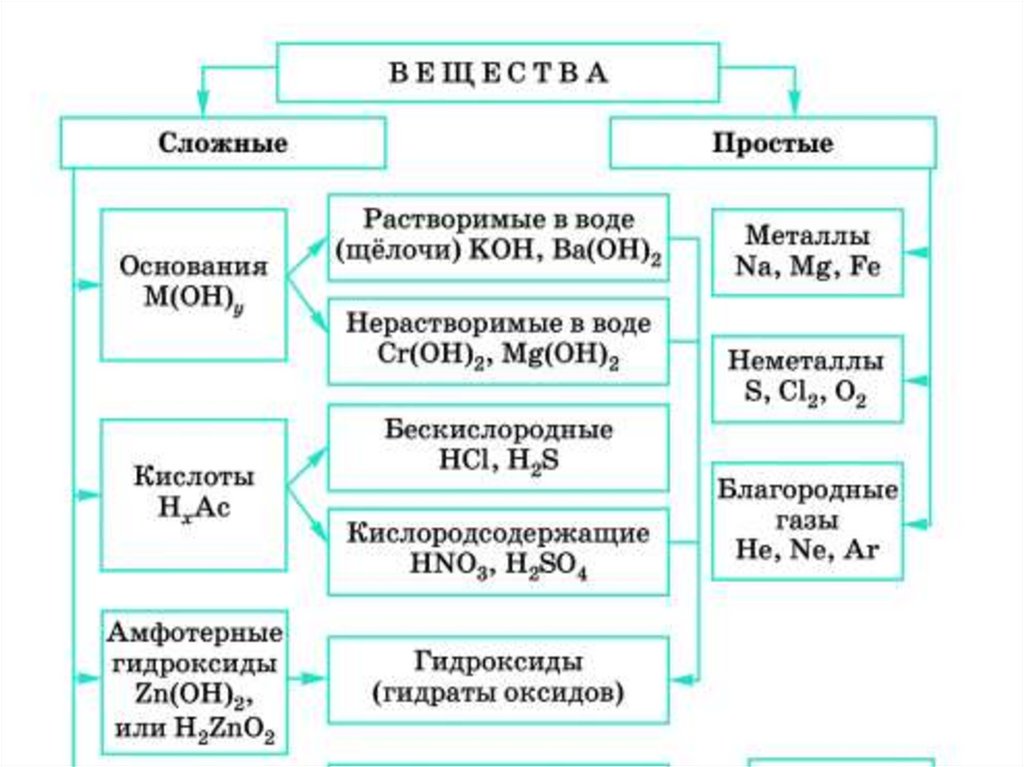
Амфотерные вещества5.
6.
Zn(OH)2- - гидроксид цинка7.
8.
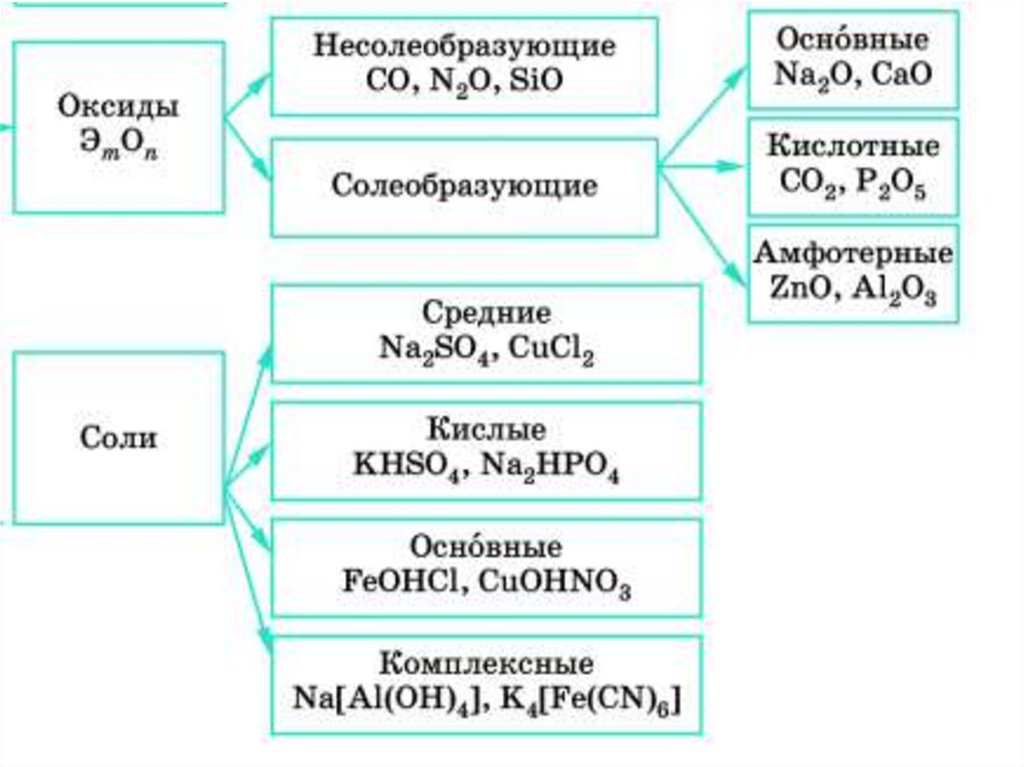
Химические свойства амфотерныхоксидов
• Амфотерные оксиды, как основные оксиды,
взаимодействую
• с кислотами, с образованием соли и воды:
• PbO + 2HCl = PbCl2+ H2O,
• С кислотными оксидами, с образованием соли:
• PbO + СО2 = PbСO3
9.
• Амфотерные оксиды, как кислотныеоксиды, взаимодействую:
• со щелочами, с образованием соли и воды:
• а) Al2O3 + 2NaOH =Метаалюминат
2NaAlO2 + H2O ↑.
натрия
• б) с основными оксидами, с образованием соли :
• Al2O3 +Na 2O= 2NaAlO2
10.
• Амфотерные оксиды, как основныеоксиды, взаимодействую:
• С кислотами с образованием соли и воды:
Al2O3 + НСl = AlCl3 + H2O (расставить
коэффициенты).
• С кислотными оксидами с образованием
соли:
• Al2O3 + SO3 =
11.
Химические свойства амфотерныхгидроксидов
• 1. При нагревании разлагаются на оксид и воду:
• 2Al(OH)3t= Al2O3 + 3H2O
• Pb(OH)2 =t PbO+ H2O
• 2. Проявляя основный характер они
взаимодействуют с кислотой
• Al(OH)3 + 3НСl = AlCl3 + 3H2
• Zn(OH)2 + 2НNO3 = Zn(NO3)2 +2H2O
12.
• Проявляя кислотный характер, они реагируют:• а) с расплавами щелочей:
t
• Al(OH)3 + NaOH → NaAlO2 + 2H2O
расплав
• Al(OH)3 + 3NaOH → Na3AlO3+ 3H2O
расплав
• б) с растворами щелочей, с образованием
комплексных солей
• Al(OH)3 + 3NaOH = Na[Al(OH)4],
тетрагидроксоалюминат
натрия
• Al(OH)3 + 6NaOH = Na3[Al(OH)6],
гексагидроксоалюминат
натрия
13.
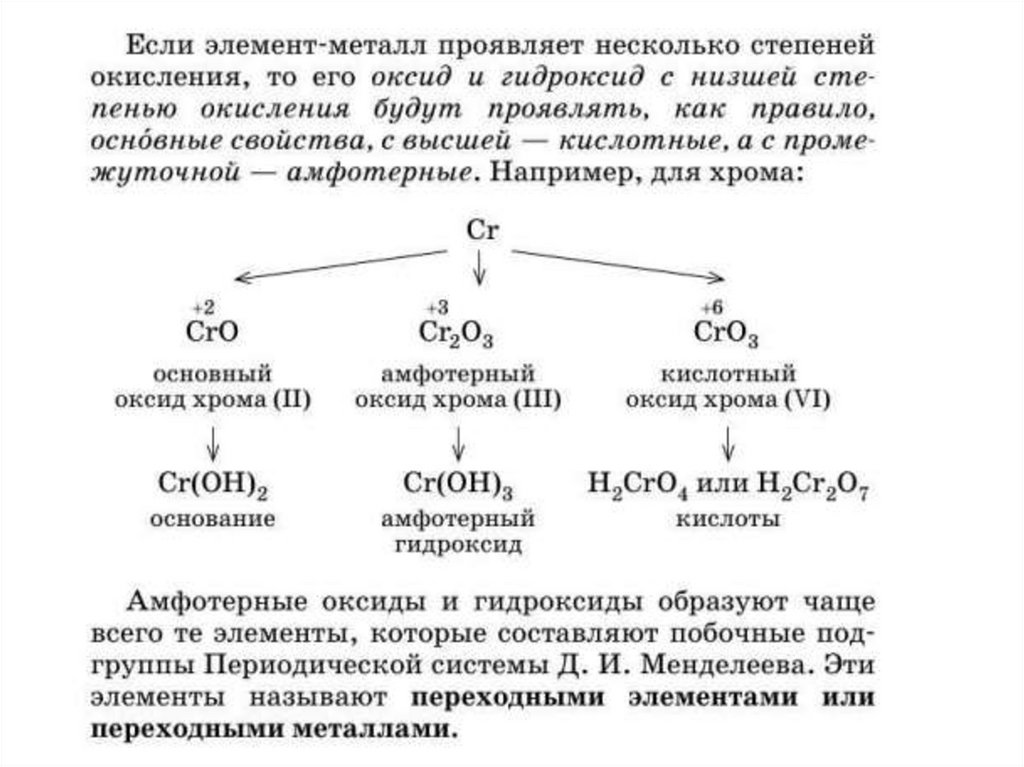
• Элементы которые образуют амфотерныеоснования могут проявлять амфотерные
свойства.
• Zn + Н2SO4 = Zn SO4 + H2 ↑.
• Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2 ↑.
• 2Al + 3Н2SO4разб. = Al2SO4 +3H2 ↑.
• 2Al + 4NaOH + 6 Н2О = Na[Al(OH)4] + 3H2↑.












 Химия
Химия








