Похожие презентации:
Теоретические основы аналитической химии
1.
Тема 1.1. Теоретические основыаналитической химии
Занятие 2
2.
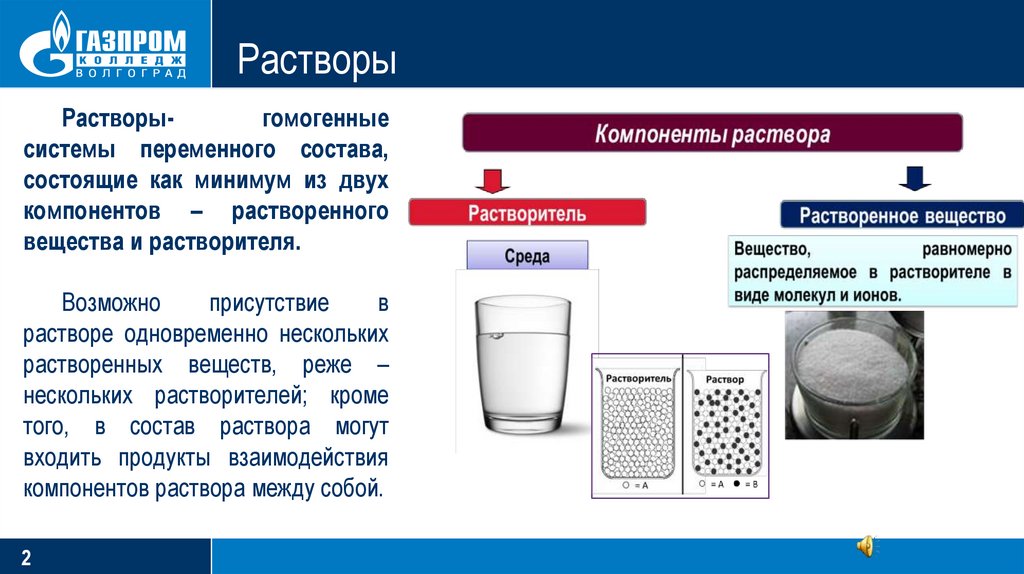
РастворыРастворыгомогенные
системы переменного состава,
состоящие как минимум из двух
компонентов – растворенного
вещества и растворителя.
Возможно
присутствие
в
растворе одновременно нескольких
растворенных веществ, реже –
нескольких растворителей; кроме
того, в состав раствора могут
входить продукты взаимодействия
компонентов раствора между собой.
2
3.
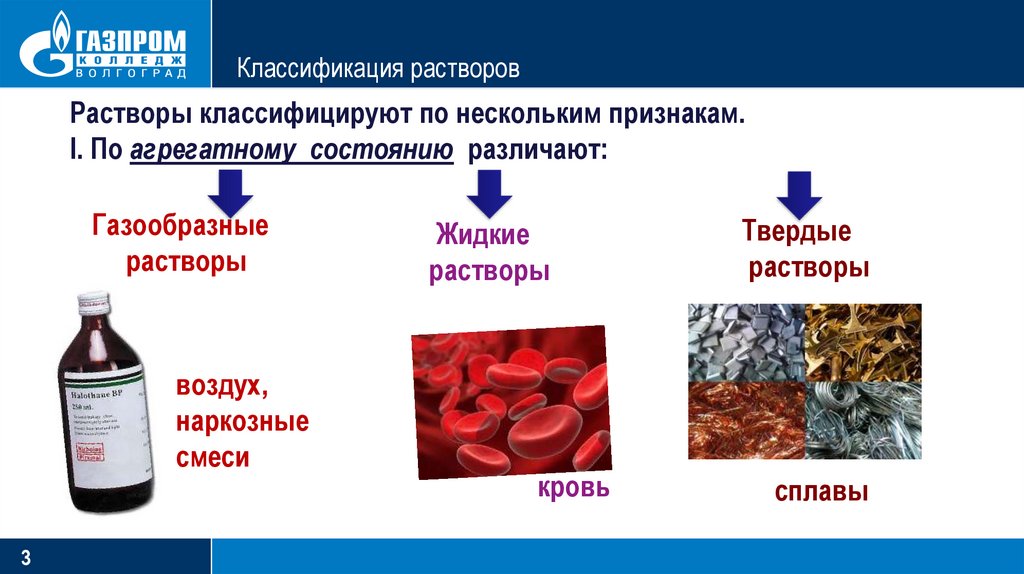
Классификация растворовРастворы классифицируют по нескольким признакам.
I. По агрегатному состоянию различают:
Газообразные
растворы
воздух,
наркозные
смеси
3
Жидкие
растворы
кровь
Твердые
растворы
сплавы
4.
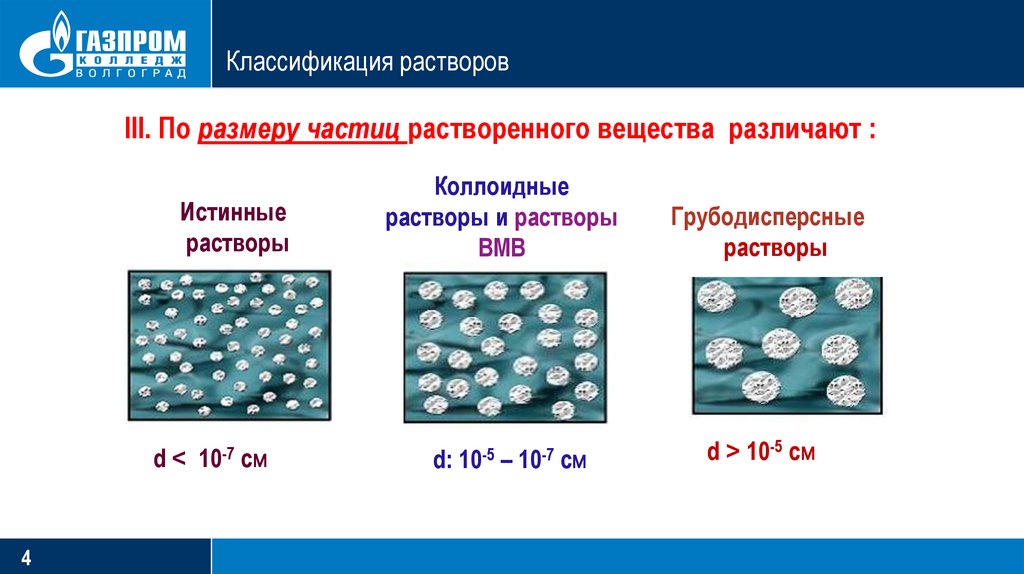
Классификация растворовIII. По размеру частиц растворенного вещества различают :
Истинные
растворы
d ˂ 10-7 см
4
Коллоидные
растворы и растворы
ВМВ
Грубодисперсные
растворы
d: 10-5 – 10-7 см
d ˃ 10-5 см
5.
РастворениеРастворение — физико-химический процесс, протекающий между
твердой и жидкой фазами и характеризующийся переходами твердого
вещества в раствор.
При растворении образуются:
соединения, называемые сольватами;
если растворителем является вода, то полученные соединения
называются гидратами;
если гидратная вода входит в состав кристаллов, то соединения
называются кристаллогидратами. Например,
Na 2SO4 10H2O , CuSO4 5H2O .
5
6.
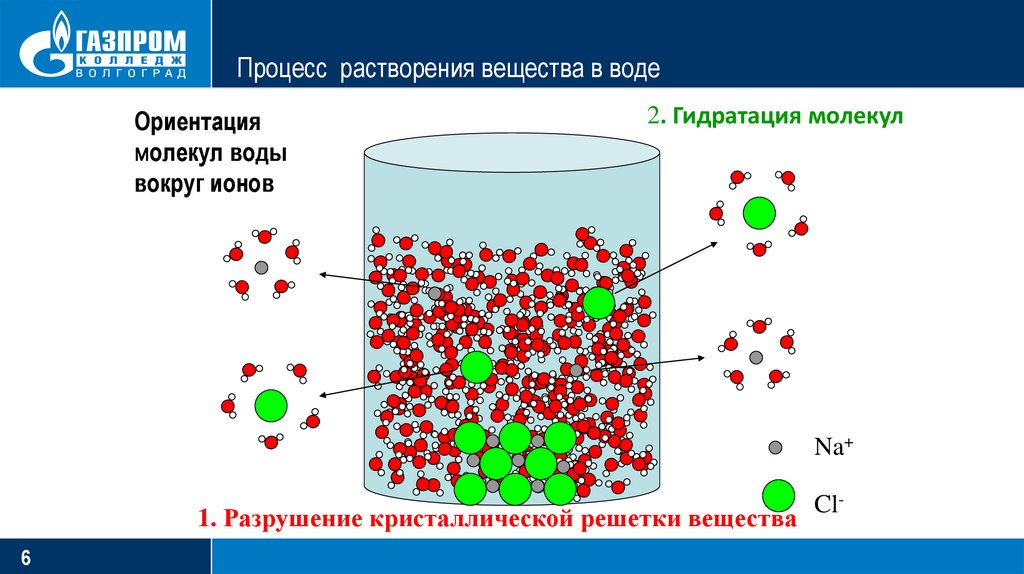
Процесс растворения вещества в водеОриентация
молекул воды
вокруг ионов
2. Гидратация молекул
Na+
1. Разрушение кристаллической решетки вещества
6
Cl-
7.
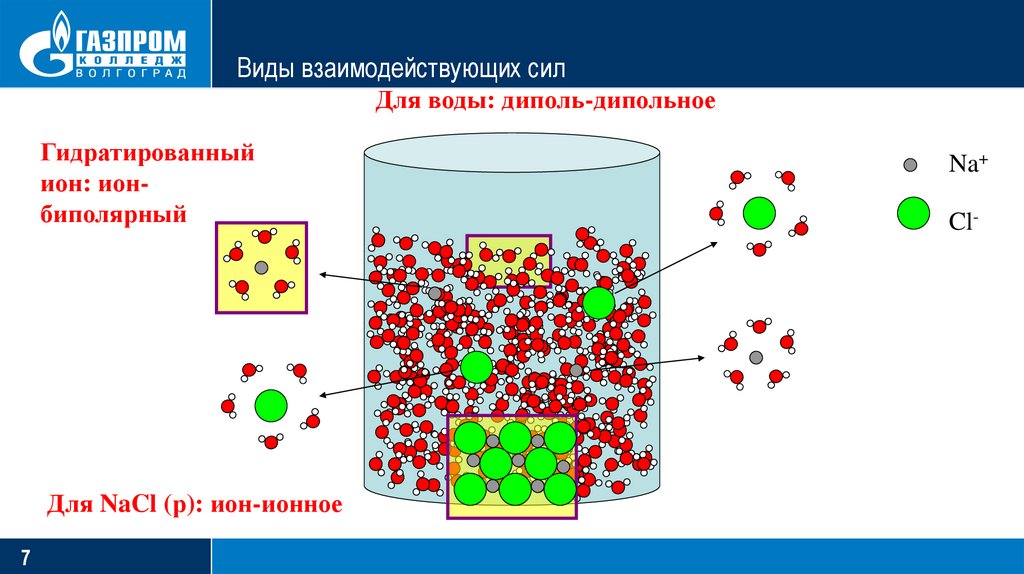
Виды взаимодействующих силДля воды: диполь-дипольное
Гидратированный
ион: ионбиполярный
Для NaCl (р): ион-ионное
7
Na+
Cl-
8.
КонцентрацияКоличественный состав раствора оценивают с помощью концентрации, т.е. содержания
растворенного вещества в единице массы или объема раствора или растворителя.
Основные способы выражения концентрации растворов:
– массовая доля
– молярная концентрация
–молярная концентрация эквивалента
–моляльная концентрация
–титр
–мольная доля
Студенты должны обладать навыками приготовления раствора с заданной концентрацией
растворенного вещества.
8
9.
Способы выражения концентрации1. Массовая доля вещества ω – отношение массы данного компонента
раствора к общей массе всего раствора.
ω(x)
m(x)
m(x)
или ω(x)
m(р - р)
(р - р) V(р - р)
m( x)
или ( x)
m( x) m( р ль)
Здесь ρ = m(р-р)/V(р-р) – плотность (г/см3 или г/мл)
m(р-р) = V ∙ρ
9
10.
Способы выражения концентрации2. Молярная концентрация раствора С (молярность) это отношение
количества растворённого вещества n(х) к объёму раствора:
n(x)
m(x)
C(x)
.
V(р - р)
M(x) V(р - р)
Молярная концентрация выражается в моль/л и показывает количество
растворённого вещества, которое содержится в 1 л раствора.
Допустимо сокращенное обозначение:
1 моль/л = 1М
10
11.
Способы выражения концентрации3. Молярная концентрация эквивалента С( x) (нормальность) это отношение
количества эквивалентов растворённого вещества n(х) к объёму раствора:
1
n( x)
1
z
C( x)
V(р - р)
z
m(x)
1
M(
Размерность - моль/л, допустимо 1 моль/л = 1н.z x) V(р - р)
. 1
z
Химический эквивалент – это реальная или условная частица вещества,
которая равноценна 1 иону водорода в ионообменных реакциях или 1 электрону в
окислительно-восстановительных реакциях.
11
12.
.Химический эквивалент
Масса одного моль эквивалента называется молярной массой эквивалента М( x). Доля реальной частицы вещества,
1
соответствующая эквиваленту, называется фактором эквивалентности
.
z
1) H3PO4 + NaOH NaH2PO4 + H2O;
2) H3PO4 + 2NaOH Na2HPO4 + 2H2O;
3) H3PO4 + 3NaOH Na3PO4 + 3H2O.
В соответствии с определением эквивалента, в 1-й реакции замещается один протон,
следовательно, z l; и молярная масса эквивалента равна молярной массе вещества.
1
1
1
M( H3PO4 ) M(H3PO4 ) 98 г/моль
z
z
Во 2-й реакции происходит замещение двух протонов, следовательно, молярная масса
эквивалента составит половину молярной массы Н3РО4, т. e. z 2,
1 1
z 2
1
1
M( H3PO4 ) M( H3PO4 ) 49 г/моль
z
2
В 3-й реакции происходит замещение трёх протонов и молярная масса эквивалента
составит третью часть молярной массы Н3РО4, т.е. z 3, a
1 1
z 3
12
1
1
M( H3PO4 ) M( H3PO4 ) 32,7 г/моль
z
3
13.
Химический эквивалентЕсли не указывается реакция, для которой рассчитывается эквивалент, учитывают
максимальное число зарядов, которые могут принять участие в реакции:
Н3РО4 1/3
NaHCO3 1
CuSO4 ½
Al2(SO4)3 1/6
В реакции FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
1/z(FeCl3) = 1/3
Но в реакции 2FeCl3 + 2KI → 2FeCl2 + I2 + 2KCl
1/z (FeCl3) = 1. т.к. Fe3+ + e → Fe2+ (ОВР)
13
14.
Способы выражения концентрации4. Титр Т(x) – это отношение массы растворённого вещества в г к объёму раствора в мл:
T(x)
m(x)
.
V р р
Измеряется в г/мл.
5. Моляльная концентрация (моляльность) b(х) – это отношение количества растворённого
вещества к массе чистого растворителя, выраженной в кг:
Измеряется в моль/кг.
n(x)
m(x)
b(x)
.
m(р - ль) M(x) m(р - ль)
6. Мольная доля N(x) – это отношение количества вещества данного компонента, содержащегося в
системе, к общему количеству веществ системы:
Выражается в долях единицы или в %.
14
n(x)
N(x)
n(x) n(y) ...
15.
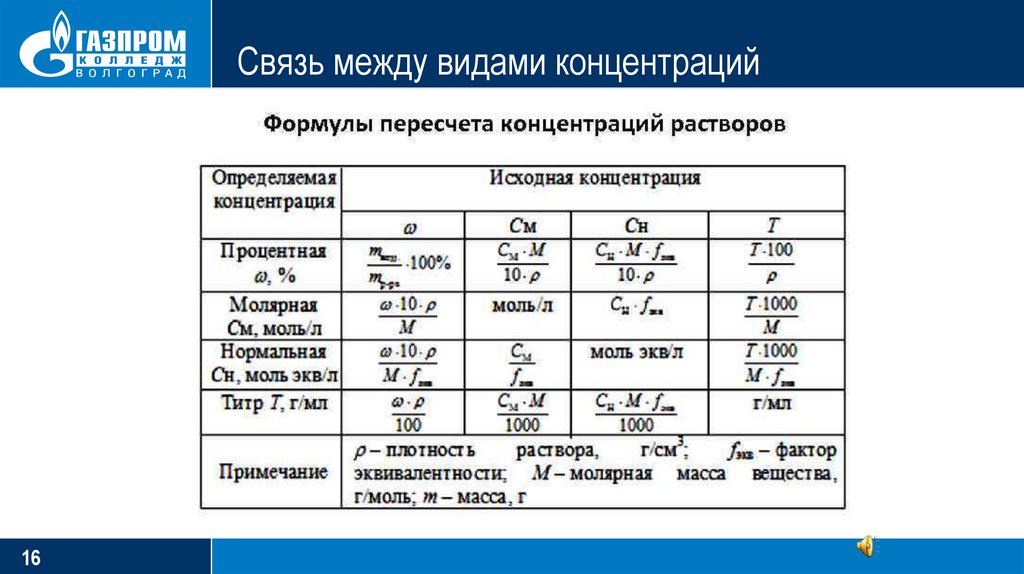
Связь между видами концентрацийИспользуя вышеприведенные формулы, легко пересчитать с одного вида концентрации на
другую. Для этого необходимо из формул найти массу растворенного вещества:
m = ωVρ = CMV = C(1/z)M1/zV = TV
С учетом, что 1 л = 1000 мл
CMV
C(1/z)M1/zV
m = ωVρ = ——— = ——————
1000
1000
= T V
Например, требуется найти связь между молярностью и нормальностью. Выбираем из
этого соотношения необходимые формулы:
После сокращений получаем:
15
CMV
C(1/z)M1/zV
——— = ——————
1000
1000
С = С(1/z) / z
C(1/z) = C∙z
16.
Связь между видами концентраций16
17.
Закон эквивалентов ДальтонаВещества реагируют между собой в эквивалентных количествах (или
согласно своим химическим эквивалентам): n1 = n2.
Используя данный закон можно определять концентрации растворов. Выразим
эквиваленты через их нормальные концентрации: n = CH · V, тогда в соответствии с
законом Дальтона: CH1 · V1 = CH2 · V2.
По данной формуле можно рассчитать неизвестную концентрацию
определяемого вещества СН, если известна концентрация другого вещества, а
также определены объемы реагирующих веществ:
CH2 = CH1 · V1 / V2
17
18.
Решение задач на приготовление раствора заданного составаЗадача 1. Приготовить 200 мл 5% раствора NaCl (ρ = 1,03 г/мл) из кристаллической
соли и воды.
Рассчитаем массу поваренной соли, необходимую для приготовления раствора, используя
формулу для массовой доли.
m(x)
ω(x)
( р р) V(р - р)
m = ω∙V∙ρ = 0,05∙200∙1,03 = 10,3 г
Рассчитаем массу приготавливаемого раствора:
m(р-р) = V∙ρ = 200∙1,03 = 206 г
Массу воды определяем по разности:
m(H2O) = m(р-р) – m(NaCl) = 206 – 10,3 = 195,7 г
С учетом плотности воды, равной 1 г/мл, получаем V(H2O) = 195,7 мл.
Таким образом, для приготовления раствора требуется взвесить 10,3 г соли и отмерить 97,85 мл
воды.
19.
Решение задач на приготовление раствора заданного составаЗадача 2. Приготовить 250 мл раствора сульфата меди (II) с молярной концентрацией
эквивалента 0,1 моль/л из кристаллогидрата медного купороса CuSO4∙5H2O.
1) Найдём массу безводного CuSO4 в растворе:
m(CuSO4) C( 1 CuSO4)·M( 1 CuSO4) V(р-р)
z
z
= 0,1 моль/л· 160 г/моль ·0,25 л 2 г.
2
2) Найдём массу кристаллогидрата, содержащего 2 г CuSO4, из
закона стехиометрических соотношений:
n(CuSO4·5H2O) = n(CuSO4) =
m(CuSO 4 )
2 0,0125 моль.
M(CuSO 4 ) 160
3) m(CuSO4·5H2O) = n(CuSO4·5H2O)·M(CuSO4·5H2O) =
= 0,0125 моль·250 г/моль = 3,12 г.
Приготовление раствора аналогично предыдущей задаче.
20.
0Решение задач на приготовление раствора заданного состава
Задача 3. Приготовить 250 мл 0,1 М раствора H2SO4 с из 10% раствора H2SO4 плотностью
1,06 г/мл.
В данном случае необходимо рассчитать объём пробы концентрированного раствора.
1) найдем массу H2SO4 в заданном растворе:
m(H2SO4) C(H2SO4)·M(H2SO4)·V(р-р) 0,1·98·0,25 2,45 г.
2) найдем массу 10% раствора H2SO4, который содержит 2,45 г кислоты:
3) Объём 10%раствора H2SO4 равен:
m(р р)
V(р р)
m(H 2SO 4 ) 2,45
24,5 г;
ω
0,1
m(р р H 2SO 4 ) 24,5
23 мл.
ρ
1,06
Приготовление раствора:
а) отмерить мерным цилиндром 23 мл 10% раствора H2SO4;
б) перенести его в мерную колбу вместимостью 250 мл;
в) добавить до метки дистиллированную воду, тщательно перемешать.















 Химия
Химия