Похожие презентации:
Насыщаемость связи. Валентные возможности атомов
1. Насыщаемость связи. Валентные возможности атомов
Мороз Борис Львович2. Насыщаемость ковалентной связи: определения
Насыщаемость – одно из свойств связи, означающее,что число ковалентных связей, которые может
образовать любой атом, является ограниченным (и
притом строго определенным).
Валентность – число ковалентных связей, образуемых
атомом данного элемента в некотором его соединении.
2
3. Механизмы образования ковалентной связи
1. «Равноценный» или «обменный».A
+
B
A
B
2. Донорно-акцепторный
A
+
B
A
B
А – акцептор, B - донор
3
4. Правило Льюиса
Атомлюбого
элемента,
образуя
химические (ковалентные) связи с атомами
того же самого или другого элемента,
стремится
путем
обобществления
электронов превратить свою электронную
конфигурацию в стабильную электронную
конфигурацию инертного газа, который
является соседом этого элемента в ПС.
Гилберт Ньютон
Льюис
(1875-1946)
Электронные конфигурации инертных газов:
1s2 – дублет (He);
ns2 np6 – октет (Ne, Ar, Kr, Xe, Rn).
4
5. Правило Льюиса
Стабильные соединения:H:O:H
: :
:
N N
: :
:
H
H:C:H
H
H:N:H
H
Минимальное
ковалентных связей, которое атом
Нестабильныечисло
соединения:
любого элемента образует в своем устойчивом
H C H равноN числу
соединении,
O неспаренных электронов в
основном
H состоянии этого атома.
5
6.
Правило Льюиса: примерыH
1s
1s
1s
О
N
2p
2p
2s
2s
H2О
H
H
25
1s
H
Вал. О = 2
NH3
1s
H
Вал. N = 3
6
7.
Правило Льюиса: примеры25
2s
N
2p
2p
N2
2s
N
Вал. N = 3
7
8. Образование связей возбужденными атомами
2p2p
С
Е* = 398 кДж/моль
2s
Вал. С = 2
С*
2s
Вал. С = 4
:
H
H:C:H
H
:
O C O
Затрата энергии, которая необходима для перевода атома углерода
в первое возбужденное состояние, компенсируется энергией,
выделяющейся
благодаря,
например,
образованию
двух
дополнительных связей С-Н в молекуле метана (энергия одной
связи С-Н равна ~400 кДж/моль).
8
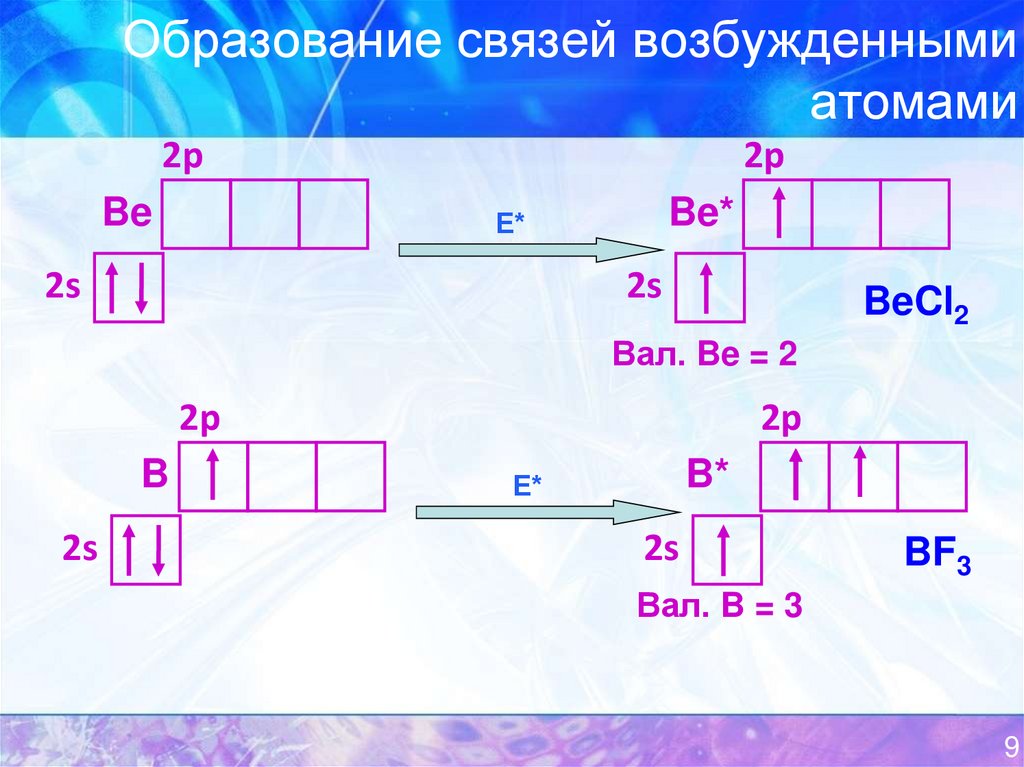
9. Образование связей возбужденными атомами
2pBe
2p
Be*
Е*
2s
2s
BeCl2
Вал. Be = 2
2p
B
2s
2p
B*
Е*
2s
BF3
Вал. B = 3
9
10. Образование связей возбужденными атомами
2pN
Е*
2s
X
2p
O
Е*
2s
X
2p
F
2s
Е*
X
10
11. Образование связей возбужденными атомами
(Е2s-E1s) > (Е3s-Е2p) >>>> (E2p-E2s)
У атомов элементов I и II периодов энергетически выгодными
являются переходы электронов только с одного подуровня на
другой в пределах одного энергетического уровня!
11
12. Образование связей возбужденными атомами
S*3d
S
3p
Предельное
число связей, образуемых атомом по
3d
«обменному»
механизму,
равняется
Вал. S =числу
4
3s
+Е*
3p
неспаренных
электронов, которые есть у атома
(SF4) в его
основном
и вероятном возбужденных состояниях.
3s
Вал. S = 2
(H2S)
S**
+Е**
3d
3p
3s
Вал. S = 6
(SCl6)
12
13. Расширение валентных возможностей атомов благодаря образованию связи по донорно-акцепторному механизму
Н+□ + :А−НА
Н2О + Н+
Н3О+ ион гидроксония
донор
HOH
H
□H+ + : O H
акцептор
H
Н+ + :B
НB+
протонирование
13
14. Расширение валентных возможностей атомов благодаря образованию связи по донорно-акцепторному механизму
BF3 + F-F
.. : ..
F
..
..F
□B : F +
..
BF4-
тетрафторборат ион
F
..
:F
F:B
..
F
2p
B*
акцептор
2s
2p
F-
2s
донор
14
15. Предел валентных возможностей атомов
Максимальная валентность элемента равна числувалентных орбиталей в его атоме.
Макс. валентность = число валентных s-АО +
+ число валентных р-АО + число валентных d-АО + …
Период
I
II
III
Макс.
валентность
1
4
9
15














 Химия
Химия








