Похожие презентации:
Поняття про родини хімічних елементів: лужні метали, галогени, інертні елементи. Урок хімії у 8 класі
1.
Урок хімії у 8 класіВчитель Ворона
. Л.М.
2.
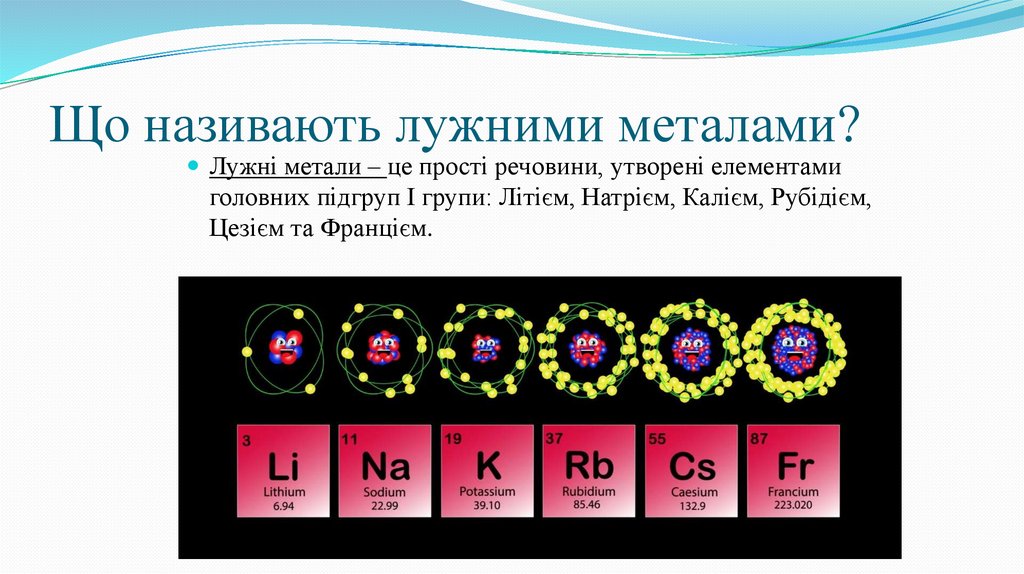
Що називають лужними металами?Лужні метали – це прості речовини, утворені елементами
головних підгруп І групи: Літієм, Натрієм, Калієм, Рубідієм,
Цезієм та Францієм.
3.
До лужних металів належать Li, Na, К, Rb, Cs, FrОсь родина в першій групі
Є у головній підгрупі.
Це метали надактивні,
Інколи аж дуже дивні.
У воді іскру пускають,
Вони – лужні, всі це знають.
Li
Na
Цезій Cs
K
4.
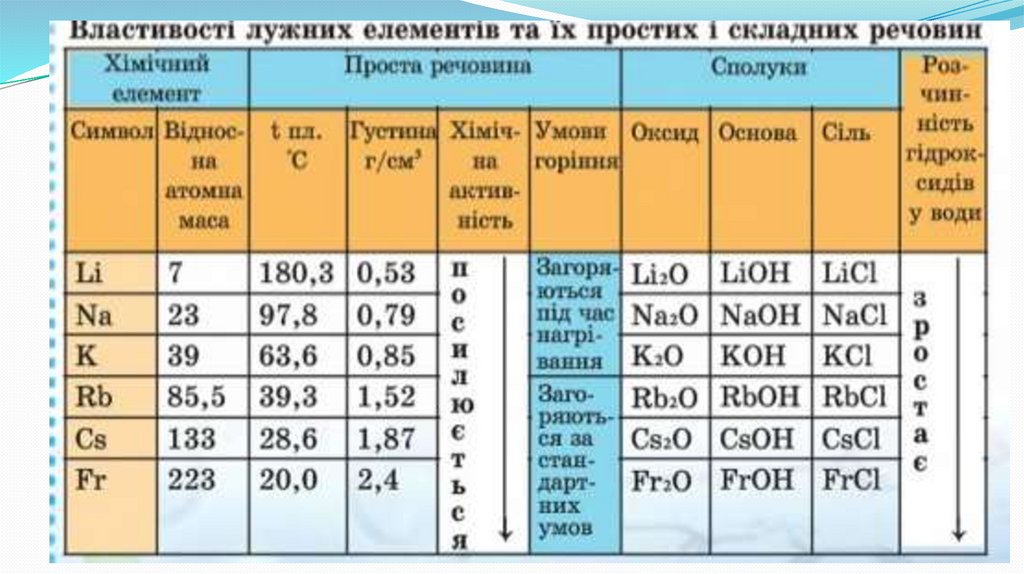
Фізичні властивості лужних металівМають металевий блиск, сріблясто-білі
(за виключенням цезію - метал
золотистого кольору з сріблястим
блиском)
М’які, легко ріжуться ножем.
Пластичні.
Легкоплавкі.
Легкі, мають невелику густину (легші за
воду).
Добре проводять тепло і електричний
струм.
5.
6.
Лужні метали дуже активні,вони легко реагують з киснем повітря, водою,
тому зберігаються в банках з гасом або запаяних
ампулах
7.
Прокоментуйте подію, яка сталася у Цюріхуперед лекцією професора Вельта.
Один зі студентів взяв із виставленої банки шматок калію
і, ретельно загорнувши в носовичок, поклав до кишені.
Під час лекцій калій почав реагувати з вологим повітрям.
Студент неспокійно закрутився на лаві, потім раптом
схопився на неї і стрімко вирвав кишеню, яка запалала,
разом з її вмістом. У чому справа? – Вигукнув
переляканий професор. У мене в кишені був шматочок
калію, загорнутий в ганчірочку, відповів тремтячий від
страху викрадач. Студенти почали голосно сміятись!
Студент постраждав не тільки від глузувань, а й від опіків.
Залишки кишені як застереження увійшли в хімічну
колекцію кафедри і зберігалися в банці з написом: «Дія
вкраденого калію на кишеню студентських брюк».
Запитання :
1. В чому мораль цієї
історії?
2.Чому студент
отримав опіки?
8.
Лужні метали активно реагують з киснем.Переглянути відео
4Li + O2 = 2Li2O
4Na + O2 = 2Na2O
Йони лужних металів здатні забарвлювати
полум’я у різні кольори. Це застосовують
для ідентифікації сполук лужних металів
Li – карміновий - червоний
Na - жовтий
K – блідо - фіолетовий
Rb – рожево - фіолетовий
Cs – блакитно - фіолетовий
9.
Лужні метали активно реагують з водою.Переглянути відео
2Li + 2Н2О = 2LiOН + Н2↑
2Na + 2Н2О = 2NaOН + Н2↑
Реакція літію з водою Реакція натрію з водою
2K + 2Н2О = 2КOН + Н2↑
З водою літій реагує повільно, натрій
значно швидше, а калій, рубідій і цезій
дуже швидко й виділяють стільки тепла, що
водень, виділяючись, загоряється.
Реакція калію з водою Реакція цезію з водою
10.
Прокоментуйте події, що сталися під часдосліду Г.Деві
Англійський хімік Г. Деві під час
електролізу лугу КОН відкрив новий
елемент, калій. Деві кинув калій у
воду й очікував, що метал має негайно
опуститися на дно. Але калій повівся
інакше. З гучним шипінням цей метал
забігав по поверхні води. Потім
пролунав оглушливий вибух, і
спалахнуло
полум’я. Так він і
носився по воді, поки не перетворився
на їдкий луг.
Запитання :
1. Чому метал не потонув у воді?
2. Як можна довести, що в
результаті реакції утворився луг?
11.
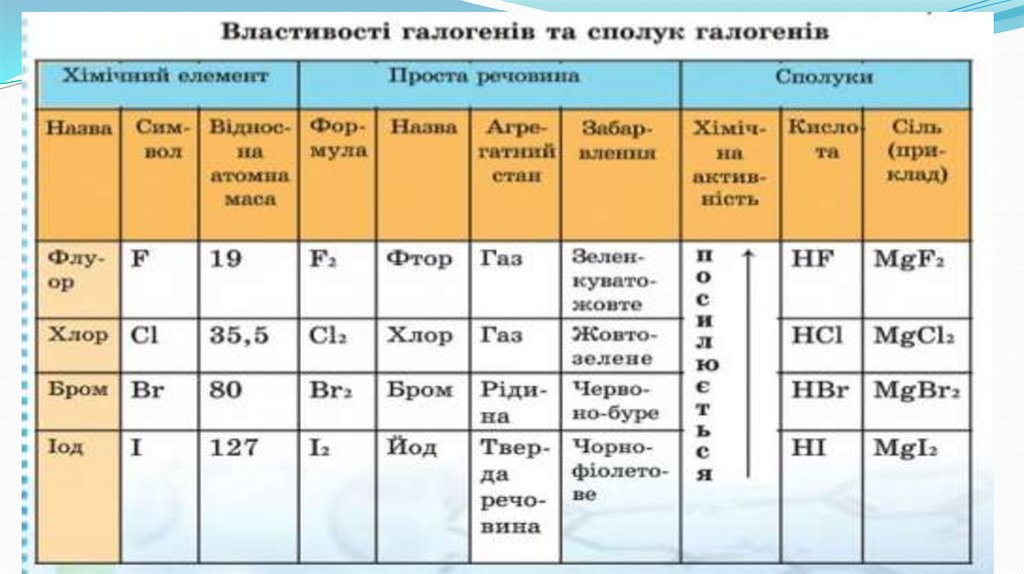
До галогенів належать F, Cl, Br, I, AtУсі прості речовини галогенів – двохатомні молекули: F2, Cl2, Br2, І2, Аt2
В сьомій групі – галогени,
Ніби справжні джентльмени.
Люблять завжди в парі бути –
Це їх звичні атрибути.
З Гідрогеном дуже дружать
І тоді кислотам служать.
F2
Cl2
Br2
ЖовтоЧервоно –
ЗеленкуватоЯк ви помітили, нічого не сказано про просту
зелений газ
бура рідина
жовтий газ
речовину такого галогену, як Теннессін (Ts).
Справа у тому, що, як і Оганесон, цей елемент
був відкритий практично нещодавно. Комісія
At2
I2
IUPAC офіційно визнала відкриття цього
елемента 30 грудня 2015 року. Його
властивості ще є предметом численних
Темно-сині кристали
Чорно-фіолетові кристали
суперечок.
12.
13.
Прокоментуйте віршХлор хвалился: «Нет мне равных!
Cl2
Галоген я самий главный.
Зря болтать я не люблю:
Все на свете отбелю!»
Йод красой своей гордился,
Твердым был, но испарился.
Фиолетовый как ночь,
Далеко умчался прочь.
Бром разлился океаном,
Хоть зловонным, но румяным.
Бил себя он грозно в грудь:
«Я ведь бром! Не кто – нибудь!..»
Br2
Фтор молчал и думал:
«Эх!..Ведь прийду – окислю всех…»
FF2
14.
Хімічні властивості галогенів1. Галогени активно реагують з металами, утворюючі солі.
2Na + Cl2 = 2NaCl
Zn + I2 = ZnI2
2Al + 3Br2 = 2AlBr3
Горіння натрію
2. Галогени активно реагують з воднем.
в хлорі
H2 + F2 = 2HF
H2 + Cl2 = 2HCl
H2 + Br2 = 2HBr
15.
Що за горді, наче ружі,І до всіх завжди байдужі,
Елементи в восьмій групі
Є у головній підгрупі?
Це спокійні, благородні
Гази, що з усіма згодні,
В поведінці неактивні,
У житті вони пасивні.
В назві їх ці всі моменти,
Це – інертні елементи.
До інертних елементів
належать Не, Ne, Аr, Кr, Хе, Rn
Прості речовини цих елементів
– одноатомні гази, що не мають
запаху і кольору.
Усі вони характеризуються
високою хімічною стійкістю
(інертністю).
16.
Якщо крізь розріджені інертні гази пропускати електричний струм, товони випромінюють світло різного забарвлення, тому їх
використовують для світлових реклам і в маяках. Трубки, наповнені
неоном світяться оранжево-червоним, а аргоном - блакитним
кольором ( звідси назви «неонові вогні», «неонові вивіски», адже неон
вперше почали використовувати з такими цілями)
17.
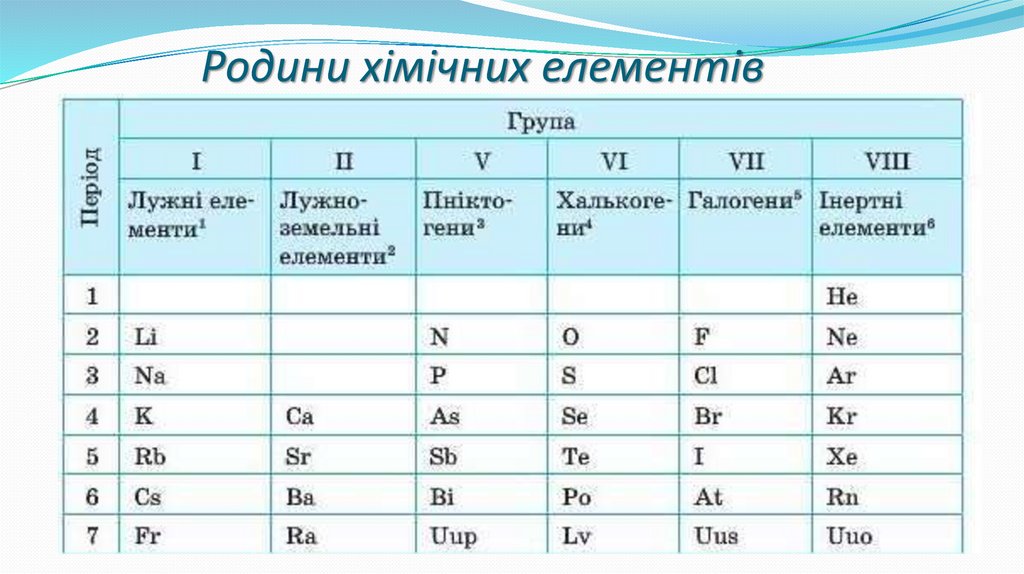
Родини хімічних елементів18.
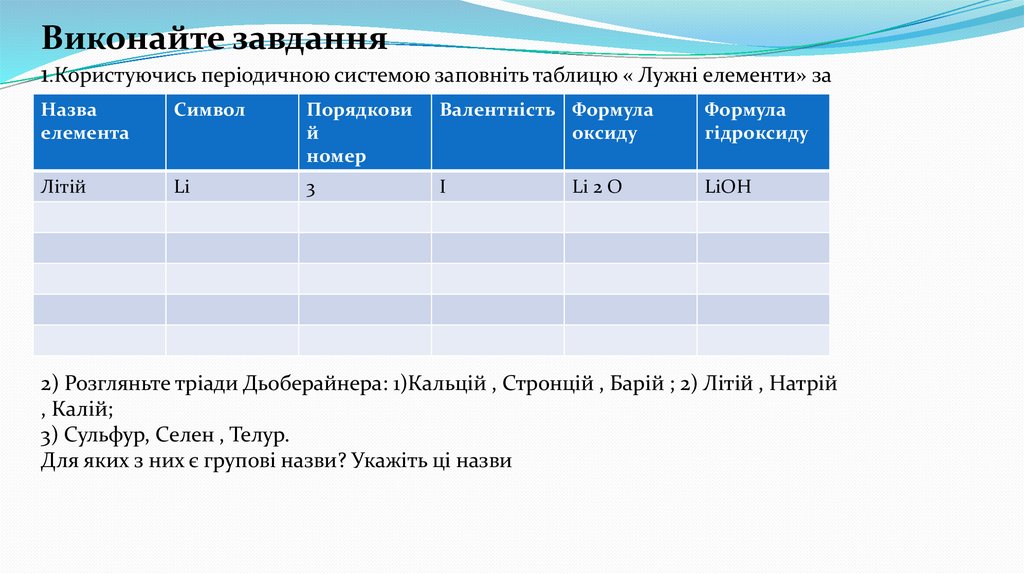
Виконайте завдання1.Користуючись періодичною системою заповніть таблицю « Лужні елементи» за
зразком
Назва
Символ
Порядкови
й
номер
Валентність Формула
оксиду
Формула
гідроксиду
Li
3
І
LiOH
елемента
Літій
Li 2 O
2) Розгляньте тріади Дьоберайнера: 1)Кальцій , Стронцій , Барій ; 2) Літій , Натрій
, Калій;
3) Сульфур, Селен , Телур.
Для яких з них є групові назви? Укажіть ці назви
19.
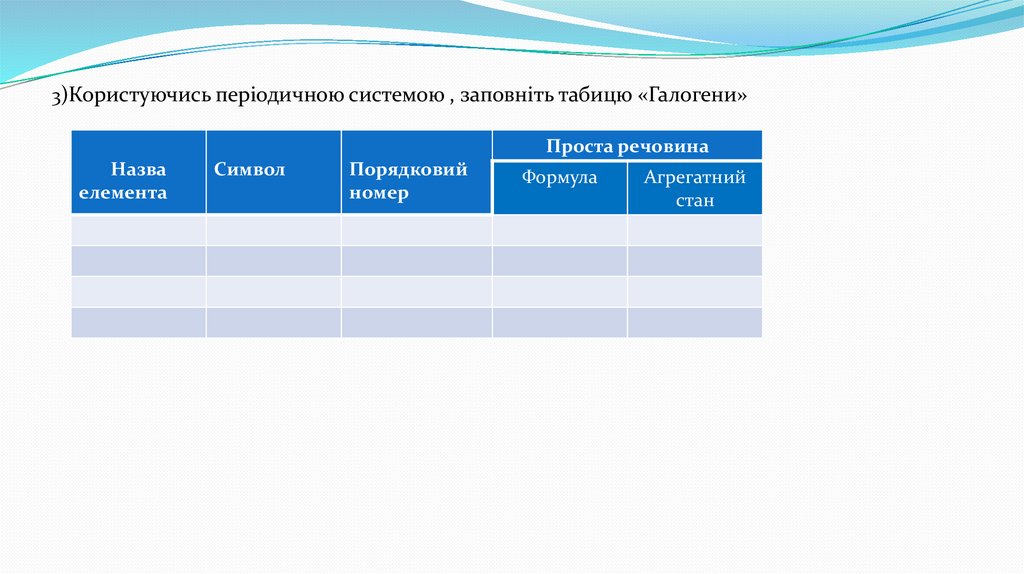
3)Користуючись періодичною системою , заповніть табицю «Галогени»Проста речовина
Назва
елемента
Символ
Порядковий
номер
Формула
Агрегатний
стан













 Химия
Химия








