Похожие презентации:
Задачи по химии
1. Глава 4 «Трудный путь»
Долго шла кислота по дороге.День был жаркий и она решила
отдохнуть, выпить сладкого чая.
Но как только кислота дотронулась
до сахара, то увидела нечто
странное - сахар обуглился.
Не утолив жажды, она села
отдохнуть под дерево и тут же
отскочила- дерево тоже обуглилось.
Это водоотнимающее свойство
кислоты используют для осушения газов. При этом
получаются кристаллогидраты серной кислоты(H2SO4∙nH2O )
С12H22O11 + H2SO4 → 12C + H2SO4∙11H2O
Узнав об этом замечательном свойстве, кислота снова
отправилась в путь.
2. Глава 5 «Ювелирный магазин»
К вечеру кислота дошла догорода. Первое, что она
увидела, была витрина
ювелирного магазина. Ей
захотелось примерить
украшения. Когда она надела
на пальчик колечки из меди
и серебра, они тут же
растворились. Только
изделия из золота и платины
остались в неизменном
виде. Почему?
3. Задание
Напишите уравнения окислительно –восстановительной реакции серебра
с концентрированной H2SO4
2Ag0 + 2H2S+6O4 (конц.) → Ag2+SO4 + S+4O2 + 2H2O
Ag0 – 1e- → Ag+ |2 окисление, восстановитель
S+6 + 2e- → S +4 |1 восстановление, окислитель
Au0 + H2SO4 (конц.) →
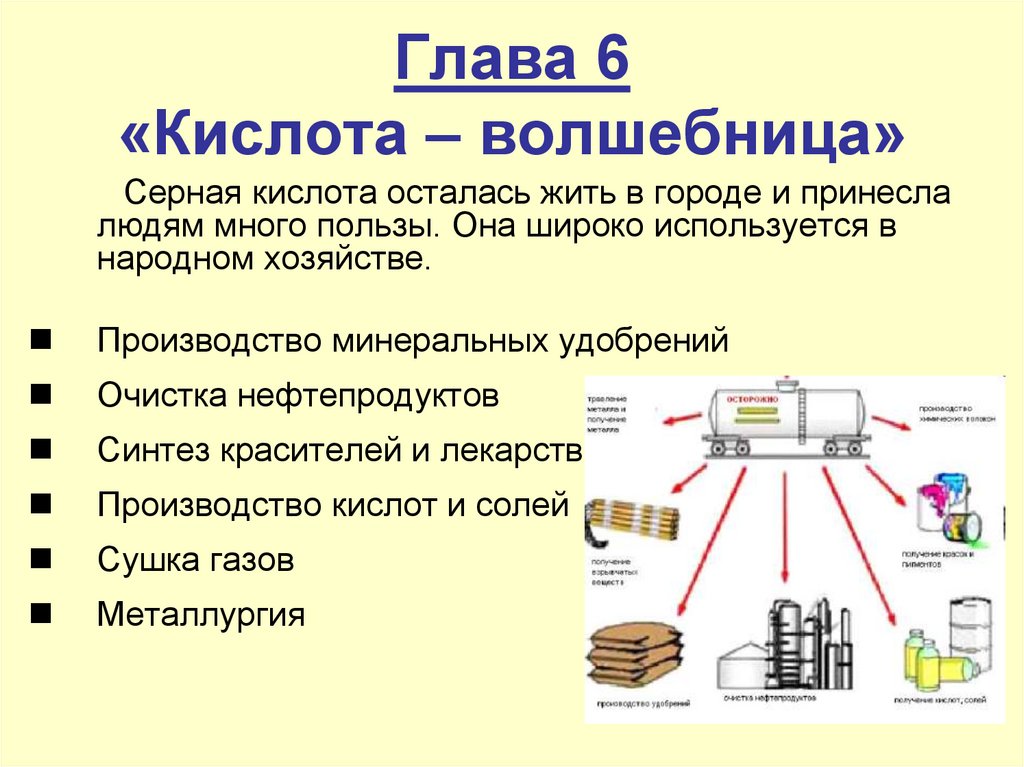
4. Глава 6 «Кислота – волшебница»
Серная кислота осталась жить в городе и принеслалюдям много пользы. Она широко используется в
народном хозяйстве.
Производство минеральных удобрений
Очистка нефтепродуктов
Синтез красителей и лекарств
Производство кислот и солей
Сушка газов
Металлургия
5.
Но все же кислота оставаласьволшебницей. В праздники она
устраивала «фейерверки в
цилиндре».
В основе этого опыта лежит окислительновосстановительная реакция, в результате которой
выделяется кислород. Он то и поджигает спирт в
цилиндре.
H2SO4(конц.) + KMnO4 → K2SO4 + MnSO4 + H2O + O2↑
6. Домашнее задание
1. Составить окислительно-восстановительнуюреакцию, представленную на предыдущем
слайде.
2. Решить задачу:
Какой объем кислорода выделится (н.у.) при
взаимодействии 318г KMnO4 и 98г
концентрированной H2SO4 ?





 Химия
Химия








