Похожие презентации:
Предельные углеводороды. Классификация органических веществ
1. ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ
2. Классификация органических веществ
ВЕЩЕСТВАУГЛЕВОДОРОДЫ
КИСЛОРОДСОДЕРЖАЩИЕ
ВЕЩЕСТВА
АЗОТ
СОДЕРЖАЩИЕ
ВЕЩЕСТВА
3. УГЛЕВОДОРОДЫ – это вещества, состоящие только из углерода и водорода
УГЛЕВОДОРОДЫЛИНЕЙНЫЕ
ПРЕДЕЛЬНЫЕ
НЕПРЕДЕЛЬНЫЕ
ЦИКЛИЧЕСКИЕ
АРОМАТИЧЕСКИЕ
4. Определение предельных углеводородов (ПУВ)
• ПУВ (АЛКАНЫ, ПАРАФИНЫ,НАСЫЩЕННЫЕ УВ) – это органические
вещества, в молекулах которых между
атомами углерода только одинарная
связь (С-С).
5. ГОМОЛОГИ – это вещества, которые отличаются количеством атомов углерода ( на группу СН2)
• ОБЩАЯ ФОРМУЛА АЛКАНОВ –СnН2n+2
Название алкана =
корень названия +
(мет, проп, бут, и далее
греч.числительные)
суффикс aн
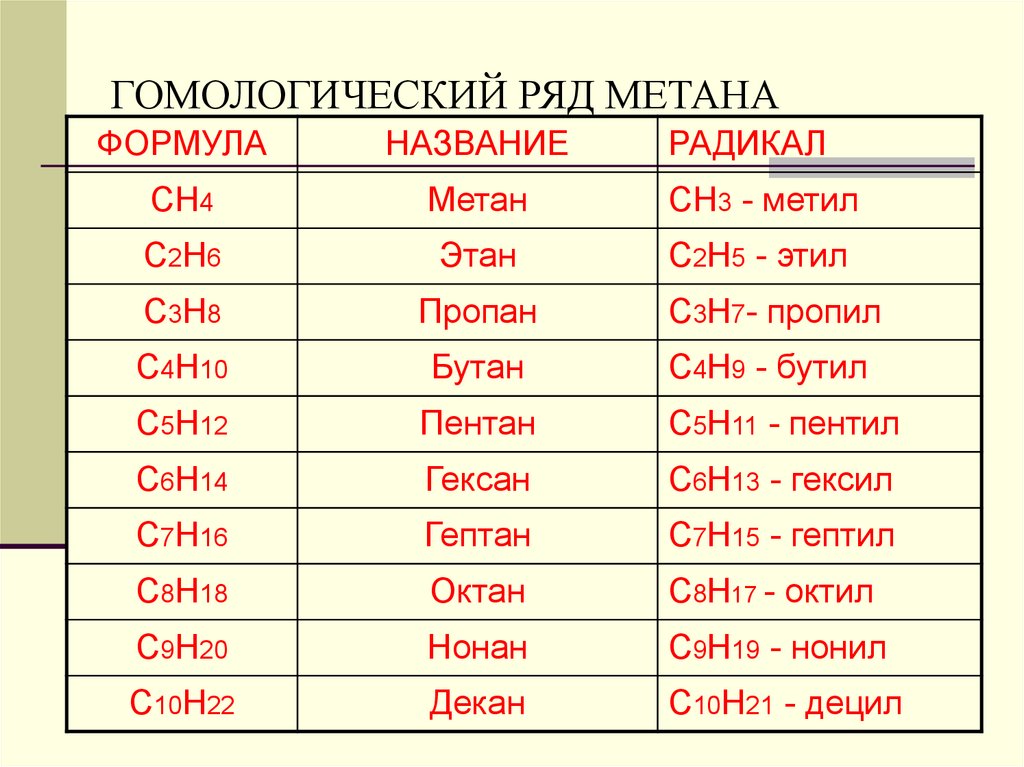
6. ГОМОЛОГИЧЕСКИЙ РЯД МЕТАНА
ФОРМУЛАНАЗВАНИЕ
РАДИКАЛ
СН4
Метан
СН3 - метил
С2Н6
Этан
С2Н5 - этил
С3Н8
Пропан
С3Н7- пропил
С4Н10
Бутан
С4Н9 - бутил
С5Н12
Пентан
С5Н11 - пентил
С6Н14
Гексан
С6Н13 - гексил
С7Н16
Гептан
С7Н15 - гептил
С8Н18
Октан
С8Н17 - октил
С9Н20
Нонан
С9Н19 - нонил
С10Н22
Декан
С10Н21 - децил
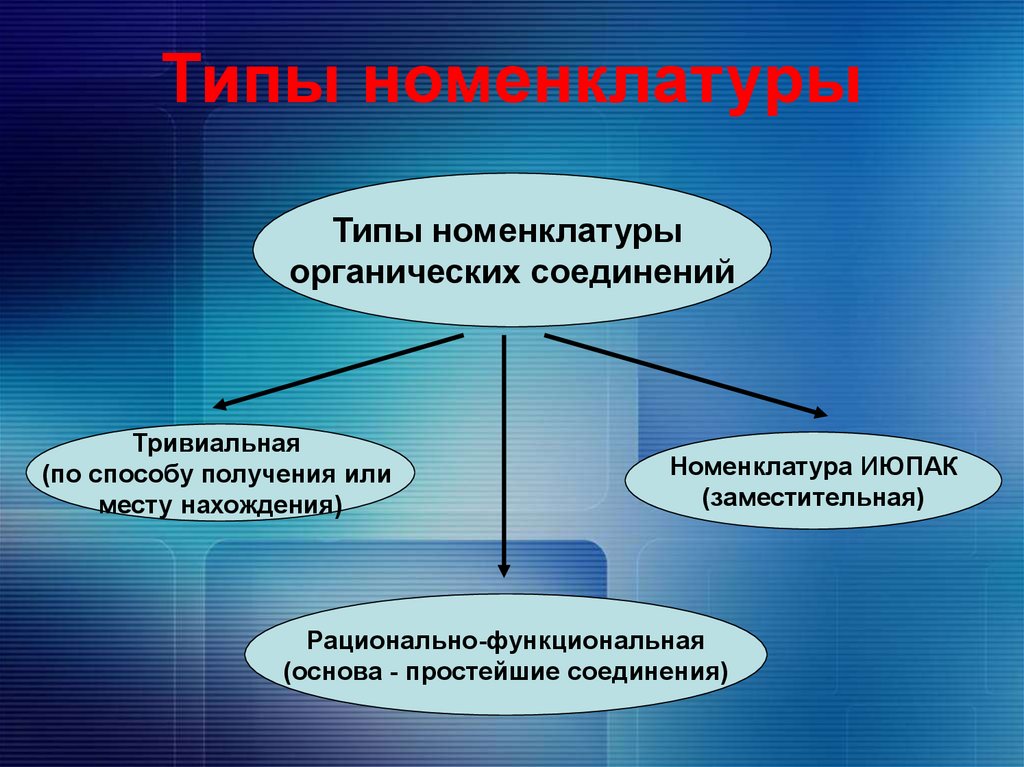
7. Типы номенклатуры
Типы номенклатурыорганических соединений
Тривиальная
(по способу получения или
месту нахождения)
Номенклатура ИЮПАК
(заместительная)
Рационально-функциональная
(основа - простейшие соединения)
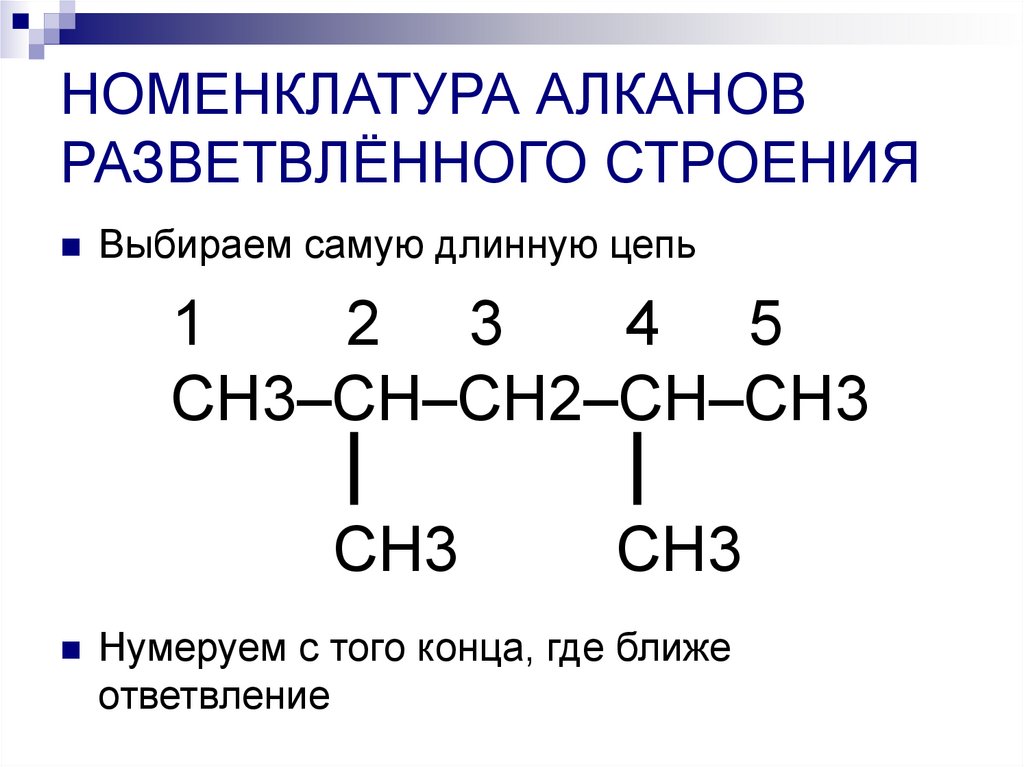
8. НОМЕНКЛАТУРА АЛКАНОВ РАЗВЕТВЛЁННОГО СТРОЕНИЯ
Выбираем самую длинную цепь1
2 3
4 5
СН3–СН–СН2–СН–СН3
СН3
СН3
Нумеруем с того конца, где ближе
ответвление
9.
• В названии на первом месте цифройуказываем положение радикалов. Если их
несколько, то:
• А) если они одинаковые, то повторяем цифру
столько раз, сколько радикалов; либо
указываем все цифры атомов
2, 2, 2 2,3,5 –
Б) если разные, то по старшинству и каждый в
отдельности.
Затем называем радикалы: если они
одинаковые, то их количество указываем
числит. ДИ, ТРИ, ТЕТРА, ПЕНТА и т.д; если
разные – каждый отдельно
2 – метил
В конце называем главную цепь по нумерации
(см. гомологический ряд)
2,4 –диметилпентан
10.
• Запишите все возможные изомерысостава С6Н14 и назовите их
• Назовите вещества:
СН3 – СН – СН – СН – СН3
СН3
С2Н5
СН3
11. Физические свойства алканов
• Алканы плохо растворимы в воде, но хорошорастворяются в органических растворителях.
• С1– С4 - газы
• С5– С7 - жидкости
• С8… - твёрдые вещества
• С увеличением молекулярной массы алканов,
в гомологическом ряду, повышаются
температуры кипения и плавления,
увеличивается плотность веществ.
12. Типы химических реакций, которые характерны для алканов
• Реакции замещения.• Реакции дегидрирования (разложения)
• Реакции горения.
13. Реакции присоединения
Галогенирование.1
CН3 – СН2 – СН3 + Сl – Сl
-
2
3
СН3 – СН – СН3
пропан
Cl
2-
хлорпропан
Реакция идёт только на свету.
14. Горение алканов
Алканы горят голубымпламенем.
С4Н10 + 9О2
бутан
4СО2 + 5Н2О
При недостатке кислорода
С4Н10 + 7О2
бутан
4СО + 5Н2О












 Химия
Химия








