Похожие презентации:
Простые вещества – неметаллы. Аллотропия. 8 класс
1. Презентация урока химии в 8 классе на тему: «Простые вещества – неметаллы. Аллотропия»
2. Тема урока: «Простые вещества – неметаллы. Аллотропия»
3. Цели урока:
• Получить представление о простыхвеществах – неметаллах;
• Познакомиться с общими физическими
свойствами неметаллов и явлением
аллотропии;
• Научиться определять принадлежность
веществ к неметаллам;
4. Проверка домашнего задания.
1. Где в периодической системенаходятся элементы,
соответствующие простым
веществам металлам?
5.
2. Каковы общие физическиесвойства металлов?
6.
3. По каким физическимсвойствам различаются
металлы?
7. 4. Какое из веществ названных в приведённом ниже стихотворении, не относится к металлам?
Семь металлов создал СветПо числу семи планет:
Медь, железо, серебро…
Дал нам Космос на добро.
Злато, олово, свинец…
Сын мой, сера - их отец.
А ещё ты должен знать:
Всем им ртуть – родная мать.
8. Изучение новой темы.
«Простые вещества –неметаллы. Аллотропия»
9.
• Неметаллы - это химическиеэлементы, которые образуют в
свободном виде простые
вещества, не обладающие
физическими свойствами
металлов.
10.
Периодическая система химических элементов Д.И. МенделееваГруппы элементов
Пери –
оды
I
1
Н
2
Li
3
Na
6.939
3
Литий
Калий
29
Cs
196,967
85,47
40,08
Бор
Алюминий
Скандий
VIII
VII
Ag 48
Сd In
112,40
114,82
55 Ва
132,905
Индий
56 57
137.34
Барий
*
138,81
204,37
[223]
Ртуть
87 Rа[226]
Франций
Радий
R2О
RO
138,81
8
15,9994
Кислород
F
Сера
Nе
9
Фтор
17 Cl
32,064
Хром
33 Se
74,9216
Мышьяк
41
92,906
Хлор
18,9984
Ar
17
18
Аргон
Селен
Марганец
34 Br
78,96
Молибден
51 Тe
121,75
Сурьма
Тантал
82 Вi
207,19
Свинец
** Ас 104 Rf
Бром
52 I
Теллур
Железо
Кобальт
39,948
[261]
83 Ро
208,980
44
101,07
Ru 45
Rh 46
Pd
102,905
106,4
Рутений
Родий
Йод
Висмут
84 At
Полоний
105 Db 106 Sg
[262]
[263]
Сиборгий
Осмий
210
Иридий
Астат
107 Bh 108 Hs 109 Мt
Борий
RO2
R2O5
RO3
R2O7
RH4
RH3
RH2
RH
54
131,30
Ксенон
78
195,09
Рt
Платина
Rn
85
[262]
Палладий
Xe
53
[210]
36
83,80
Криптон
126,9044
Рений
Никель
Кr
35
79,904
Технеций
78,96
Вольфрам
Актиний Резерфордий Дубний
R2O3
10
20,183
Неон
35,453
Nb 42
Мо 43
Тс
[99]
95,94
Ниобий
50 Sb
118,69
Гафний
81 Pb
Таллий
88 89
О
La 72
Hf 73
W 75
Re 76
Ir
Та 74
Оs 77
178.49
180,948
183.85
186,2
190,2
192,2
Лантан
Hg ТI
Аu 80
200,59
Фосфор
32 As
72,59
Цирконий
Олово
Гелий
15 S
30,9738
Ванадий
Германий
49 Sn
Азот
7
14,0067
2
4.0026
Ti 23
V 24
Cr 25
Fe 27
Мn 26
Со 28
50,942
51,996
44,956
55,847
58,9332
58,71 Ni
Y 40
Zr
91,22
Иттрий
N
14 P
28,086
Кремний
31 Ge
88,905
Кадмий
Углерод
Титан
26,9815
38 39
Стронций
6
12,01115
Sc 22
47,90
44,956
Галлий
87,62
С
13 Si
26,9815
20 21
Кальций
37 Sr
Золото
Fr
5
10,811
12 Al
24,312
Цинк
Цезий
79
В
Сu 30
Zn Ga
65,37
Рубидий
47
4
9,0122
Магний
19 Сa
Серебро
ЛВС
Ве
11 Мg
22,9898
39,102
107,868
Высшие
оксиды
VI
Не
Бериллий
Натрий
Rb
7
V
Водород
Медь
6
IV
1
63,546
5
III
1,00797
К
4
II
[265]
Хассий
[266]
Мейтнерий
RO4
Радон
86
[222]
11.
НеметаллыГазообразные
Жидкие
Твёрдые
12. Газообразные вещества неметаллы:
• О2 • N2 • H2 • Cl2 • F2 -13.
N2Cl2
F2
В начало
14. благородные газы:
He Ne Ar Kr Xe Rn -• Инертные газы
• Каждая молекула
инертного газа
состоит из одного
атома.
• Покажите как
распределяются
электроны в атомах
гелия и неона.
15. Строение внешнего электронного слоя атомов гелия и неона
Ne)
)
)
He
+10
+2
2
2
8
16. Применение гелия, неона и аргона.
17. Единственное жидкое вещество - Br2.
18. Твердые вещества:
• S–• P–
• I2 –
• C–
• Si -
19. Аллотропия – способность атомов одного химического элемента образовывать несколько простых веществ.
Причины аллотропии:1. Различное число атомов в молекуле;
2. Образование различных
кристаллических форм.
20. Аллотропия кислорода. Кислород и озон
21. Модификации кислорода.
• О2- кислород;• бесцветный газ;
• не имеет запаха;
• плохо растворим в
воде;
• температура
кипения-182,9 С;
• устойчивая
молекула.
• О3 – озон;
• газ голубого цвета;
• имеет резкий запах;
• растворяется в 10
раз лучше, чем
кислород;
• температура
кипения -111,9 С;
• не устойчивая
молекула.
22. Аллотропия фосфора. Красный и белый фосфор
•Р(красный фосфор)
• Р4
• (белый фосфор)
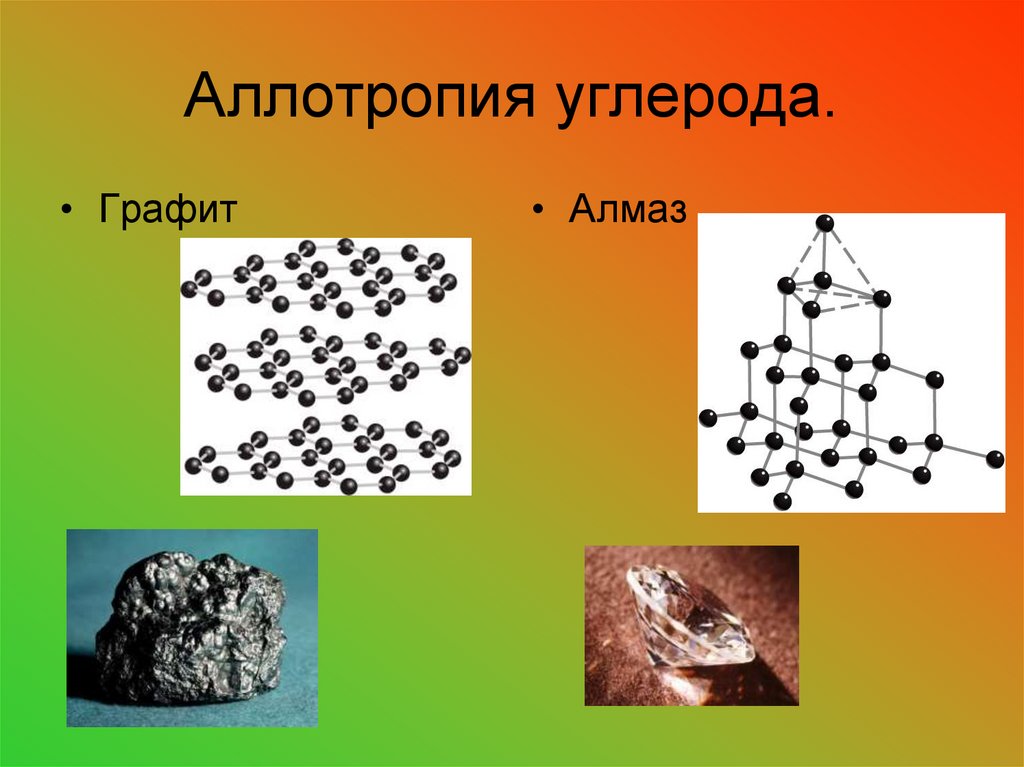
23. Аллотропия углерода.
• Графит• Алмаз
24. Аллотропия серы. Кристаллическая, пластическая и моноклинная
25. Пограничное положение между металлами и неметаллами.
•Белоеолово
•металл
•Серое
олово
•неметалл
26.
Почему химически невернопоэтическое выражение:
«В воздухе пахло грозой»?
27.
• Экспедиция полярногоисследователя Р. Скотта к
Южному полюсу в 1912 году
погибла из-за того, что
потеряла весь запас горючего:
оно находилось в запаянных
оловом баках. Какой
химический процесс лежал в
основе этого?
28.
• Какой тип химической связидолжен быть в
металлическом водороде?
29. Выполните задание.
• 1 вариант• О2 – кислород, газ;
• Р4 –
• I2 –
• Si –
• бетта Sn –
• He –
• H2 –
• F2 -
• 2 вариант
• О3 –озон, газ;
• P–
• C–
• альфа Sn –
• Ne –
• N2 –
• Cl2 –
• Br2 –
30. Проверь ответы.
• 1 вариант• О2 – кислород, газ;
• Р4 – белый
фосфор,твёрдый;
• I2 – йод, твердый
• Si – кремний, твердый
• бетта Sn – белое олово,
металл, твёрдое;
• He – гелий,
благородный газ;
• H2 – водород, газ;
• F2 – фтор, газ.
• 2 вариант
• О3 –озон, газ;
• P – красный фосфор,
твёрдый;
• C – углерод, твёрдый;
• альфа Sn – серое
олово, неметалл,
порошок;
• Ne – неон,благородный
газ;
• N2 – азот, газ;
• Cl2 – хлор, газ;
• Br2 – бром, жидкость.
31. Критерии оценок
• 8 правильных ответов – «5»;• 7,6 првильных ответов – «4»;
• 5,4 правильных ответов – «3»;
• Менее 4 правильных ответов – «2»;






























 Химия
Химия








