Похожие презентации:
Вода в химической промышленности
1.
Лекция 4ВОДА В ХИМИЧЕСКОЙ ПРОМЫШЛЕННОСТИ
Содержание
1.Классификация воды
2.Показатели качества воды
3.Промышленная водоподготовка
2.
ВОДА - самая обильная из земных стихий. Древниеговорили, где есть вода – там жизнь.
Вода - самое распространенное на
земле
вещество.
Почти
3/4
поверхности земного шара покрыты
водой. Гидросфера земли занимает
71% всей биосферы. Общие запасы
воды на земле составляют 1\800 часть
объема всей планеты и основная
часть приходится на мировой океан.
Без воды немыслима жизнь на
планете
Земля,
немыслима
жизнедеятельность человека. Именно
доступность и незаменимость воды
обусловила ее широкое применение
в
различных
областях
жизни
человека.
3.
Химическая промышленность - один из самых крупныхпотребителей воды. Расход воды в химических
производствах очень велик. На отдельных химических
предприятиях потребление воды достигает 1 млн. м3 в
сутки. Вода расходуется на промывку, охлаждение
агрегатов, разбавление сточных промышленных вод.
Масштабы
потребления
воды
химической
промышленностью зависят от типа производства и
колеблются в широких пределах.
Так, расходные коэффициенты по воде (в м3 на тонну продукции) составляют: для азотной
кислоты 200, вискозного волокна 1200, аммиака 1500, синтетического каучука 1600,
капронового волокна 2500.Например, завод капронового волокна расходует такое же
количество воды как город с населением 120000 человек, а специализированный завод
пластических масс по потреблению воды эквивалентен городу с населением 400000
человек.
4.
Превращение воды в один из важнейших элементовхимического производства объясняется:
- наличием комплекса ценных свойств
(высокая теплоемкость, малая вязкость,
низкая температура кипения и др.);
- доступностью и дешевизной (затраты
исключительно на извлечение и очистку);
- нетоксичностью;
- удобством использования в
производстве и транспортировки.
5.
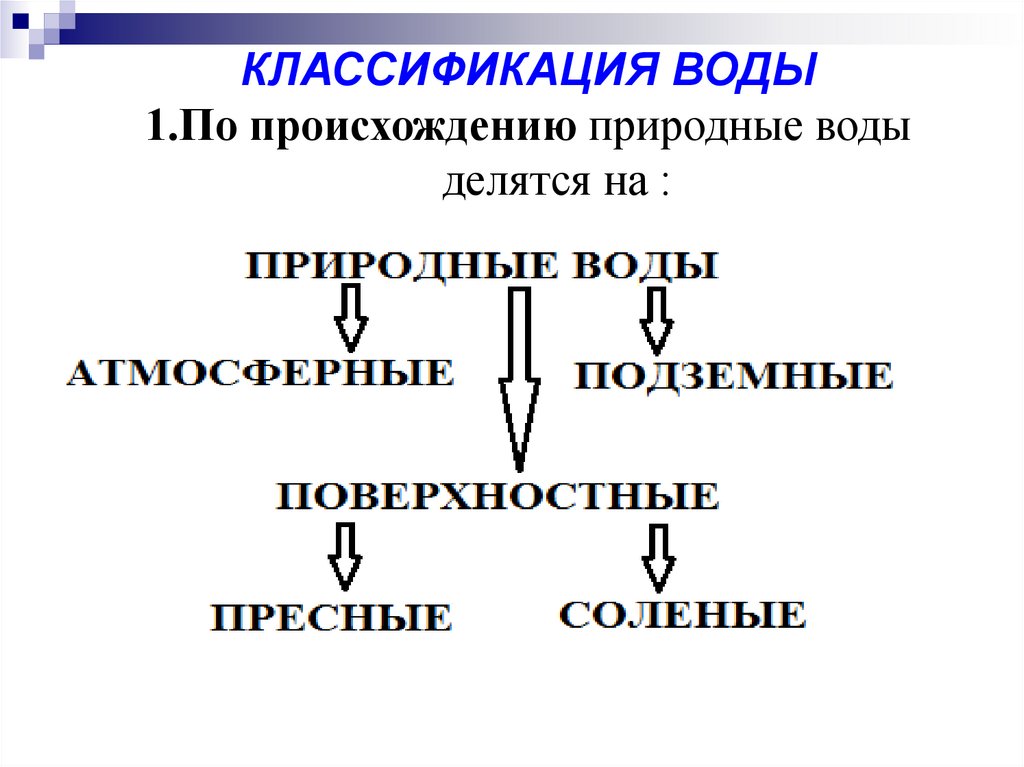
КЛАССИФИКАЦИЯ ВОДЫ1.По происхождению природные воды
делятся на :
6.
Атмосферная вода, выпадающая в виде дождя и снега,содержит минимальное количество примесей, главным
образом, в виде растворенных газов (кислорода, оксида
углерода (II), азота, сероводорода), бактерий, а в
промышленных районах также оксиды азота и серы и
различные органические вещества.
Поверхностные воды представляют воды открытых
водоемов: рек, озер, каналов, водохранилищ. В состав
поверхностных вод входят различные минеральные и
органические вещества.
Подземные воды – воды артезианских скважин, колодцев,
ключей, гейзеров. Они характеризуются значительным
содержанием минеральных солей.
7.
Природнаявода,
представляет
собой
сложную
многокомпонентную систему, в состав которой входят
минеральные вещества, газы, коллоидные и крупнодисперсные
частицы, микроорганизмы.
Многообразие примесей в природных водах не позволяет
создать единую их классификацию по какому-либо одному
признаку, поэтому принято классифицировать эти примеси по
нескольким признакам. Разнообразие же классификаций дает
наиболее объективную картину.
8.
1.По степени дисперсности примеси природных вод могут бытьразделены на грубодисперсные, коллоидно-дисперсные и истиннорастворенные примеси.
2.По химическому характеру примеси разделяются на: газовые,
минеральные и органические.
3.По солесодержанию природные воды разделяются на пресные (<1
г/кг), солоноватые (1—25 г/кг) и соленые (>25 г/кг).
В свою
очередь
пресные воды можно
подразделить на
маломинерализованные
(<0,2 г/кг),
средней
минерализации
(0,2—0,5 г/кг) и повышенной минерализации (0,5—1,0 г/кг).
9.
4.По значению общей жесткости, мг-экв/кг, природные водыклассифицируются: Ж0<1,5 — воды с малой жесткостью; Ж0 = 1,5 – 3
— воды со средней жесткостью; Ж0 =4 -6 — воды с повышенной
жесткостью; Ж0=6-12—воды с высокой жесткостью и Ж0>12 воды с
очень высокой жесткостью.
5) По содержание соответствующих анионов и катионов. Все
природные воды подразделяются на три класса: гидрокарбонатные
(в которых преобладает анион НСО3- ), сульфатные (преобладает SO42-) и
хлоридные (преобладает С1-). Каждый класс подразделяется
по
преобладающему катиону на группы: кальциевую, магниевую,
натриевую. (Свыше 80% всех рек РФ обладает водами гидрокарбонатного
класса).
6)По степени загрязненности органическими веществами природные
воды можно разделить на четыре группы, характеризующиеся
определенной окисляемостью, мг О2/кг: меньше 5—малая, 5—
10—средняя, 10—20—повышенная и свыше 20—сильная.
10.
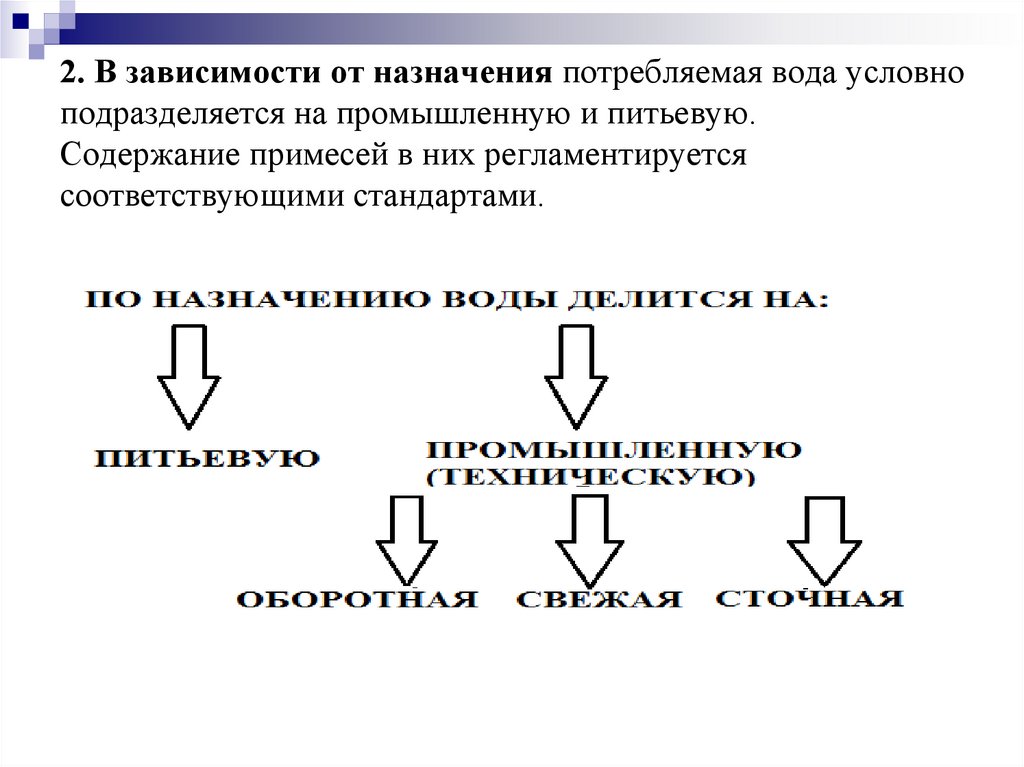
2. В зависимости от назначения потребляемая вода условноподразделяется на промышленную и питьевую.
Содержание примесей в них регламентируется
соответствующими стандартами.
11.
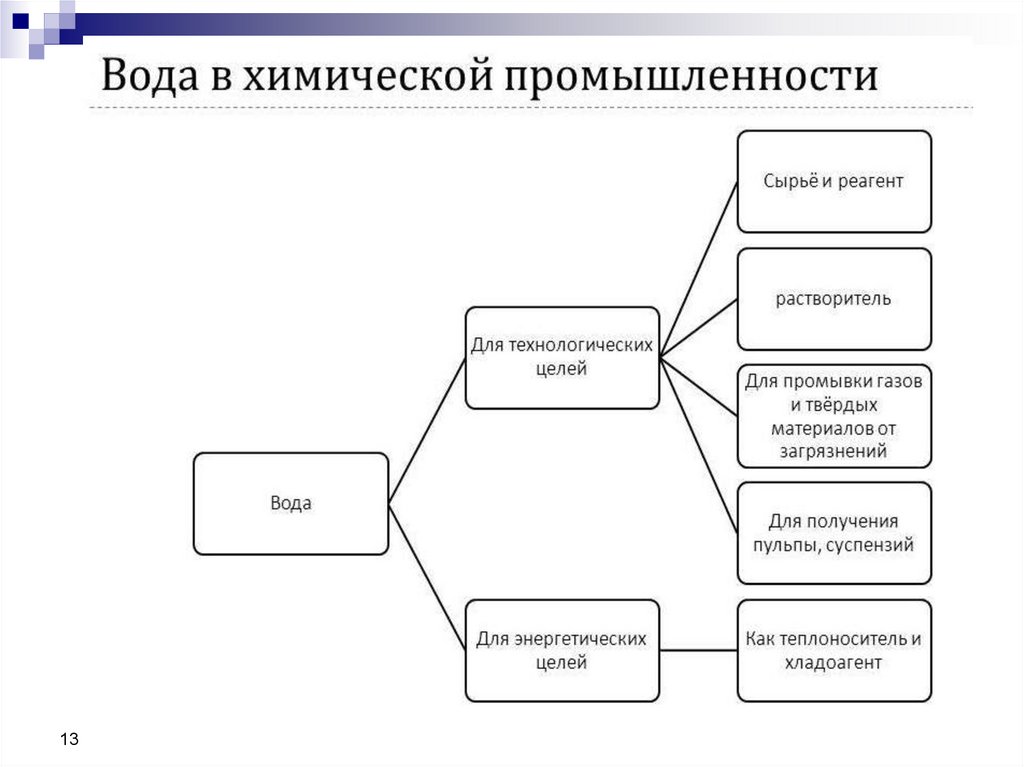
В химической промышленности вода используется вследующих направлениях:
1.для технологических целей в качестве:
- растворителя твердых, жидких и газообразных
веществ;
-среды для осуществления физических и
механических процессов (флотация, транспортировка
твердых материалов в виде пульпы и др.);
- промывной жидкости для газов;
- экстрагента и абсорбента различных веществ;
12.
2.как теплоноситель (в виде горячей воды и пара) ихладагента для обогрева и охлаждения аппаратуры;
3. в качестве сырья и реагента для производства
различной химической продукции (например,
водорода, ацетилена, серной и азотной кислот и др.).
13.
1314.
2. ПОКАЗАТЕЛИ КАЧЕСТВА ВОДЫВода, используемая в химической промышленности
(технологическая вода) должна удовлетворять по качеству
определенным требованиям того или иного производства.
Качество воды определяется ее физическими и
химическими
характеристиками,
такими,
как
прозрачность,
цвет,
запах,
температура,
общее
солесодержание, жесткость, окисляемость и реакция воды.
Эти характеристики показывают наличие или отсутствие
тех или иных примесей. Для промышленных вод
важнейшими из этих характеристик являются жесткость,
окисляемость, реакция и содержание примесей различной
дисперсности.
15.
Жесткость воды является одним из важнейшихпоказателей при использовании воды. Различают
следующие виды жесткости.
В зависимости от природы анионов различают временную
(карбонатную) жесткость, зависящую от наличия в воде
бикарбонат НСО3- ионов , и постоянную (некарбонатную)
жесткость, вызываемую присутствием хлорид-ионов и
сульфат-ионов .
Сумма временной и постоянной жесткостей называется
общей жесткостью воды:
Ж0=Жк+Жнк
16.
Окисляемость.Это
показатель
характеризующий
содержание в воде органических веществ. Их обычно
определяют по количеству окислителя , расходуемого на
их окисление. При этом, как правило, пользуются
перманганатом калия КМnО4 или эквивалентом его
количества кислорода, затраченного на окисление 1 литра
воды, то есть мг/л.
Активная реакция воды характеризует ее кислотность и
щелочность. Она зависит от присутствия в воде
некоторых газов, реагирующих с водой (хлор, оксид
углерода и др.), растворимых гуминовых кислот и
веществ, вносимых в водоем промышленными стоками.
Для большинства природных вод активная среда
характеризуется величиной рН = 6,5 – 8,5.
17.
Требования, предъявляемые к качествупитьевой воды
Запах и привкус не более 2 баллов
Цветность не более 20°
Прозрачность по шрифту не менее
30 см
Общая жесткость воды не более 10
мг-кв/л
Требования первой группы
обязательны для всех
хозяйственно-питьевых систем
централизованного водоснабжения
мутность осветленной воды не
более 2 мг/л
содержание железа не более 0,3
мг/л
активная реакция рН при
осветлении и умягчении воды не
менее 6,5 и не более 9,5
содержание остаточного активного
хлора не менее 0,3 и не более 0,5
мг/л.
Требования второй группы должны
соблюдаться при наличии в системе
водоснабжения очистных
сооружений
18.
Требования, предъявляемые к качествупроизводственной воды
На производстве вода используется в качестве охлаждения
оборудования.
В воде не должно содержаться много взвешенных частиц
Должна иметь небольшую карбонатную жесткость
(не более 4—5 мг∙экв/л)
Вода не должна нагреваться выше 30—50°С.
19.
Т.о. для заключения пригодности использования воды длябытового или промышленного назначения необходим
анализ химического состава воды.
Требования,
предъявляемые
к
воде,
обязательно
указываются в технологических регламентах конкретных
химических
производств
и
регламентируются
соответствующими ГОСТами.
Пресная
природная
вода
используется
без
предварительной очистки в процессах первичной
обработки сырья, для охлаждения продуктов и аппаратов
и для различных вспомогательных операций. Во всех
остальных случаях она подвергается очистке различными
методами в зависимости от характера примесей и
предъявляемых требований.
20.
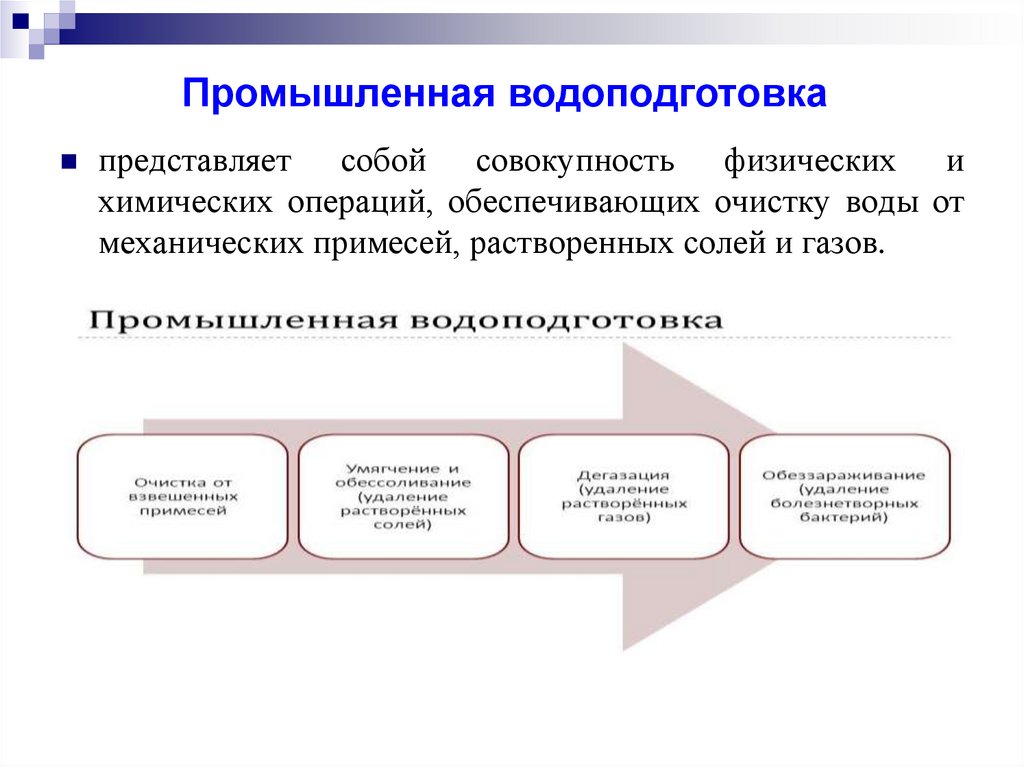
Промышленная водоподготовкапредставляет собой совокупность физических и
химических операций, обеспечивающих очистку воды от
механических примесей, растворенных солей и газов.
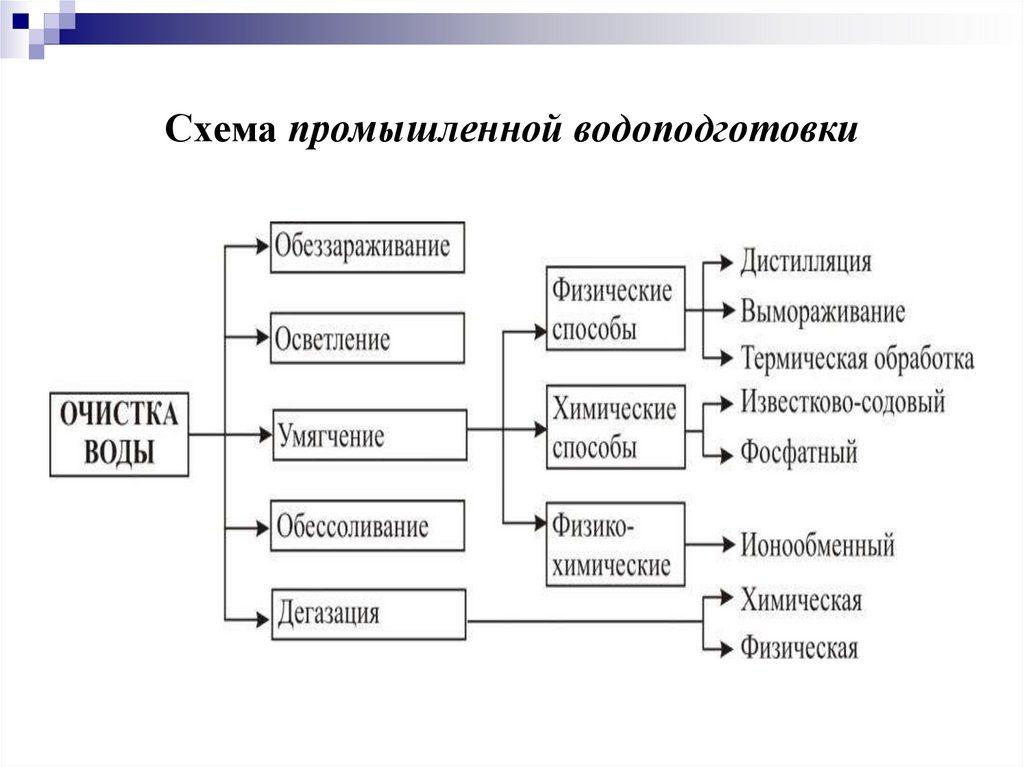
21.
Схема промышленной водоподготовки22.
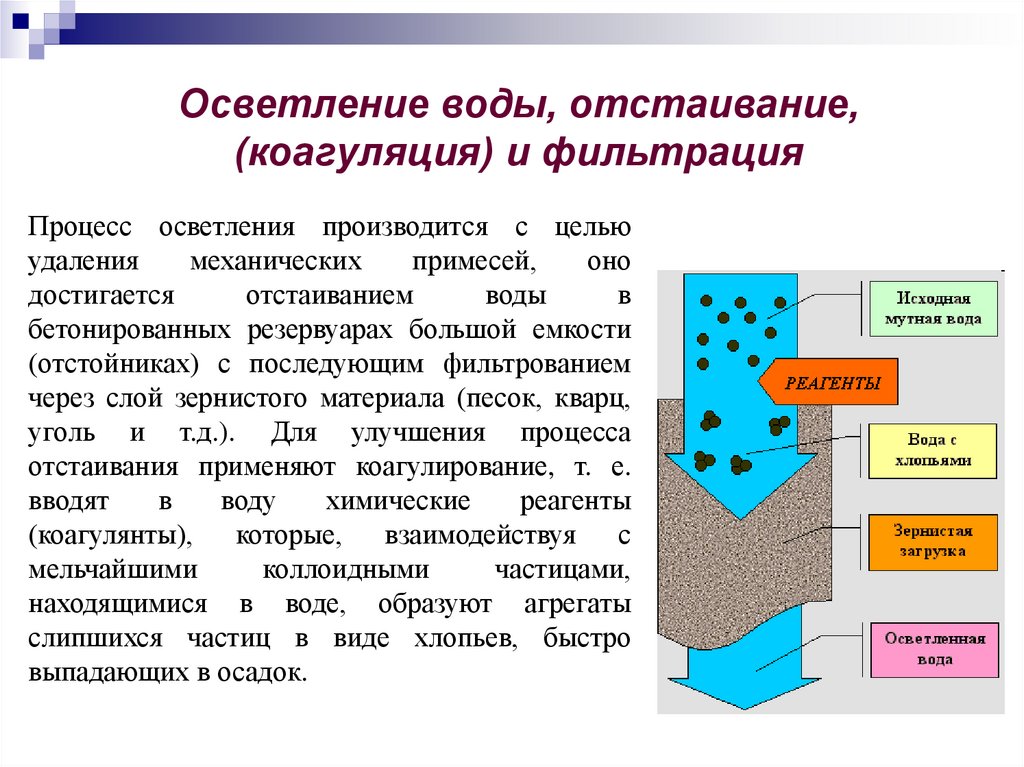
Осветление воды, отстаивание,(коагуляция) и фильтрация
Процесс осветления производится с целью
удаления
механических
примесей,
оно
достигается
отстаиванием
воды
в
бетонированных резервуарах большой емкости
(отстойниках) с последующим фильтрованием
через слой зернистого материала (песок, кварц,
уголь и т.д.). Для улучшения процесса
отстаивания применяют коагулирование, т. е.
вводят
в
воду
химические
реагенты
(коагулянты), которые, взаимодействуя с
мельчайшими
коллоидными
частицами,
находящимися в воде, образуют агрегаты
слипшихся частиц в виде хлопьев, быстро
выпадающих в осадок.
23.
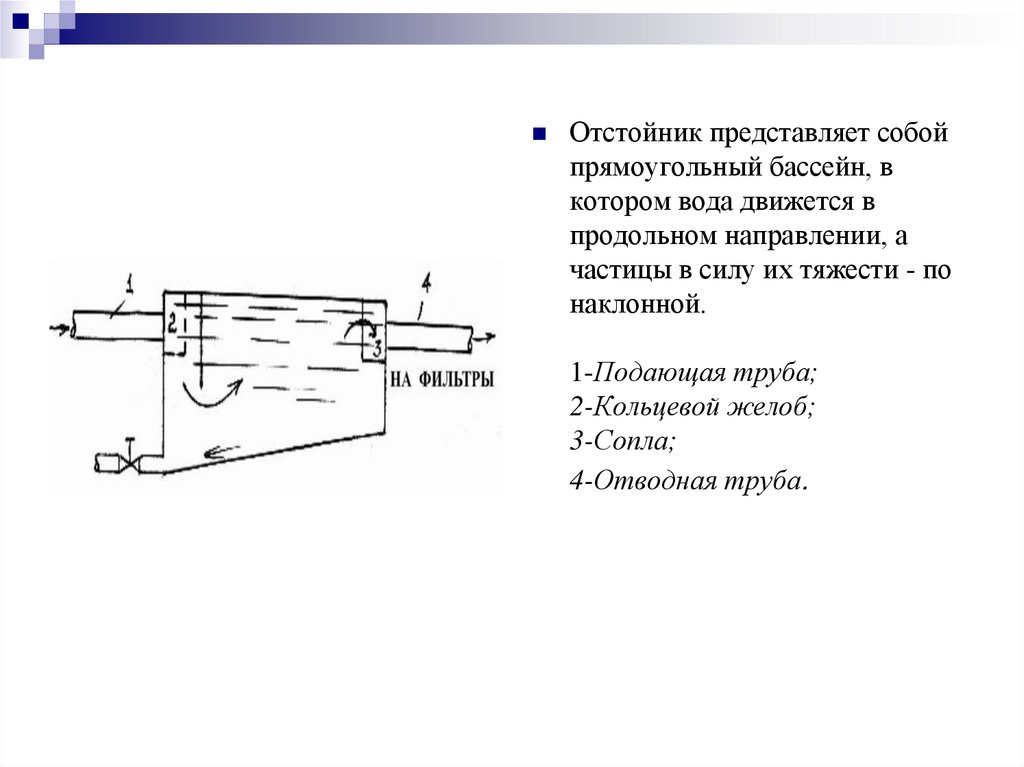
Отстойник представляет собойпрямоугольный бассейн, в
котором вода движется в
продольном направлении, а
частицы в силу их тяжести - по
наклонной.
1-Подающая труба;
2-Кольцевой желоб;
3-Сопла;
4-Отводная труба.
24.
ФильтрованиеОтстаивание от крупных частиц осуществляется в непрерывнодействующих отстойниках большой емкости, от мелких частиц
освобождаются фильтрованием.
Фильтрование представляет собой сложный процесс очистки воды от
примесей при течении воды через пористую среду. Крупные частицы
удаляются из воды отстаиванием. Для очистки же от взвеси воду
фильтруют через слой зернистой загрузки (песка, керамзита,
антрацита). При медленной скорости взвесь задерживается верхними
слоями фильтра, при больших скоростях - толщей фильтрующего
слоя. При этом происходит физическая адсорбция загрязнений на
зернах фильтра. Чем крупнее зерна загрузки и чем больше скорость
фильтрования, тем на большую глубину проникают загрязнения.
Различают быстрые, медленные, осветлительные фильтры и
микрофильтры.
25.
В водопроводной практике в качестве основного фильтрующегоматериала применяют кварцевый песок, дробленый антрацит,
сульфоуголь, целлюлозу, перлит и др.
В настоящее время предлагаются и новые фильтрующие материалы,
обладающие повышенной емкостью поглощения и эффективностью
очистки воды: керамзит, вулканические шлаки, горелые породы,
шунгизит и др. Для очистки воды от ГДП успешно применяют
плавающие загрузки из гранул вспененного полистирола,
газонаполненных гранул керамзита и др.
Все применяемые фильтрующие материалы должны обладать
высокой механической прочностью, химической стойкостью,
правильно подобранным фракционным составом.
26.
КоагуляцияДля
удаления
коллоидных
частиц
(мельчайших глинистых частиц и
белковых
веществ)
используется
коагуляция
с
последующей
фильтрацией от выпавшего осадка.
Под коагуляцией понимают физикохимический
процесс
слипания
коллоидных частиц и образования
грубодисперсной макрофазы (флокул) с
последующим ее выделением из воды.
27.
В качестве коагулянтов, обычно применяют сернокислые солиА12(SО4)3 и FеSО4. Эти соли в воде почти полностью диссоциируют:
А l 2(SО4)3 ↔ 2А l 3+ + 3SО2-4;
FеSО4 ↔ Fе2++ SО2-4
Катионы слабых оснований Аl3+ и Fе2+ легко подвергаются гидролизу.
Так, гидролиз ионов А13+ протекает следующим образом:
Аl3++Н2О ↔ А l (ОН)2+ + Н + ;
А l (ОН)2++Н2О ↔ А l (ОН)2+ + Н + ;
А l(ОН)2+ + Н20 ↔ А l (ОН)3 + Н +
28.
гидролиз ионов Fе2+:
Fе2 + +Н2О ↔ Fе(ОН)+ + Н + ;
Fе(ОН)++Н2О ↔ Fе(ОН)2 + Н + .
В щелочной среде (рН>8) и при достаточном количестве кислорода:
4Fе(ОН)2 + О2 + 2Н2О ↔ 4Fе(ОН)3
Полный гидролиз ионов А13+ и Fе2+ возможен лишь при условии
отвода ионов Н +. В природной воде связывание этих ионов
происходит согласно реакции
Н++НСО3-↔ Н2СО3 + СО2 + Н20,
поэтому наличие бикарбонат-ионов в воде является необходимым
условием для обеспечения глубокого протекания процесса гидролиза.
При недостаточной величине щелочности концентрация ионов Н+
может регулироваться введением NаОН, но это приводит к
увеличению солесодержания воды.
29.
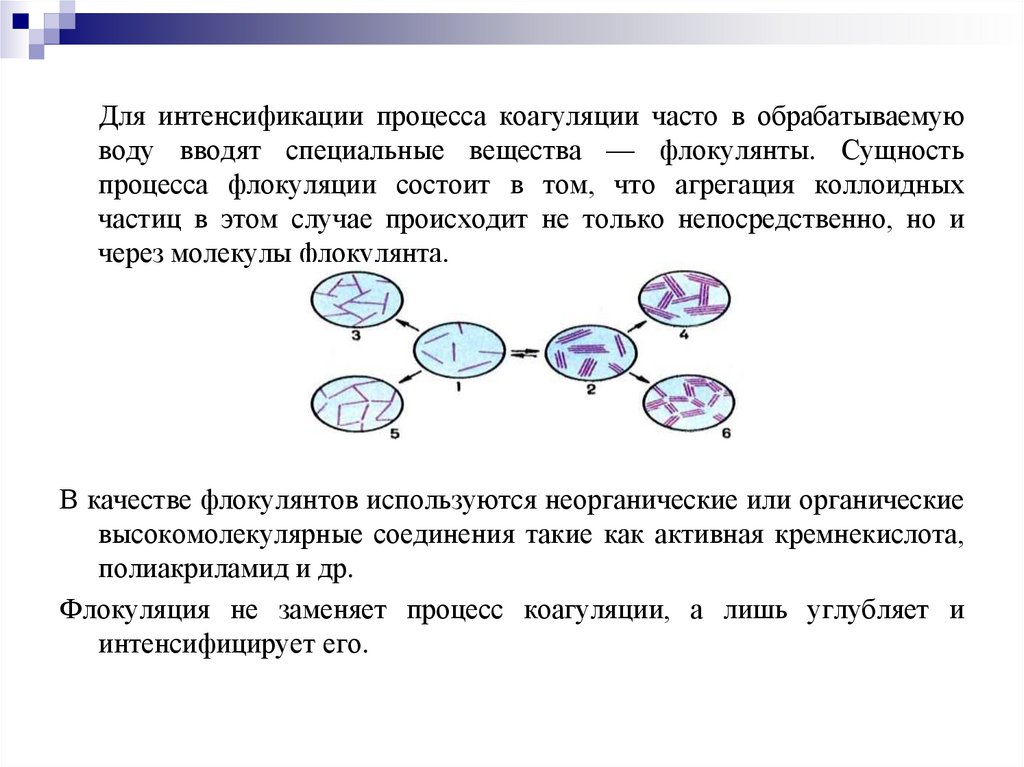
Для интенсификации процесса коагуляции часто в обрабатываемуюводу вводят специальные вещества — флокулянты. Сущность
процесса флокуляции состоит в том, что агрегация коллоидных
частиц в этом случае происходит не только непосредственно, но и
через молекулы флокулянта.
В качестве флокулянтов используются неорганические или органические
высокомолекулярные соединения такие как активная кремнекислота,
полиакриламид и др.
Флокуляция не заменяет процесс коагуляции, а лишь углубляет и
интенсифицирует его.
30.
ОбессоливаниеОбессоливание применяется в тех производствах, где к воде
предъявляются особо жесткие требования по чистоте, например при
получении полупроводниковых материалов, химически чистых
реактивов, фармацевтических препаратов. Обессоливание воды
достигается методом ионного обмена, дистилляцией и электродиализом.
Полное обессоливание воды обеспечивается ее дистилляцией
(термическое обессоливание) обычно после того, как вода
предварительно очистится с помощью ионитовых фильтров.
Вода последовательно проходит через катионитный и анионитный
фильтры и поступает, распыляясь в дегазатор, где из нее удаляются
растворенные диоксид углерода, кислород и другие газы.
Метод ионного обмена основан на свойстве некоторых твердых тел
(ионитов) поглощать из раствора ионы в обмен на эквивалентное
количество других ионов того же знака.
31.
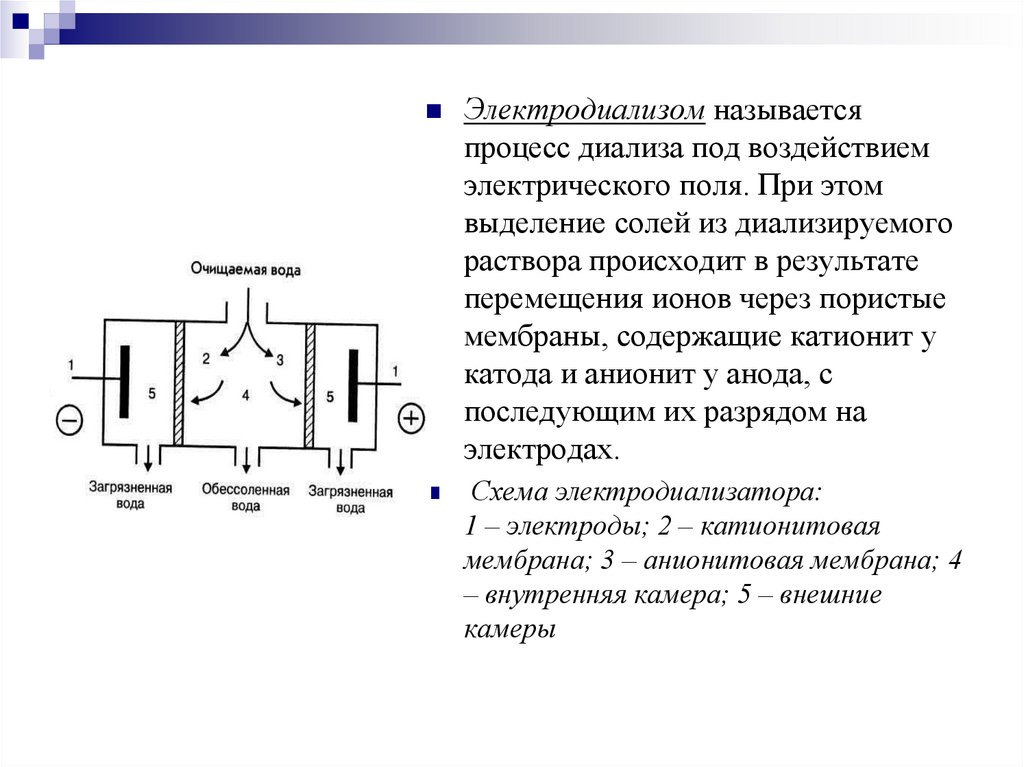
Электродиализом называетсяпроцесс диализа под воздействием
электрического поля. При этом
выделение солей из диализируемого
раствора происходит в результате
перемещения ионов через пористые
мембраны, содержащие катионит у
катода и анионит у анода, с
последующим их разрядом на
электродах.
Схема электродиализатора:
1 – электроды; 2 – катионитовая
мембрана; 3 – анионитовая мембрана; 4
– внутренняя камера; 5 – внешние
камеры
32.
Дистилляция воды- это её испарение с последующим охлаждением и конденсацией паров (перегонка).
Дистилляция производится с целью освобождения
жидкости от взвешенных в ней примесей или для
выделения более летучих частей. Дистиллированная вода
- чистая, без всяких примесей, идет для изготовления
лекарств и пр.
Дистиллированная
вода
для
постоянного
употребления непригодна,
так как не содержит
микроэлементов,
необходимых
организму.
Постоянное
применение
дистиллированной
воды
приводит к нарушениям
иммунной
системы,
сердечного
ритма,
процесса
переваривания
пищи
33.
ОбеззараживаниеДля обеззараживания воду дезинфицируют с помощью
реагентов, убивающих болезнетворные (патогенные)
микроорганизмы.
К
этим
реагентам
относятся
газообразный хлор и хлорсодержащие вещества (хлорная
известь, хлорамины, диоксид хлора, гипохлориты), озон,
иод, серебро и физические агенты (ультрафиолетовые
лучи, ультразвук и др.).
34.
Хлорирование водыВ практике водоочистки пользуются чаще всего хлором и
хлорсодержащими веществами. При введении в воду хлора и
хлорсодержащих веществ происходит их гидролиз и образование
НС1О:
Cl2+H2O = HCl+HClO; 2CaCl2O + 2H2O = CaCl2+Ca(OH)2+2HСlO;
NaOCl+H2O=NaOH+HOCl; NaOCl+H2CO3 =NaHCO3+HClO;
Ca(OCl)2+2Н2О 2HOCl+Са(ОН)2.
Из всех соединений хлора наиболее эффективным реагентом является
хлорноватистая кислота. Считается, что хлорноватистая кислота
вступает в реакцию с ферментами бактерий и тем самым нарушает
обмен веществ в бактериальной клетке. Эффект действия хлора на
микробы зависит от начальной дозы хлора, продолжительности
сохранения его в воде и рН воды.
Хлор расходуется на окисление примесей как органического так и
неорганического происхождения.
35.
Озонирование воды.Озон по бактерицидному действию имеет преимущества перед хлором.
Бактерицидное действие озона связано с его высокими окислительными
свойствами и легкостью его проникновения через клеточные оболочки микробов.
Действие озона на споровые формы бактерий примерно в 300 600 раз сильнее,
чем действие хлора. Например, вирус полиомиелита погибает под действием 0,45
мг/л озона через 2 мин, тогда как хлор убивает его через 3 часа при дозе 2 мг/л.
Доза озона в 2мг/л полностью обеззараживает воду от бактерий кишечной
группы. Критическая доза озона (0,4 0,5 мг/л) выше нее бактерицидное действие
озона резко возрастает и достигается полное обеззараживание в отличие от хлора,
обеззараживающее действие которого при малых концентрациях монотонно
возрастает с увеличением дозы реагента.
Растворимость озона в природных водах зависит от рН и количества веществ,
растворенных в воде. Так, наличие в воде кислот увеличивает растворимость
озона, а щелочей – снижает растворимость. рН воды должен быть около 7.
По экономическим соображениям наиболее целесообразно вводить озон в уже
предварительно обработанную коагулянтом и отфильтрованную воду.
36.
Обеззараживание йодомЭтот способ обеззараживания применяется в плавательных бассейнах.
При 20оС в воде растворяется 300 мг/л, при 50 С – 750 мг/л йода. Для
обеззараживания воды природных водоисточников
доза йода
колеблется в пределах от 0,3 до 1 мг/л при рН меньше 7. При этих
значениях запах йода не обнаруживается. Он появляется при
концентрациях выше 1,5 мг/л. Для дезинфекции воды йод применяют
в виде органических соединений - йодофоров.
37.
ОлигодинамияОбеззараживание ионами серебра. Ионы серебра взаимодействуют с
ферментами бактерий и нарушают обмен бактериальной клетки с
окружающей средой или ионы проникают внутрь микробной клетки, и губят
её. Обеззараживание тем лучше, чем выше концентрация ионов серебра [Ag+]
и температура.
Воду можно обеззараживать металлическим серебром. Тогда нужно иметь
большую
поверхность
соприкосновения,
а
это
обеспечивается
использованием серебряных песка, бус, колец, через которые фильтруют
воду. Достаточным содержанием ионов серебра в воде считается
концентрация
2∙10-11
г-ион/л.
На
практике
используют
метод
электрохимического растворения серебра. С его помощью можно
регулировать процесс обеззараживания и точно дозировать концентрацию
ионов серебра. Олигодинамическим действием обладает также и медь.
38.
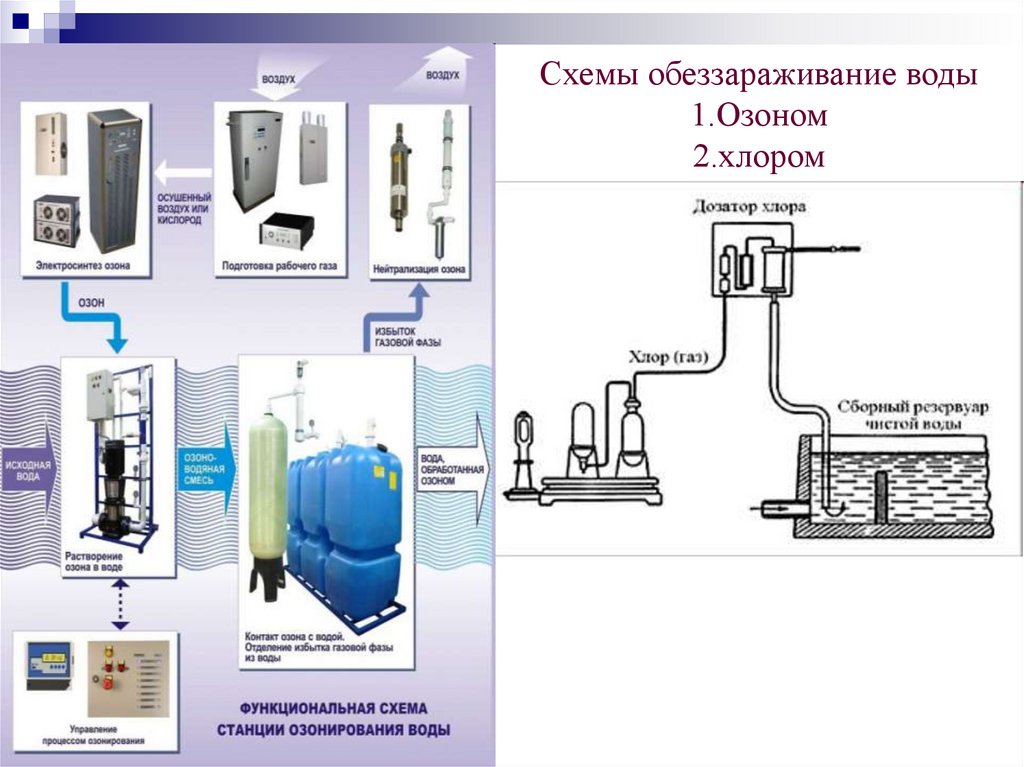
Схемы обеззараживание воды1.Озоном
2.хлором
39.
Обеззараживание УФ лучами.УФ лучи влияют на протоплазму и ферментымикробных клеток, что вызывает их гибель. Наибольшим действием на
бактерии обладают лучи с длиной волн 2000-2950 Ао (бактерицидная
область). Лучи оказывают губительное воздействие на вегетативные формы
бактерий, споры, на простейшие и вирусы.
Степень обеззараживания рассчитывается из отношения конечного количества
бактерий к начальному в единице объема: р/р0.
Обеззараживание
ультразвуком (УЗ). Для обеззараживания воды
применяют УЗ с частотой >20 000 Гц. Под влиянием УЗ гибнут животные и
растительные клетки, простейшие и микроорганизмы. Эффект разрушения
зависит от интенсивности УЗ волн и от морфологических особенностей
объектов. УЗ в воде вокруг объектов образует полости из пузырьков, которые
изолируют объекты от окружающей среды, создавая вокруг них местные
давления в десятки тыс. атмосфер – явление УЗ кавитации. Смена
физического состояния жидкости действует разрушающе на вещества,
находящиеся в УЗ поле. Клетки бактерий механически разрушаются, и
распадается белковое вещество протоплазмы.
40.
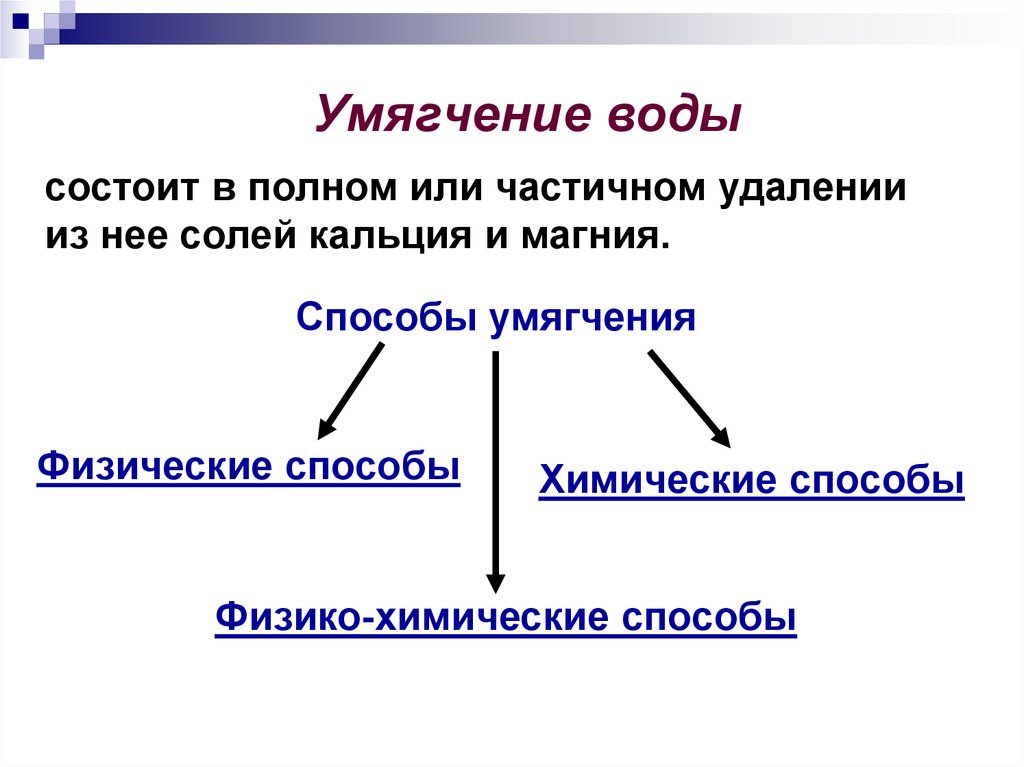
Умягчение водысостоит в полном или частичном удалении
из нее солей кальция и магния.
Способы умягчения
Физические способы
Химические способы
Физико-химические способы
41.
При физическом методе воду нагревают до кипения, врезультате чего растворимые гидрокарбонаты кальция и
магния превращаются в их карбонаты, выпадающие в
осадок:
Са(НСО3)2 = СаСО3 + Н2О +СО2.
Этим методом удаляется только временная жесткость.
К химическим методам умягчения относятся фосфатный и
известково-содовый,
заключающийся
в
обработке
тринатрийфосфатом (Na3Р04) или смесью гидроксида
кальция и карбоната натрия. Реакции протекают
с
образованием нерастворимого осадка :
3СаS04 + 2 Na3Р04 = 3Nа2S04 + Са3 (Р04) 2
Са(НСОз)2+Са(ОН)2=2СаСО3+ 2Н2О,
СаS04 +Na2СО3= CaCO3+ Na2 SO4
42.
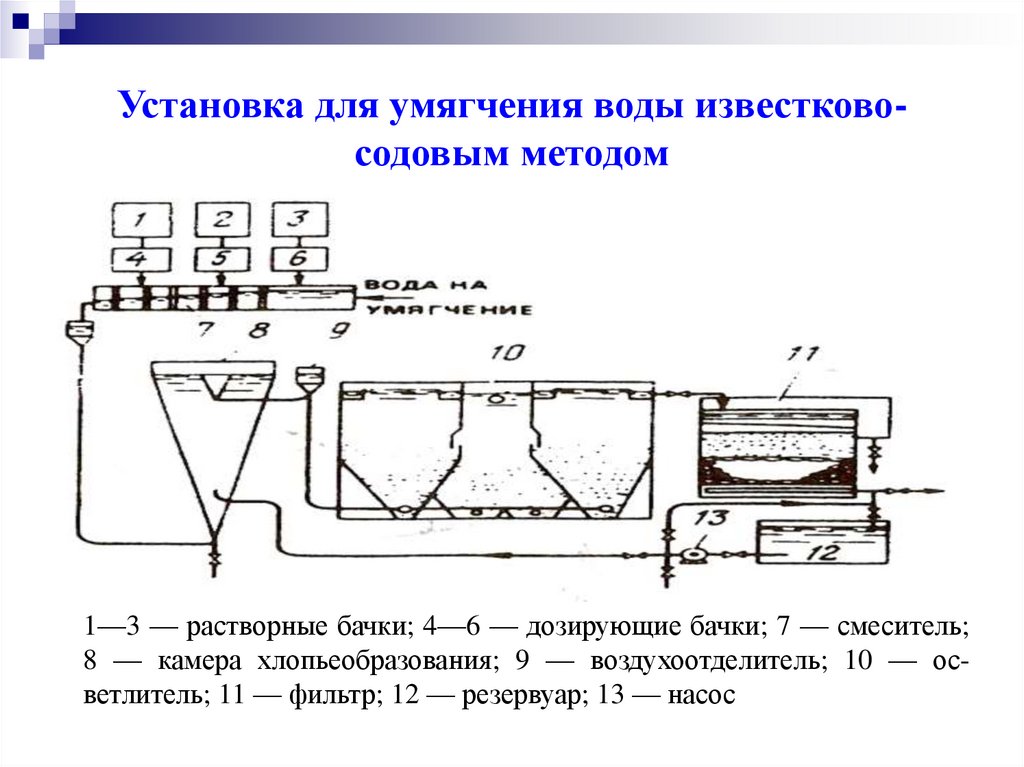
Установка для умягчения воды известковосодовым методом1—3 — растворные бачки; 4—6 — дозирующие бачки; 7 — смеситель;
8 — камера хлопьеобразования; 9 — воздухоотделитель; 10 — осветлитель; 11 — фильтр; 12 — резервуар; 13 — насос
43.
физико-химические методы:
метод ионного обмена, основанный на способности некоторых
материалов, обмениваться ионами с водой. Такими материалы
называют катионитами или анионитами.
Катиониты отдают воде катион натрия (Na- катиониты) или катион
водорода (Н- катиониты) ,а аниониты - ОН- группу. Обмен ионов
кальция и магния на Na+ или Н+ называется умягчением воды,
процесс полного освобождения воды от ионов – обессоливанием.
В качестве катионитов применяют сульфоугли, алюмосиликаты,
искусственные смолы, в качестве анионитов искуственные смолы.
Соответственно процессы ионного обмена подразделяются на
Н(Na)- катионирование и анионирование .
Поскольку процесс ионного обмена обратим, установление
равновесия
в
системе
означает
прекращение
процесса
обессоливания.
43
44.
Схема установки для Na-катионирования1- труба, 2-бак, 3-трубопровод, 4- труба.
45.
Поглощающая способность ионита характеризуетсяего обменной емкостью, равной количеству ионов
кальция и магния, которое может поглотить единица
объема или массы ионита, выраженное в граммэквивалентах: гэкв/м3 и гэкв/кг.
От величины обменной емкости при данном объеме
ионита зависит время рабочего цикла ионитовых
фильтров.
При насыщении ионита он может быть регенерирован
промывкой растворами:
для Н-катионитов – кислоты, Na-катионитов – хлорида натрия
для анионитов – раствором щелочи.
Са(Кат) + 2NaCl = Na2(Кат) + CaCl2
(Ан)Cl + KOH = (Ан)ОН + КСl
45
46.
ДегазацияДегазация – удаление из воды растворенных в ней или
образующихся в процессе ее обработки газов –
достигается химическим способом, при котором газы
поглощаются химическими реагентами, например в
случае диоксида углерода:
Са(ОН)2+СО2=СаСО3 +Н2О
или физическими способами термической деаэрации на
воздухе или в вакууме.
Обычно из воды приходится удалять углекислоту,
сероводород, кислород и реже метан.
47.
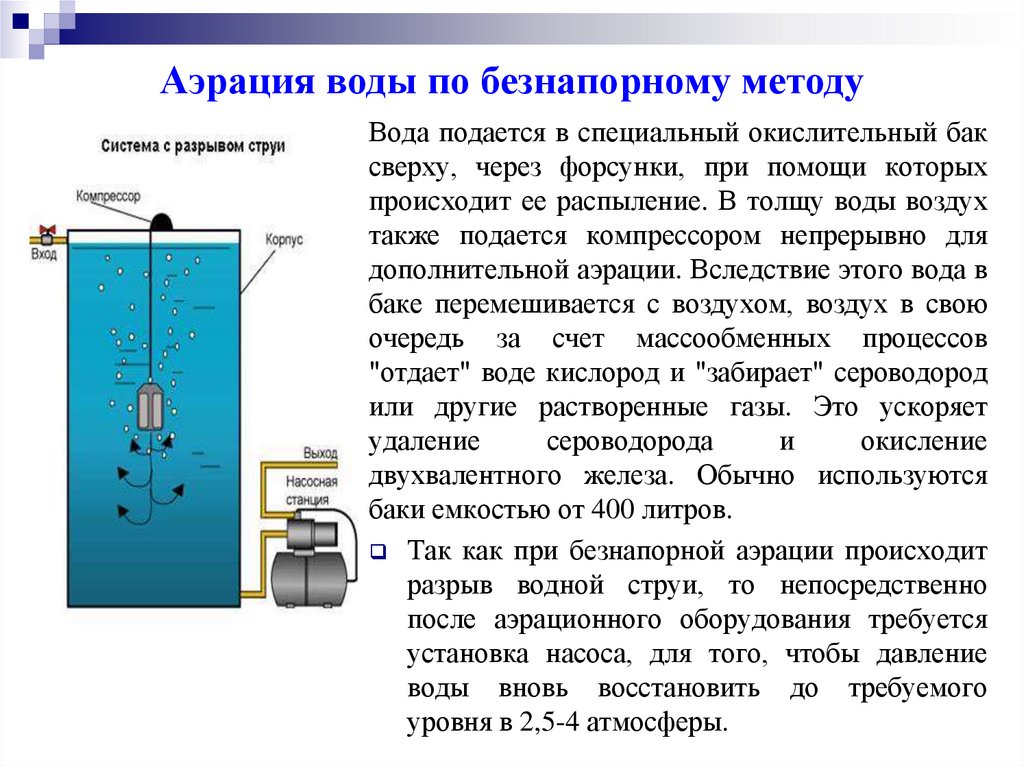
Аэрация воды по безнапорному методуВода подается в специальный окислительный бак
сверху, через форсунки, при помощи которых
происходит ее распыление. В толщу воды воздух
также подается компрессором непрерывно для
дополнительной аэрации. Вследствие этого вода в
баке перемешивается с воздухом, воздух в свою
очередь за счет массообменных процессов
"отдает" воде кислород и "забирает" сероводород
или другие растворенные газы. Это ускоряет
удаление
сероводорода
и
окисление
двухвалентного железа. Обычно используются
баки емкостью от 400 литров.
Так как при безнапорной аэрации происходит
разрыв водной струи, то непосредственно
после аэрационного оборудования требуется
установка насоса, для того, чтобы давление
воды вновь восстановить до требуемого
уровня в 2,5-4 атмосферы.
48.
Аэрация воды напорным методомПри напорной аэрации струя воды не
разрывается.
Подача
воды
происходит
под
давлением в аэрационную колонну и выходит из этой
колонны без потери давления. Воздух подается в
колонну при помощи компрессора. За счет чего в
колонне создается воздушная подушка, в которой и
происходит распыление воды. Дозирование воздуха
осуществляется пропорционально количеству воды,
проходящему через колонну за единицу времени, то
есть компрессор включается во время отбора воды.
Осадок
нерастворимых
соединений
железа
задерживается
осадочным
фильтром,
устанавливаемым сразу после аэрационной колонны.
Если сравнивать с безнапорными системами,
преимущество этого метода в том, что
дополнительный насос для восстановления
давления не требуется.
49.
ОбезжелезиваниеОбезжелезивание воды поверхностных источников
проводится путем аэрации, введения реагентовокислителей с аэрацией или без нее и путем
катионирования.
Одновременно
происходит
ее
осветление и обесцвечивание.
Содержание железа в питьевой воде не должно
превышать 0,3 мг/л. На предприятиях ряда отраслей
промышленности, например текстильной, содержание
железа в воде, используемой для технологических нужд,
не должно превышать 0,1—0,2 мг/л.
50.
Нейтрализация- это обработка воды с целью регулирования значения
рН. Нейтрализация оказывается необходимой для
предотвращения
коррозионных
процессов
в
трубопроводах, для поддержания оптимальных
условий жизнедеятельности микроорганизмов на
очистных сооружениях систем водоотведения, перед
сбросом некоторых видов очищенных сточных вод в
водоем. Во всех перечисленных случаях в результате
нейтрализации желательно иметь значение рН воды
близким к 7.
51.
Рациональное использование водныхресурсов в химической и нефтехимической
промышленности решается путем:
- разработки научно-обоснованных норм расхода
воды на технологические операции;
- максимально полного использования отходов и
снижения за счет этого потребности в
очистительных сооружениях;
- замены водяного охлаждения аппаратуры
воздушным;
- организации замкнутых бессточных производств
и водооборотных циклов.






































 Промышленность
Промышленность








