Похожие презентации:
Физическая химия
1. ФИЗИЧЕСКАЯ ХИМИЯ
Лектор – к.т.н., доцентКовынева Наталья Николаевна
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
2. Физическая химия
– наука, которая изучает физическими методамистроение химических соединений, количественные
закономерности и механизмы химических процессов.
Название «физическая химия» и определение ее содержания
впервые были даны М. В. Ломоносовым, который в 1752 г. начал
читать лекции по физической химии и написал первый учебник
«Истинная физическая химия для учащейся молодежи».
Физическая химия – наука, «объясняющая
на основе положений и опытов физических
причину того, что происходит
при химических операциях
в смешанных телах»
М.В. Ломоносов
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
3. Основные задачи физической химии
установление связи между строением вещества иего реакционной способностью;
изучение и объяснение закономерностей,
определяющих возможность (направленность)
протекания процесса;
изучение механизма химических реакций и
скорости их протекания, влияния на них различных
факторов;
определение условий для получения
максимального выхода продуктов.
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
4. Разделы физической химии
Строение вещества - учение о строении атомов имолекул и об агрегатных состояниях вещества
Химическая термодинамика - изучает
энергетические эффекты химических процессов,
позволяет определить возможность, направление и
глубину протекания химического процесса в
конкретных условиях.
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
5. Разделы физической химии
Фазовые равновесия - с помощью диаграммсостояния можно установить протекающие в системе
качественные изменения, характер взаимодействия
между компонентами, области существования и
составы равновесных фаз и т.д.
Учение о растворах - рассматривает процессы
образования растворов, их внутреннюю структуру и
важнейшие свойства, зависимость структуры и
свойств от природы компонентов раствора.
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
6. Разделы физической химии
Электрохимия - изучает свойства растворовэлектролитов, явления электропроводности,
коррозии, электролиза, работу гальванических
элементов.
Химическая кинетика и катализ - изучает скорость
и механизм протекания химических процессов в
различных средах при различных условиях.
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
7. Разделы физической химии
Физическая химия является теоретической основойлюбой химической технологии, т.к. позволяет
решать задачи эффективного управления
производством, предсказывать результаты процессов
в тех или иных условиях и выясняет,
как надо изменить последние, чтобы процесс шел
в желаемом направлении с наименьшими затратами
и максимальным выходом нужных продуктов.
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
8. Химическая термодинамика
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.9.
Вместе с появлением тепловых машин на рубеже XVIIIи XIX веков появляется такая наука, как техническая
термодинамика. Ее задачи в то время сводились
к изучению закономерностей превращения теплоты
в механическую работу, отсюда и происходит название
от двух греческих слов:
«термо» (температура) и «динамика» (работа)
По мере развития науки и расширения научных знаний
были открыты и другие новые виды энергии, такие как
электрическая, ядерная, химическая. Обобщением
закономерностей взаимного превращения различных
видов (форм) энергии и изучением полученных
законов занимается классическая термодинамика.
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
10.
Химическая термодинамика применяет законыклассической термодинамики к химическим явлениям
и процессам.
Изучает тепловые эффекты химических реакций,
Изучает состояние химического равновесия,
Определяет возможность, направленность и полноту
протекания химических реакций,
Определяет наиболее благоприятные условия для
осуществления термодинамически возможного
процесса и условия, при которых можно свести к
минимуму все побочные процессы и др.
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
11.
Термодинамический метод базируется на законахтермодинамики и применяется только к системам,
состоящим из большого числа частиц,
т.е. к макросистемам.
Поэтому законы термодинамики нельзя применять
ни к отдельно взятой частице или молекуле,
ни ко всей бесконечной Вселенной.
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
12.
Особенность термодинамического метода:он не рассматривает молекулярную структуру вещества,
его не интересует характер сил взаимодействия между
молекулами (частицами) системы; метод оперирует
усредненными характеристиками множества частиц
как единого целого.
В этом абстрагировании от свойств отдельных частиц
заключается некая ограниченность (слабость) метода.
С другой стороны, это дает возможность рассматривать
все процессы и явления с единых позиций независимо
от полноты наших сведений о составе и строении частиц
системы, и в этом состоит уникальность
термодинамического метода, или сильная сторона
термодинамики.
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
13.
Термодинамическая система – материальный объект,выделенный из внешней среды с помощью реально
существующей или воображаемой граничной
поверхности и способный обмениваться с другими
телами энергией и (или) веществом.
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
14. Классификации термодинамических систем
По характеру взаимодействия с окружающейсредой различают:
Открытые, в которых существует обмен энергией
и веществом с окружающей средой;
Закрытые, в которых существует обмен энергией
с окружающей средой, но нет обмена веществом;
Изолированные, в которых нет обмена с
окружающей средой ни энергией, ни веществом.
(понятие абстрактное и используется лишь для
моделирования термодинамических процессов).
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
15.
энергияЕ
энергия
открытая
система
закрытая
система
изолированная
система
вещество
m
вещество
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
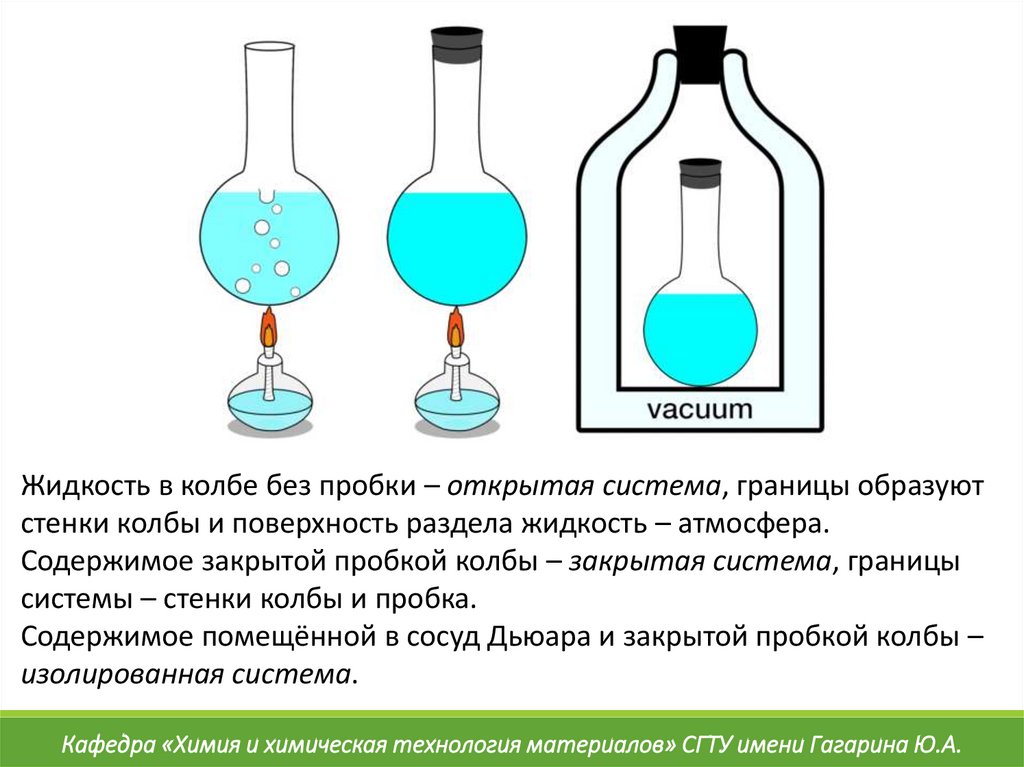
16.
Жидкость в колбе без пробки – открытая система, границы образуютстенки колбы и поверхность раздела жидкость – атмосфера.
Содержимое закрытой пробкой колбы – закрытая система, границы
системы – стенки колбы и пробка.
Содержимое помещённой в сосуд Дьюара и закрытой пробкой колбы –
изолированная система.
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
17.
Термодинамическую систему называют гомогенной,если между любыми её частями нет поверхностей
раздела и, следовательно, свойства системы
непрерывно изменяется от точки к точке.
Примерами гомогенных систем служат растворы
(газовые, жидкие и твердые).
Термодинамическую систему называют гетерогенной,
если она состоит из нескольких гомогенных частей с
разными свойствами. На поверхностях, разделяющих
гомогенные части гетерогенной системы, хотя бы одно
термодинамическое свойство вещества изменяется
скачкообразно.
Гомогенную часть гетерогенной системы называют
фазой.
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
18.
Термодинамическиесистемы
Гомогенные системы
Гетерогенные системы
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
19.
Термодинамические параметры состояния –физические величины, характеризующие состояние
термодинамической системы (температура, объем,
давление, концентрация и другие).
Интенсивные – не зависят от массы системы
и при объединении систем выравниваются
(температура T, давление P, концентрация С и др.)
Экстенсивные – зависят от массы системы и при
объединении систем складываются,
т.е. обладают свойством аддитивности
(объем V, внутренняя энергия U, энтропия S и др.)
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
20.
Если параметры состояния во времени не меняются,то такое состояние считается равновесным.
В равновесной термодинамической системе параметры
состояния связаны между собой определенными
математическими уравнениями – уравнениями
состояния.
Например, уравнение состояния идеального газа
Менделеева – Клапейрона:
PV = nRT
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
21.
Если состояние системы изменяется, то говорят, что всистеме происходит термодинамический процесс.
Все термодинамические свойства строго определены
только в равновесных состояниях.
Процесс в термодинамике – это последовательность
состояний системы, ведущих от одного начального
набора термодинамических переменных к другому –
конечному.
Различают процессы:
Самопроизвольные, для осуществления которых не
надо затрачивать энергию;
Несамопроизвольные, происходящие только при
затрате энергии.
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
22.
Различают процессы:Обратимые, когда переход системы из одного
состояния в другое и обратно может происходить
через последовательность одних и тех же состояний,
и после возвращения в исходное состояние в
окружающей среде не остается макроскопических
изменений;
Квазистатические, или равновесные, которые
происходят под действием бесконечно малой
разности обобщенных сил;
Необратимые, или неравновесные, когда в
результате процесса невозможно возвратить и
систему, и ее окружение к первоначальному
состоянию.
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
23.
Различают процессы:Изотермический – термодинамический процесс,
происходящий в системе при постоянной
температуре (Т = const).
Изобарический – термодинамический процесс,
происходящий в системе при постоянном давлении
(P = const).
Изохорический – термодинамический процесс,
происходящий в системе при постоянном объеме
(V = const).
Адиабатический – термодинамический процесс,
при котором система не обменивается теплотой
с окружающим пространством.
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
24.
Термодинамические функции разделяют на:функции состояния, которые зависят только от
состояния системы и не зависят от пути, по которому
это состояние получено;
функции процесса, значение которых зависит от
пути, по которому происходит изменение системы.
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
25.
Термодинамические функции состояния –функции независимых параметров, определяющих
равновесное состояние термодинамической системы,
т.е. это величины, не зависящие от предыстории
системы и полностью определяемые ее состоянием
в данный момент.
Изменение термодинамических функций состояния
в процессе перехода от начального состояния (1)
к конечному состоянию (2) не зависит от пути
(характера процесса), а определяется только
разностью значений данной функции в конечном
и начальном состоянии.
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
26.
Внутренняя энергия, U [кДж/моль]Полная энергия системы разделяется на внешнюю и
внутреннюю. Во внешнюю энергию входят: энергия
движения системы как целого и потенциальная энергия
системы в поле сил. Вся остальная часть энергии
системы называется её внутренней энергией.
Внутренняя энергия системы представляет собой
сумму энергий межмолекулярного взаимодействия,
поступательного и вращательного движений молекул,
колебательного движения атомов, электронной,
внутриядерной и др.
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
27.
Энтальпия, Н [кДж/моль]– термодинамический потенциал, характеризующий
состояние системы в термодинамическом равновесии
при выборе в качестве независимых переменных
давления, энтропии и числа частиц.
– это та энергия, которая доступна для преобразования
в теплоту при определенных температуре и давлении.
H = U + PV
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
28.
Энтропия, S [Дж/моль∙К]– мера неупорядоченности системы.
Свободная энергия Гиббса, G [кДж/моль]
– изобарно-изотермический потенциал
ΔG = ΔH – TΔS, Т, Р = const
Свободная энергия Гельмгольца, F [кДж/моль]
– изохорно-изотермический потенциал
ΔF = ΔU – TΔS, T, V = const
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
29.
Термодинамические функции процессаВзаимное превращение одного вида энергии в другой,
а также переход энергии от одной системы к другой
всегда происходит в форме какого-либо процесса.
Если этот процесс осуществляется за счет хаотического
столкновения молекул двух соприкасающихся тел,
т.е. путем теплопроводности или путем излучения,
то мерой передаваемой таким способом энергии
является теплота Q.
Если же переход энергии сопровождается
направленным перемещением масс, состоящих из
большого числа частиц, то мерой передаваемой таким
способом энергии является работа А.
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
30.
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИР. Майер (1842 г.), Д. Джоуль (1842 г.), Л. Гельмгольц (1847 г.)
Первое начало термодинамики представляет собой закон
сохранения энергии: энергия неучтожаема и несотворяема,
она лишь может переходить из одной формы в другую.
Первое начало термодинамики устанавливает соотношение между
теплотой Q, работой А и изменением внутренней энергии системы ∆U
∆U = Q – А
Q = ∆U + А
Изменение внутренней энергии системы
равно количеству сообщенной системе теплоты
минус количество работы,
совершенной системой против внешних сил.
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
31.
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ1. Изохорные процессы. V = const, ∆V = 0
∆U = Q – А
A = P∆V = 0
∆U = QV
2. Изобарные процессы. Р = const, ∆Р = 0
QР = U2 – U1 + Р(V2 – V1) =
= (U2 + РV2) – (U1 + РV1) = Н2 – Н1 = ∆Н
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
32.
Основные понятия термохимииТепловые эффекты, сопровождающие протекание реакций,
являются предметом изучения одного из разделов
химической термодинамики – термохимии.
Тепловой эффект химической реакции
– количество теплоты, выделившейся или
поглотившейся в ходе реакции.
Экзотермическая – реакция с выделением
теплоты (∆Н < 0)
Эндотермическая – реакция с поглощением
теплоты (∆Н > 0)
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
33.
Основные понятия термохимииКафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
34.
Основные понятия термохимииТеплота сгорания вещества – тепловой эффект
реакции окисления 1 моль вещества в избытке
кислорода до высших оксидов.
Теплота растворения – тепловой эффект процесса
растворения 1 моль вещества в бесконечно большом
количестве растворителя.
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
35. Закон Гесса (1840 г.)
Тепловой эффект химической реакциине зависит от пути ее протекания,
а зависит лишь от природы и физического состояния
исходных веществ и продуктов реакции
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
36.
Следствие из закона ГессаТепловой эффект химической реакции равен
разности между теплотами образования всех
продуктов реакции и теплотами образования всех
исходных веществ, умноженными на
соответствующие стехиометрические коэффициенты.
Для реакции аА + bB = mM + nN
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
37.
Энтальпия фазовых переходовКафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
38.
Fe2O3 + 3CO = 2Fe + 3CO2, ΔH° = - 29 кДжΔH°(Fe2O3) = ?
Из термодинамических таблиц
ΔH°(CO2) = - 393.5 кДж/моль,
ΔH°(CO) = -110.5 кДж/моль
ΔH°х.р. = 3ΔH°(CO2) - ΔH°(Fe2O3) - 3ΔH°(CO)
ΔH°(Fe2O3) = 3ΔH°(CO2) - 3ΔH°(CO) - ΔH°х.р.
ΔH°(Fe2O3) = 3(-393.5) – 3(-110.5) – (-29) =
= -820 кДж/моль
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
39.
Закон Лавуазье – ЛапласаТепловой эффект прямой реакции равен по
величине и противоположен по знаку
тепловому эффекту обратной реакции
ΔНразлож. = - ΔHобр.
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
40.
Уравнение КирхгофаВ общем случае тепловой эффект химической реакции зависит от
температуры и давления, при которых протекает реакция.
Влиянием давления на ΔН обычно пренебрегают.
Влияние температуры на величину теплового эффекта
описывает закон Кирхгофа:
температурный коэффициент теплового эффекта
химической реакции равен изменению теплоемкости
системы в ходе реакции.
Н Н
0
Т
0
298
Т
С р dТ
298
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
41. Второе начало термодинамики
Какой из процессов будет протекать самопроизвольно?Какое количество работы может быть при этом получено?
Каков предел самопроизвольного течения процесса?
Какими должны быть условия, чтобы нужный процесс
протекал в необходимом направлении и в требуемой
степени?
Применимо лишь к макроскопическим системам
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
42.
Статистическое толкование энтропииМакросостояние системы тем более вероятно, чем большим
числом микросостояний оно может осуществиться.
Термодинамическая вероятность (W)
– число микросостояний, отвечающих данному
макросостоянию системы.
Энтропия – функция состояния, описывающая
степень неупорядоченности системы.
S = k∙lnW
R
k = N = 1,38·10-23 Дж/К
A
Людвиг
Больцман
W - термодинамическая
вероятность;
k – постоянная Больцмана;
R = 8,31 Дж/моль∙К;
NА - число Авогадро.
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
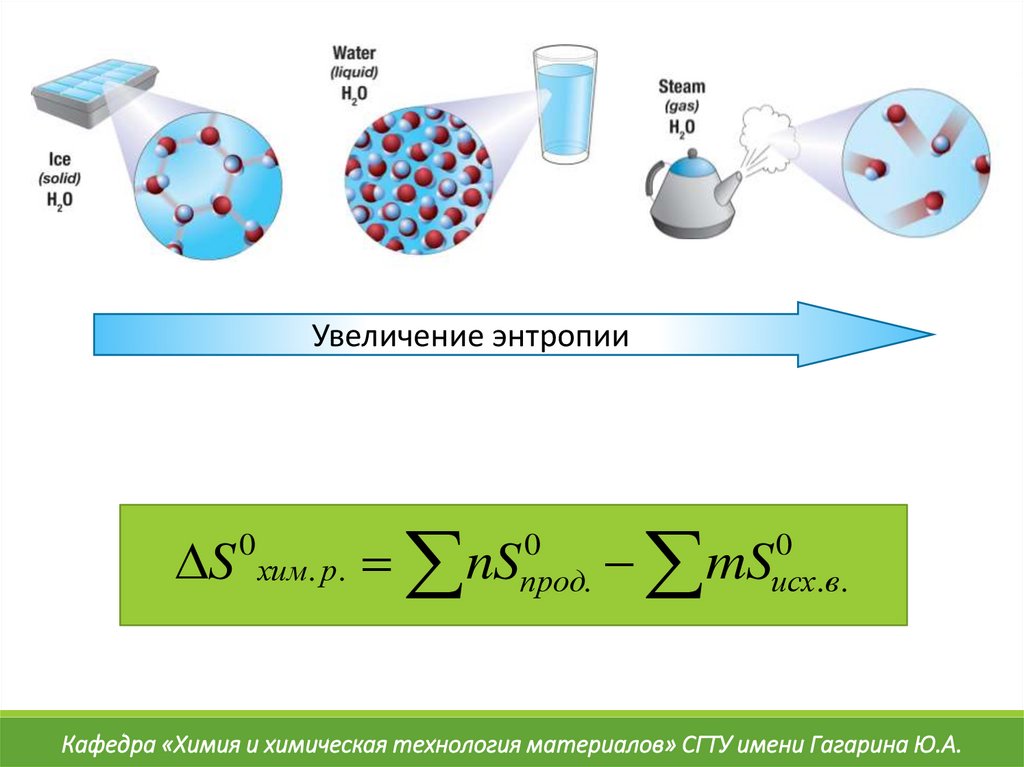
43.
Увеличение энтропииS хим. р. nS
0
0
прод.
mS
0
исх. в.
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
44. Энтропия в изолированной системе
U = const, V = const, ∆Q = 0ΔS > 0 самопроизвольный процесс
ΔS = 0 равновесный процесс
В изолированных системах энтропия только увеличивается
и при равновесии достигает максимума.
Поэтому она может быть использована в качестве критерия протекания
самопроизвольных процессов только в изолированных системах.
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
45. Критерии термодинамического равновесия в неизолированной системе
Поведение всякой термодинамической системы в общем случаеопределяется одновременным действием двух факторов –
энтальпийного, отражающего стремление системы к минимуму
тепловой энергии, и энтропийного, отражающего стремление
системы к максимальной неупорядоченности.
Энтальпийный фактор ∆Н < 0
Энтропийный фактор ∆S > 0
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
46. Свободная энергия Гельмгольца Изохорно-изотермический потенциал
V, Т = const ∆F = ∆U - T∆SСвободная энергия Гиббса
Изобарно-изотермический потенциал
Р, Т = const ∆G = ∆H - T∆S
0
0
0
G298
n Gпродук
m
G
исход.в.
.
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
47. ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
Термодинамически возможны только процессы,идущие в сторону уменьшения свободной энергии
∆G < 0
∆F < 0
при ∆G < 0 реакция самопроизвольная;
при ∆G > 0 реакция не самопроизвольная;
H
T
S
при ∆G = 0 система находится
в равновесии
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
48.
Взаимосвязь ∆Gо и Кх.р.∆Gо = - RT ln Кх.р.
∆G > 0 равновесие сместится влево ←
∆G < 0 равновесие сместится вправо →
∆G = 0 состояние равновесия
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.
49.
СО(г) + Н2О(ж) = СО2(г) + Н2(г)0
H CO
110,52кДж / моль
0
SCO
197,91 Дж / моль К
H H0 2O ( ж) 285,84кДж / моль
SH0 2O ( ж) 69,94 Дж / моль К
H
0
SCO
213,65 Дж / моль К
2
0
CO2
393,51кДж / моль
SH0 2 130,59 Дж / моль К
H х0. р. ( 393,51 0) ( 110,52 285,84) 2,85кДж
S х0. р. (213,65 130,59) (197,91 69,94) 76,39 Дж / К 0,07639кДж / К
Gх0. р. 2,85 298 0,07639 19,91кДж
Кафедра «Химия и химическая технология материалов» СГТУ имени Гагарина Ю.А.















































 Химия
Химия








