Похожие презентации:
Спирты. Определение
1.
Тема урока:Спирты
Алферова Мария Владимировна
учитель химии ГБОУ лицей №486
2.
План изучения класса СПИРТЫ1.Определение
2.Классификация
3.Строение предельных одноатомных
спиртов
4.Номенклатура
5.Изомерия
6.Получение
7.Физические свойства
8.Химические свойства
9.Применение спиртов
3.
Спирты (Алкоголи) –– производные углеводородов, в
молекулах которых один или несколько
атомов замещены на соответствующее
число гидроксильных групп (–ОН)
Функциональная группа спиртов:
-ОН
4.
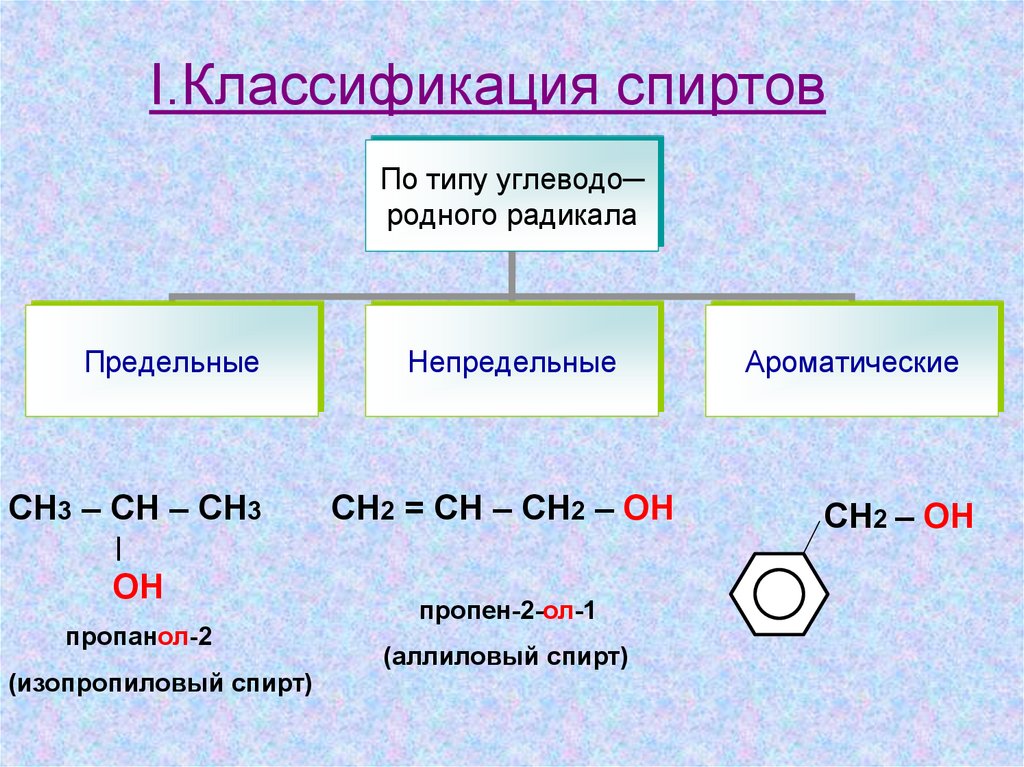
I.Классификация спиртовПо типу углеводо─
родного радикала
Предельные
СН3 – СН – СН3
Непредельные
СН2 = СН – СН2 – ОН
|
OH
пропанол-2
(изопропиловый спирт)
пропен-2-ол-1
(аллиловый спирт)
Ароматические
СН2 – ОН
5.
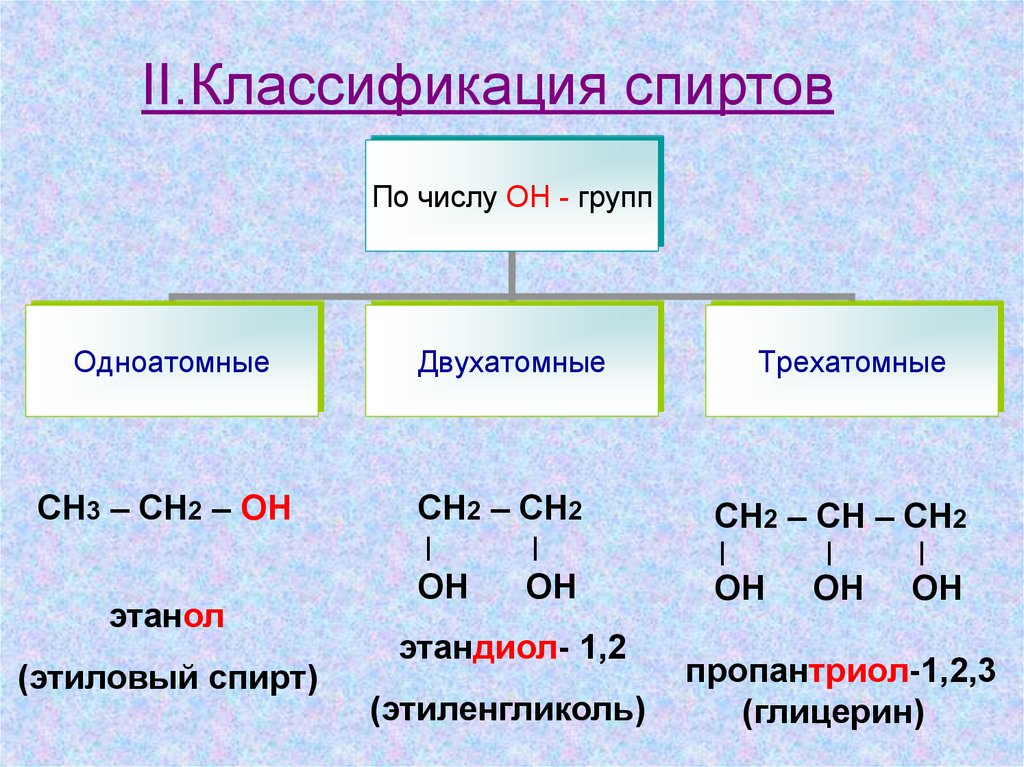
II.Классификация спиртовПо числу ОН - групп
Одноатомные
СН3 – СН2 – OH
этанол
(этиловый спирт)
Двухатомные
Трехатомные
СН2 – СН2
СН2 – СН – СН2
|
|
|
ОН
ОН
ОН
этандиол- 1,2
(этиленгликоль)
|
ОН
|
ОН
пропантриол-1,2,3
(глицерин)
6.
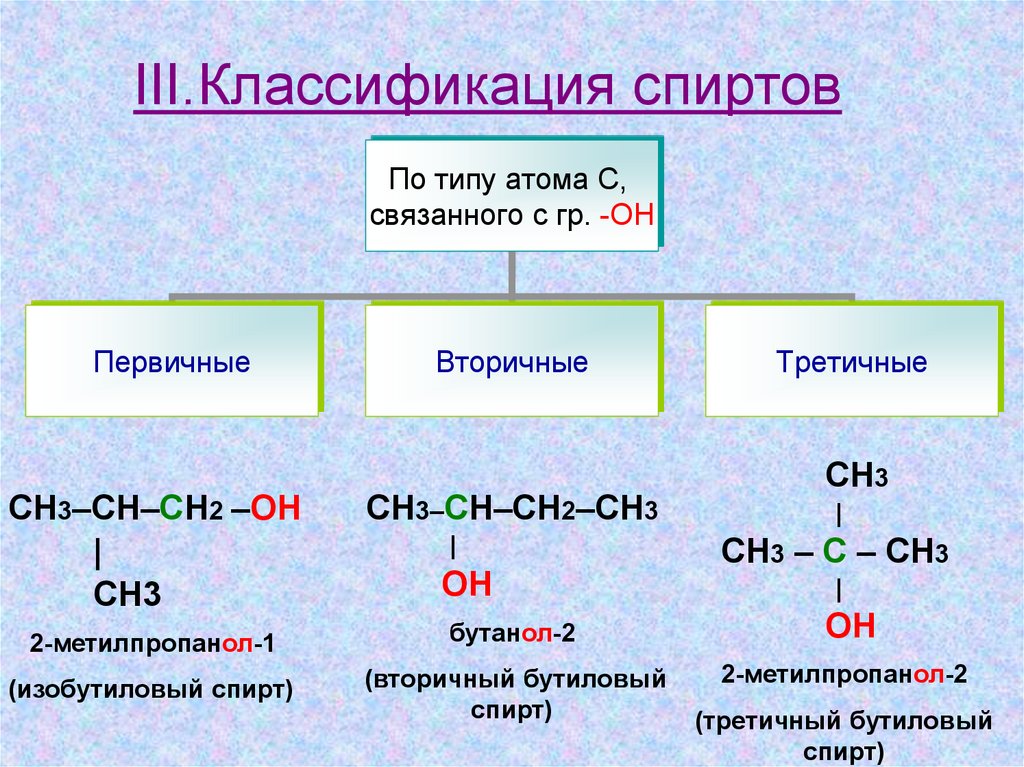
III.Классификация спиртовПо типу атома С,
связанного с гр. -ОН
Первичные
СН3–СН–СН2 –ОН
|
СН3
Вторичные
СН3–СН–СН2–СН3
|
ОН
Третичные
СН3
|
СН3 – С – СН3
|
2-метилпропанол-1
бутанол-2
ОН
(изобутиловый спирт)
(вторичный бутиловый
спирт)
2-метилпропанол-2
(третичный бутиловый
спирт)
7.
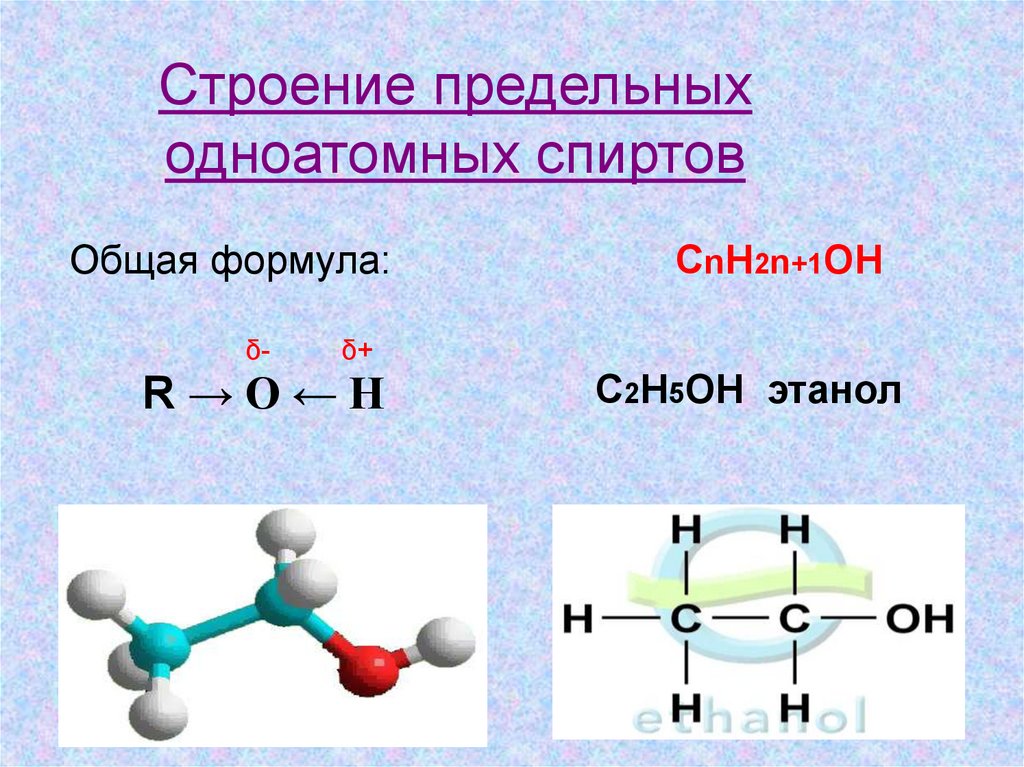
Строение предельныходноатомных спиртов
Общая формула:
δ-
СnH2n+1OH
δ+
R→O←H
C2H5OH этанол
8.
НоменклатураСН3ОН
метанол (метиловый спирт)
С2Н5ОН этанол
(этиловый спирт)
С3Н7ОН пропанол (пропиловый спирт)
3
2
1
1
СН3-СН2-СН2-ОН
(пропиловый спирт)
4
3
2
1
СН3-СН-СН2-СН-СН3
|
3
СН3-СН-СН3
|
ОН
пропанол-2
(изопропиловый спирт)
пропанол-1
5
2
|
CH3
ОН
4-метилпентанол-2
9.
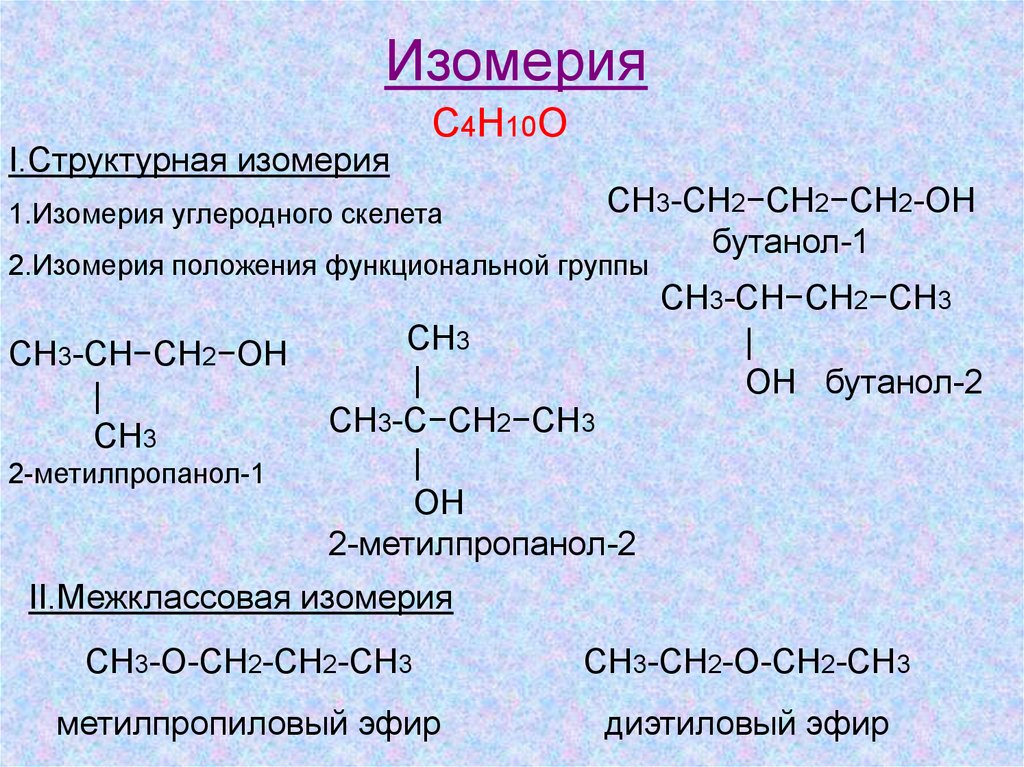
ИзомерияI.Структурная изомерия
С4Н10О
1.Изомерия углеродного скелета
СН3-СН2−СН2−СН2-ОН
бутанол-1
2.Изомерия положения функциональной группы
СН3-СН−СН2−ОН
|
СН3
2-метилпропанол-1
CH3
|
СН3-С−СН2−СН3
|
OH
2-метилпропанол-2
СН3-СН−СН2−СН3
|
OH бутанол-2
II.Межклассовая изомерия
СН3-О-СН2-СН2-СН3
СН3-СН2-О-СН2-СН3
метилпропиловый эфир
диэтиловый эфир
10.
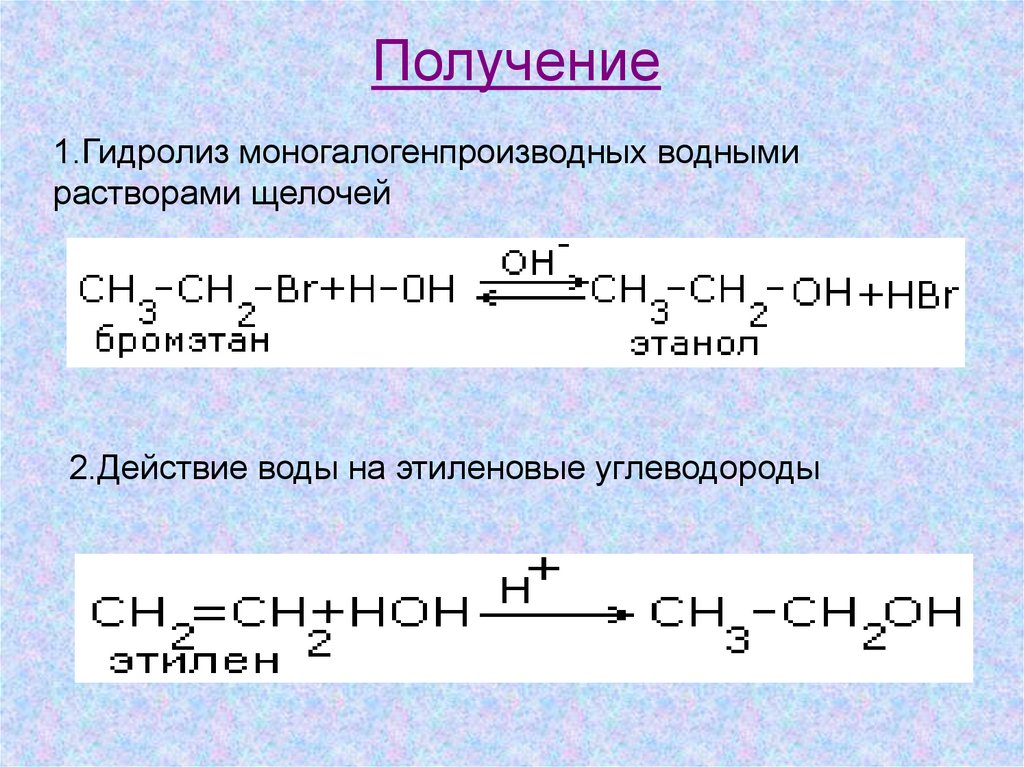
Получение1.Гидролиз моногалогенпроизводных водными
растворами щелочей
2.Действие воды на этиленовые углеводороды
11.
Получение3.Восстановление альдегидов и кетонов
4.Сбраживание растительного сырья, содержащего
крахмал
С6H12O6 →2C2H5OH+2CO2
12.
Физические свойства1. Агрегатное состояние
предельные одноатомные спирты от С1 до С12 – жидкости
высшие спирты – мазеобразные вещества
от С21 и выше – твердые вещества
2. Плотность легче воды
3. Температура кипения
• t кип. спиртов нормального строения увеличивается с увеличением
молекулярной массы
• t кип. спиртов нормального строения выше t кип. спиртов
изостроения
4. Растворимость в воде
С увеличением молекулярной массы снижается.
Метиловый, этиловый и пропиловый спирты хорошо растворимы.
5. Горючесть
13.
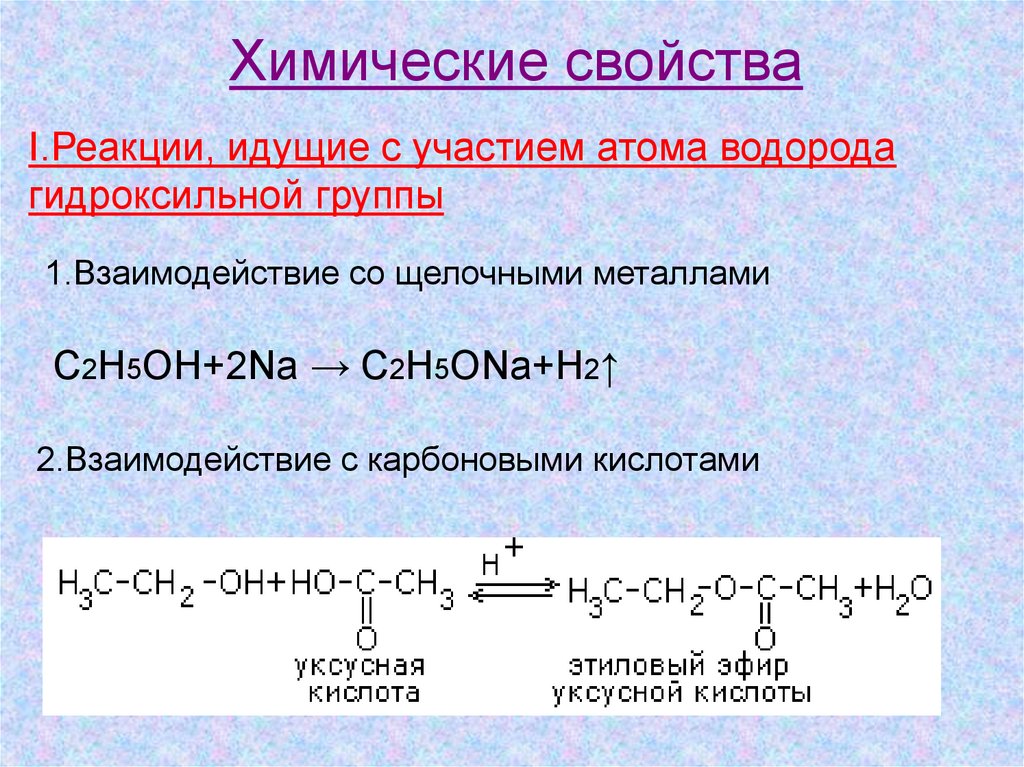
Химические свойстваI.Реакции, идущие с участием атома водорода
гидроксильной группы
1.Взаимодействие со щелочными металлами
C2H5OH+2Na → C2H5ONa+H2↑
2.Взаимодействие с карбоновыми кислотами
14.
Химические свойстваII. Реакции, идущие с участием гидроксильной
группы
1.Взаимодействие с галогеноводородами
C2H5OH+HBr →C2H5Br +HOH
2.Отщепление воды
C2H5OH→ CH2=CH2+H2О
3.Межмолекулярная дегидратация
C2H5OH+HOC2H5 → (C2H5)2O + H2O
диэтиловый эфир
15.
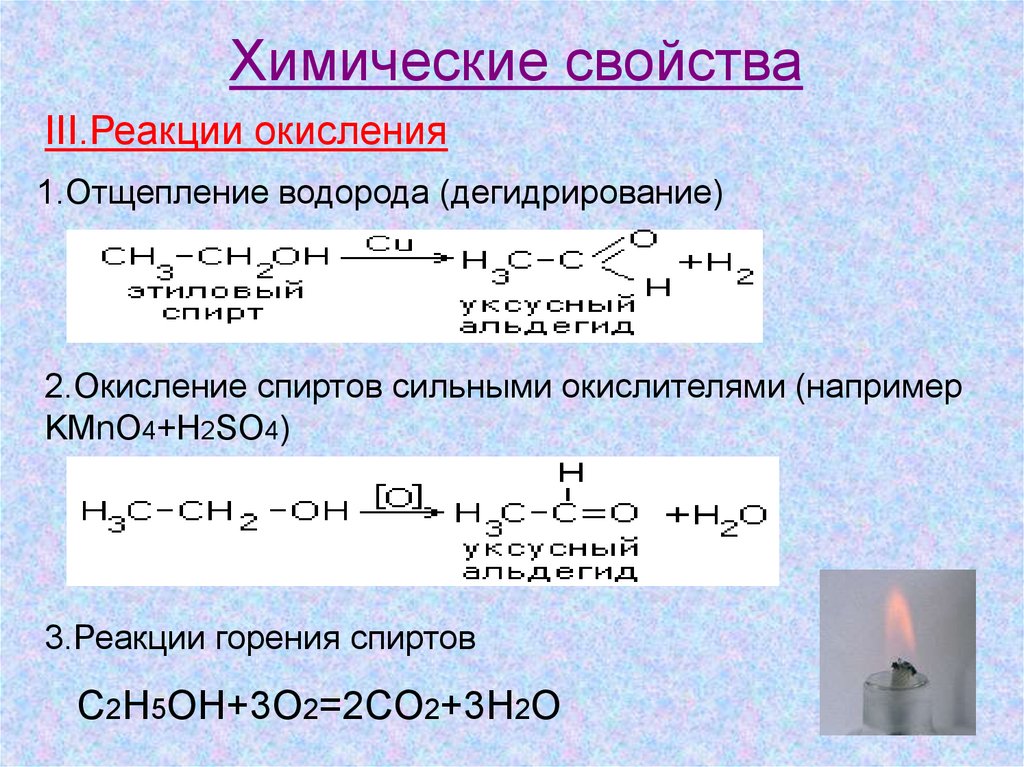
Химические свойстваIII.Реакции окисления
1.Отщепление водорода (дегидрирование)
2.Окисление спиртов сильными окислителями (например
KMnO4+H2SO4)
3.Реакции горения спиртов
C2H5OH+3O2=2CO2+3H2O
16.
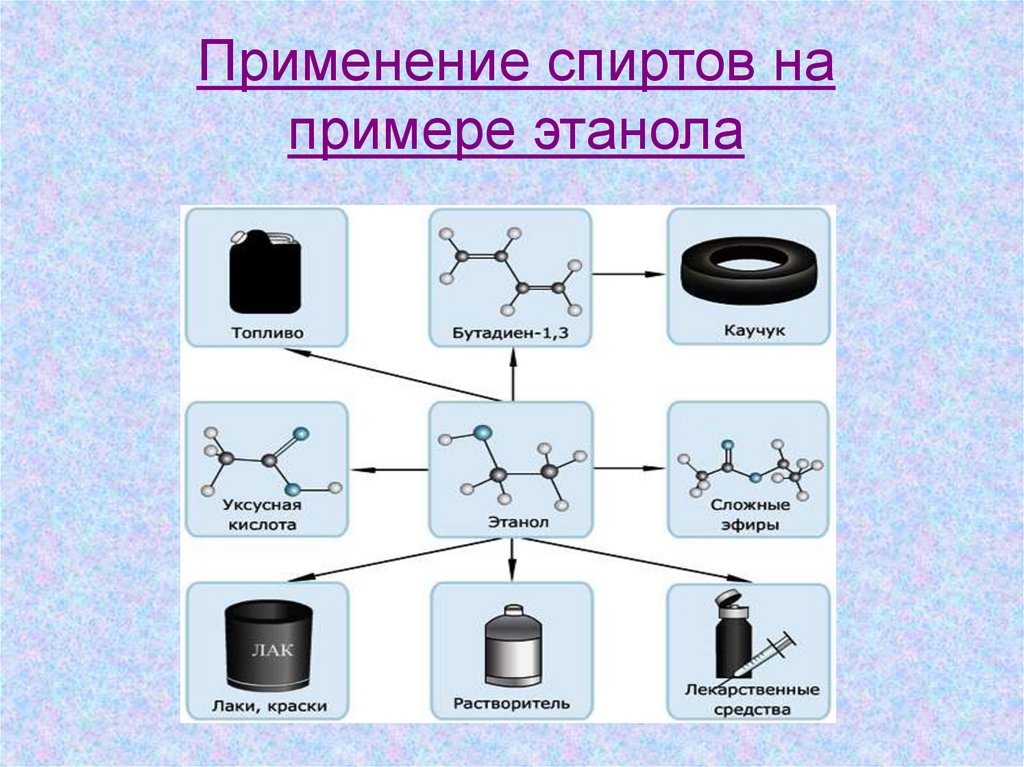
Применение спиртов напримере этанола








 Химия
Химия








