Похожие презентации:
Окислительно-восстановительные реакции (урок химии в 11 классе)
1.
Окислительно –восстановительные
реакции
(урок химии в 11 классе)
2.
Окислительно –восстановительные реакцииэто реакции, протекающие с
изменением степеней окисления
атомов химических элементов или
ионов, входящих в состав
реагирующих веществ
3.
Вариант 1• Задание 1: Рассчитайте степени
окисления элементов в соединениях:
• MnO2, H2SO4, K2SO3, H2S, KMnO4 .
Вариант 2
• Задание 1: Рассчитайте степени
окисления элементов в соединениях:
• СO2, H2FeO4, K2SO4, Na2S, K2MnO4
4.
Вариант 1• Задание 1: Рассчитайте степени окисления
элементов в соединениях:
• Mn+4O2-2, H2+S+6O4-2, K2+S+4O3_2, H2+S-2,
K+Mn+7O4-2 .
Вариант 2
• Задание 1: Рассчитайте степени окисления
элементов в соединениях:
• С+4O2-2, H2+Fe+6O4-2, K2+S+6O-24, Na+2S-2,
K+2Mn+6O4-2
5.
• Задание 2: Методом электронногобаланса найдите и поставьте
коэффициенты в следующей схеме
окислительно – восстановительной
реакции:
• HNO3 + Ag → AgNO3 + NO + H2O
• KI + KMnO4 + H2SO4 →
I2 + MnSO4 + K2SO4 + H2O
• FeSO4 + KMnO4 + H2SO4 →
Fe2(SO4)3 + MnSO4 +K2SO4 + H2O
6.
РастворKMnO4
(малиновый)
Na2SO3
Na2SO3
Среда
Среда
Среда
кислая
нейтральная
щелочная
(H2SO4)
(Н2О)
Na2SO3
(КOH)
контроль
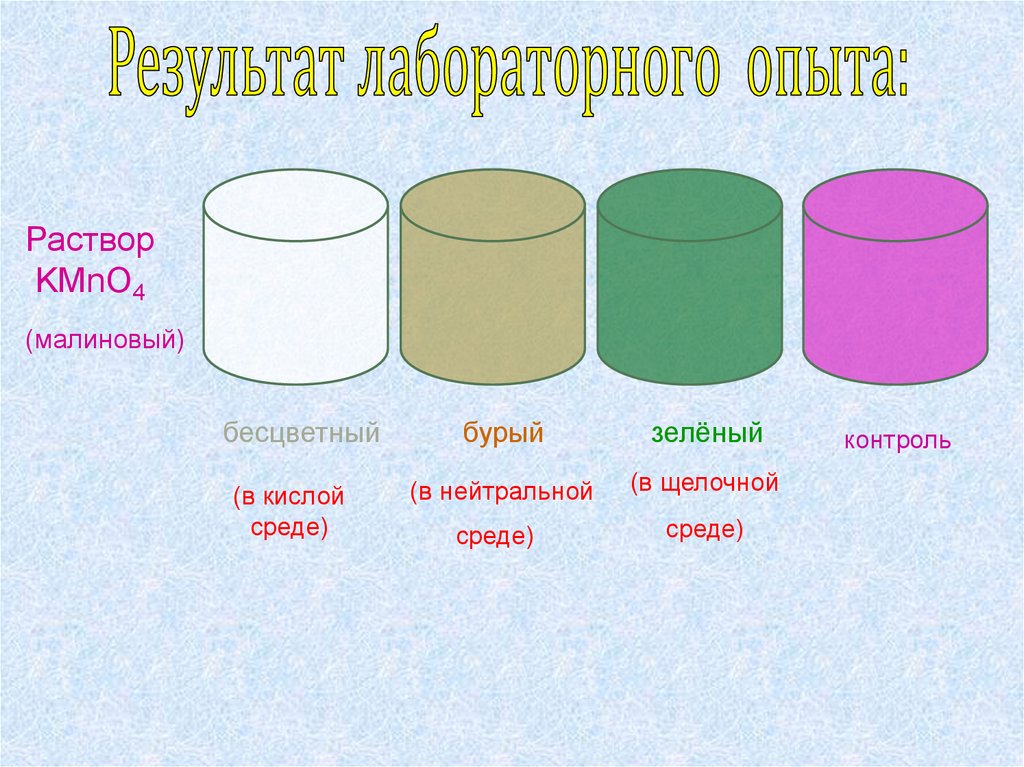
7.
РастворKMnO4
(малиновый)
бесцветный
(в кислой
среде)
бурый
зелёный
(в нейтральной
(в щелочной
среде)
среде)
контроль
8.
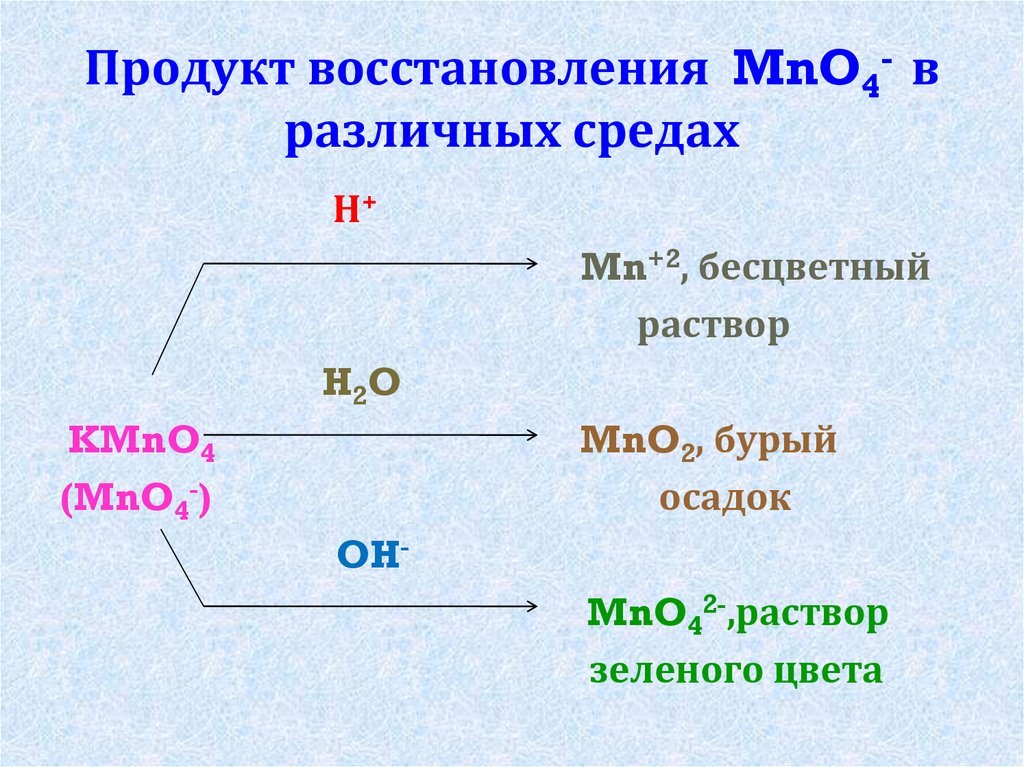
Продукт восстановления MnO4- вразличных средах
Н+
Mn+2, бесцветный
раствор
H2O
MnO2, бурый
осадок
KMnO4
(MnO4-)
OH-
MnO42-,раствор
зеленого цвета
9.
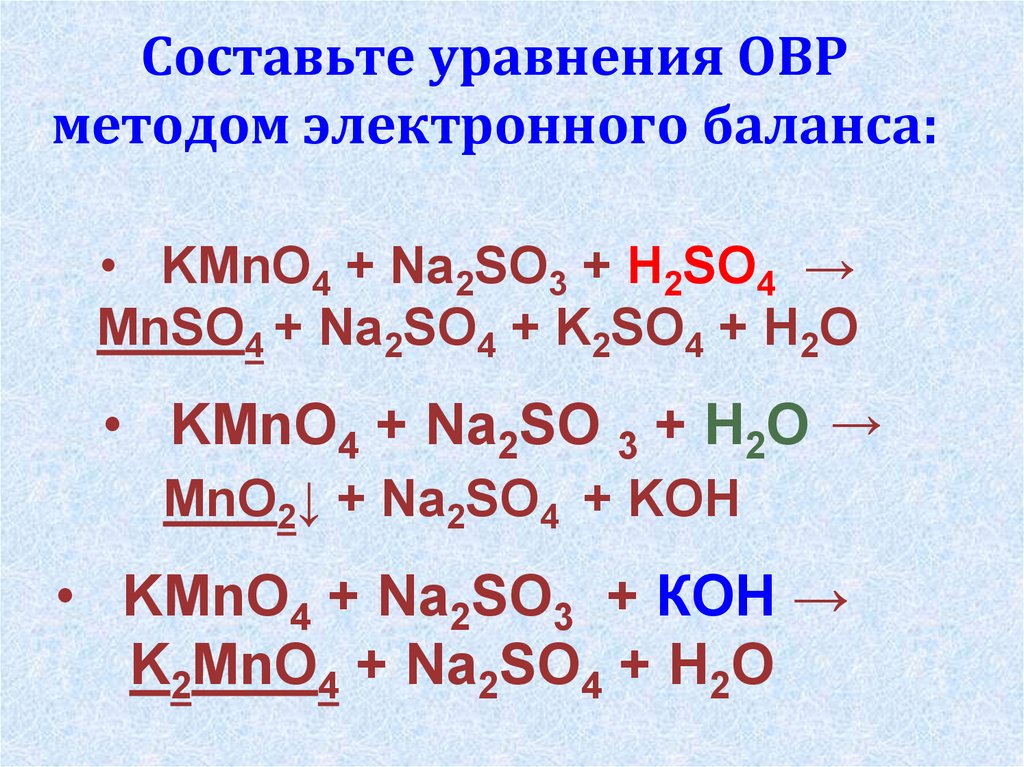
Составьте уравнения ОВРметодом электронного баланса:
• KMnO4 + Na2SO3 + H2SO4 →
MnSO4 + Na2SO4 + K2SO4 + H2O
• KMnO4 + Na2SO 3 + H2O →
MnO2↓ + Na2SO4 + KOH
• KMnO4 + Na2SO3 + КOH →
K2MnO4 + Na2SO4 + H2O
10.
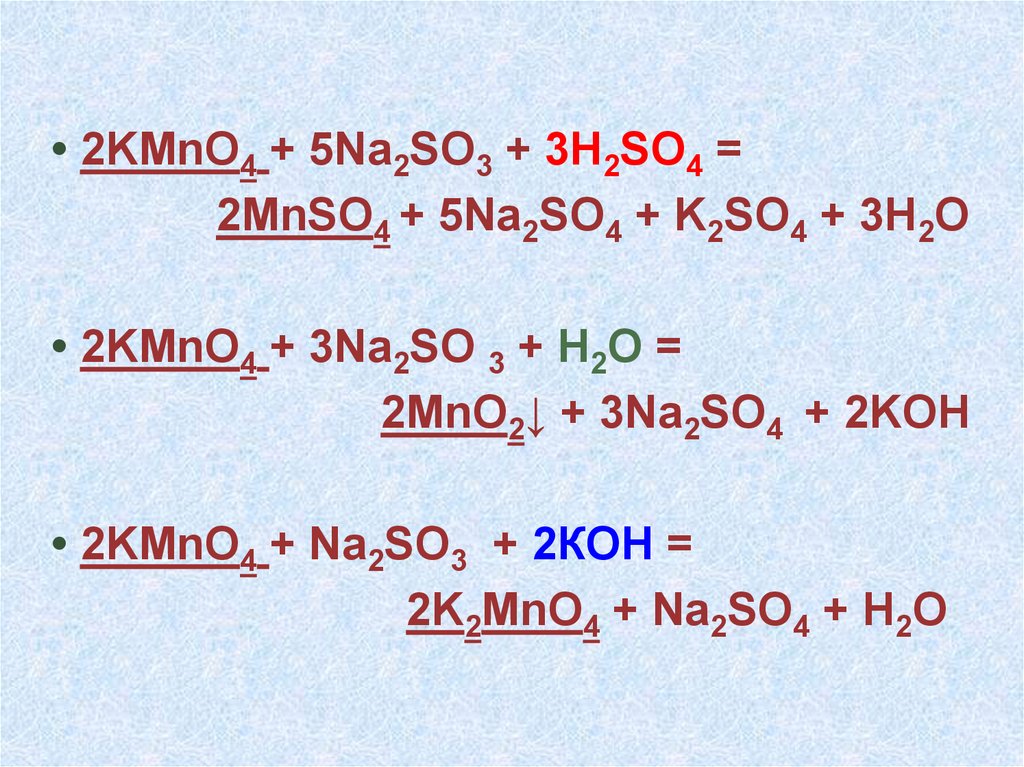
• 2KMnO4 + 5Na2SO3 + 3H2SO4 =2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
• 2KMnO4 + 3Na2SO 3 + H2O =
2MnO2↓ + 3Na2SO4 + 2KOH
• 2KMnO4 + Na2SO3 + 2КOH =
2K2MnO4 + Na2SO4 + H2O
11.
Пятна от раствора перманганата калия быстровыводятся раствором пероксида водорода,
подкисленным уксусной кислотой:
2KMnO4 + 9H2O2 + 6CH3COOH =
2Mn(CH3COO)2 +2CH3COOK + 7O2 + 12H2O
Старые пятна перманганата калия содержат
оксид марганца (IV), поэтому будет протекать еще
одна реакция:
MnO2 + 3H2O2 + 2CH3COOH =
Mn(CH3COO)2 + 2O2 + 4H2O
12.
13.
Используя схемы, данные на уроке, закончитеуравнения реакций и расставьте в них коэффициенты:
• AI + H2SO4 (конц.) →
• Ag + HNO3 (конц.) →
• KBr + KMnO4 + H2SO4 →
Br2 + …… + K2SO4 + H2O








 Химия
Химия








