Похожие презентации:
Проведение расчетов на основе формул и уравнений реакций
1.
МОУ Балтасинская гимназияПроведение расчетов
на основе формул и
уравнений реакций
Хафизова Эльвира Мударисовна
Учитель химии I кв. категории
2.
Цель: Обобщить и систематизировать знанияучащихся в области решения задач. Закрепить
умения и навыки по решению задач, с
использованием понятий массовая доля.
План урока:
1. Вычисления массовой доли химического
элемента в веществе.
2. Вычисления массовой доли растворенного
вещества в растворе.
3. Вычисления с помощью уравнений реакций.
3.
0Головоломка «Уравнения связи»
m
n
M
mв-ва
mр-ра
W
n
N
V
Vm
W
Ar·n
C
Na
W
mр-ра
mпр
NA
Mr
mв-ва
V
mтеор
mр-ра Vр-ра
Рр-ра
W
N
4.
Вычисления массовой доли химическогоэлемента в веществе.
1 MgSiO3
2 AI(NO3)3
3 AI(NO3)3
4 Fe(NO3)3
5 Fe(NO3)3
48%
19,7%
67,6%
59,5%
17,4%
6 AI2(SO4)3
7 Fe(NO3)3
9Fe2(SO4)3
10Fe2(SO4)3
56,1%
23,1%
48%
24%
B2O3
15 AI2(SO4)3
31,4%
28,1%
11AI2(SO4)3
28,1%
16 CuSO4
40%
12 BaSiO3
22,5%
17 Fe(NO3)3
17,4%
8 CuSO4
40%
13 Fe(NO3)3
17,4%
18 CuSO4
40%
14
19 AI(NO3)3
20 MgSiO3
19,7%
48%
5.
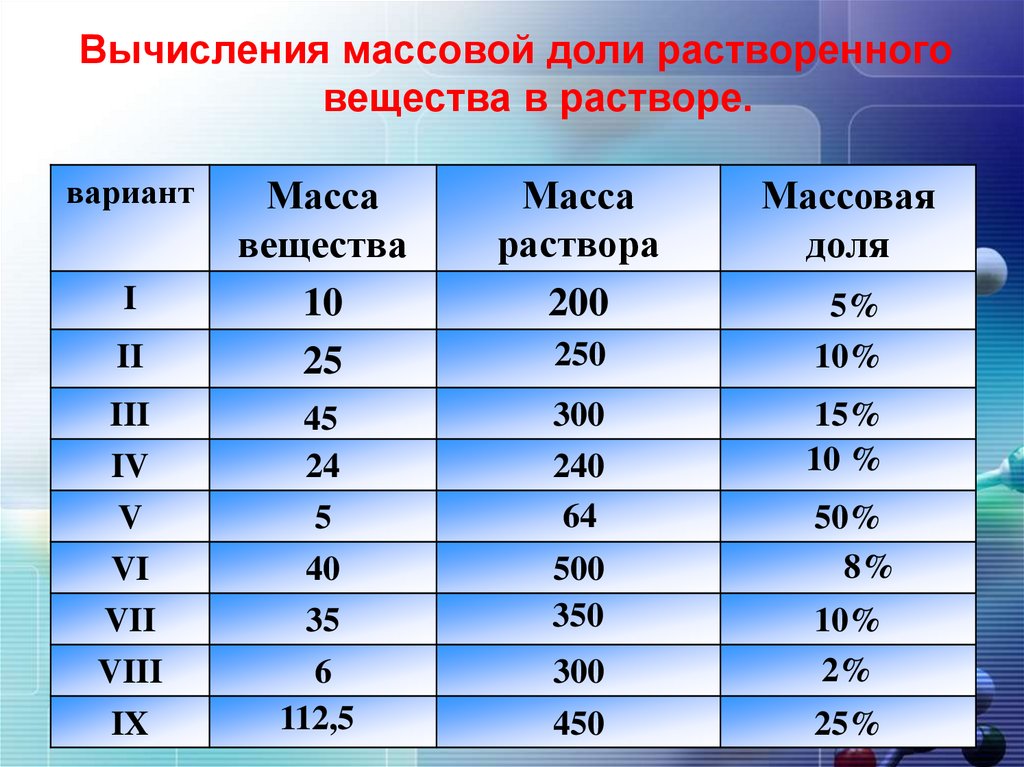
Вычисления массовой доли растворенноговещества в растворе.
вариант
Масса
раствора
200
II
Масса
вещества
10
25
III
IV
V
45
24
5
300
240
64
VI
VII
VIII
40
35
6
112,5
500
350
I
IX
250
300
450
Массовая
доля
5%
10%
15%
10 %
50%
8%
10%
2%
25%
6.
«Химический кроссворд»+
CaO
H2
+
CaCI2
HCI
+
ZnSO4
Ca
Zn
+
S
+
H2
H2S
+
O2
SO2
+
O2
H2
+
SO3
+
H2O
H2SO4
7.
H2Fe2O3
H2SO4
Na
Ca
S
HNO3
O2
8.
Вычисления с помощью уравненийреакций.
1. Составляем уравнение реакции
2. Определяем молярные массы
(для газов- молярные объемы) и
записываем их,
3. Находим число молей вещества, массу
или объем которого известны,
4. Определяем по уравнению реакции, в
каких мольных соотношениях находятся
взятые для расчета вещества,
5. Рассчитываем массу или объем искомого
вещества
6. Формулируем ответ.
9.
Задача:Вычислите объем водорода, выделившегося при
взаимодействии цинка массой 13 г, с разбавленной
серной кислотой.
1)Zn+H2SO4→ZnSO4+H2↑
2) M(Zn)=65 г/моль
Vm(H2)=22,4 л/моль
3) n(Zn)=m/M
n(Zn)=13г : 65 г/моль=0,2 моль
4) n(Zn)=n(H2)
5) V(H2)= n•Vm
6) V(H2)=0,2моль•22,4л/моль=4,48л
Ответ: 4,48 л.
10.
Избыток или недостаток?Запомните:
1)Приступая к решению задачи, надо
обратить внимание на наличие «лишних»
данных в ее условии: они указывают на то,
что одно из реагирующих веществ взято в
избытке.
2) если это имеет место, надо провести
расчет по уравнению реакции и
обнаружить это вещество,
3) решать задачу, используя в расчетах тот
реагент, который израсходуется
полностью










 Химия
Химия








