Похожие презентации:
Фронтальная беседа
1. Фронтальная беседа
1.С каким химическим элементом и простымвеществом вы сейчас знакомитесь?
2.Какие соединения этого элемента вы уже изучили?
3.С каким из этих соединений вы часто
сталкиваетесь в жизни?
4.Для каких целей его используем и на каких
свойствах этого вещества оно основано?
5. Какой концентрации раствор нашатырного
спирта? Бывает ли раствор аммиака другой
концентрации?
2. Решите задачу:
1.***Сколько воды необходимо добавитьк100г. 25% раствора аммиака чтобы
получить 10% раствор аммиака?
2.**К 100г. 25% раствора аммиака
добавили 400г. воды. Какова массовая доля
аммиака во вновь полученном растворе?
3*.Определите массу аммиака в 100г. 25%
раствора аммиака.
3. Практическое задание:
В двух пробирках находятся солинеобходимо узнать в какой из пробирок
находится соль аммония? Как это сделать?
4.
5.
Как вы думаете, какие цели и задачи можносформулировать по этой проблеме?
6. Цели урока:
изучить свойства оксидов азота, повторитьклассификацию и основные свойства
оксидов и где они применяются?
7. 1) Третий лишний
1. N2O3NO2
NH3
2.
NO
N2O5
N 2O
8. 2) Игра крестики-нолики: Отметьте крестиком правильно составленные формулы оксидов азота
N2 ON2O5 NO
N4O3
NO2 N2O6
N3O2
NO3 N2O3
9. Проверка:
1) Третий лишний: 1. NH3 ; 2. N2O52) Крестики-нолики:
N2 O
N2O5
NO2
NO
N2O3
10.
Виды оксидов азотаN+12O
+2
NO
+3
N
2 O3
N2O – оксид азота(I)
NO – оксид азота(II)
+4
NO
2
+5
N
2 O5
Несолеобразующие оксиды, т.к.
не взаимодействуют при обычных
условиях с кислотами и щелочами
с образованием солей.
N2O3 – оксид азота(III) - азотистый ангидрид
NO2 – окcид азота(IV) и его димер N2O4 – ангидриды
азотной и азотистой кислот.
N2O5 – азотный ангидрид
Кислотные оксиды
11.
Наиболее важные из 5 оксидов азотаявляются оксид азота-2 и оксид азота-4
Задание: Заполните таблицу
«сравнительная характеристика оксидов
азота».
12.
Признаки1.Агрегатное состояние,температура
плавления и кипения
2.Цвет
3.Токсичность для организма
4.Отношение к воде
5.Кислотно-основные свойства
6.Окислительно-восстановительные
свойства
7.Особые свойства
8.Получение
а) промышленности
б) лаборатории
9. Применение
NO
Mr(NO)= 30
NO2
Mr (NO2)= 46
13.
Оксид азота(II) - NOФизические свойства. Бесцветный газ, при низких
температурах - голубая жидкость. В твердом состоянии димеризован (N2O2). Не растворим в воде.
t0(плав) = -1640С, t0(кип) = - 151,70С.
Получение. 1. При реакции неактивных металлов с
разбавленной азотной кислотой:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
2. При каталитическом окислении аммиака:
4NH3 + 5O2 = 4NO + 6H2O
3. При взаимодействии с кислородом воздуха:
N2 + O2 = 2NO (t0 ≥ 20000C, кат. Pt/Rh)
4. При взаимодействии нитритов с серной кислотой:
2 NaNO2 + H2SO4 = Na2SO4 + NO + NO2 + H2O
14.
Химические свойства. Очень реакционноспособноевещество. Может проявлять и окислительные и
восстановительные свойства.
1. При обычной температуре окисляется кислородом
воздуха:
2NO + O2 = 2NO2
2. Восстановитель:
NO + NO2 = N2O3
2NO + Cl2 = 2NOCl (нитрозилхлорид)
3. Окислитель:
2NO + 2SO2 = 2SO3 + N2
2NO + 2Н2 = N2 + 2Н2О (2000С)
2NO + 2Cu = N2 + 2CuO (5000С)
2NO + 2H2S = N2 + 2S + 2Н2О (3000С)
4. Взаимодействует с органическими веществами.
Примененяется. В производстве азотной кислоты.
15.
Оксид азота(IV) - NO2Физические свойства. Это красно-бурый газ с резким запахом.
При низких температурах из-за наличия у атомов азота
неспаренных электронов димеризуется в N2O4. Димер в
жидком состоянии бесцветный, в твердом - белый. t(пл) = -11,20С.
Хорошо растворяется в холодной воде. Насыщенный раствор
имеет ярко-зеленый цвет.
Получение.
1. Термическим разложением нитратов металлов,
расположенных в ряду активности в интервале Al-Сu:
2Cu(NO3)2 = 2CuO + 4NO2 + O2
2. Взаимодействием меди с концентрированной азотной
кислотой:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
3. Окислением оксида азота(II):
2NO + O2 = 2NO2
16.
Химические свойства.1. Взаимодействие с водой:
2NO2 + H2O(хол) = HNO3 + HNO2
3NO2 + H2O(гор) = 2HNO3 + NO
2. Взаимодействие с растворами щелочей:
2NO2 + 2КОН = КNO3 + КNO2 + Н2О
3. При растворении в воде в присутствии кислорода:
4NO2 + 2H2O + О2 = 4HNO3
Используется в промышленном способе получения
азотной кислоты.
3. Хороший окислитель:
NO2 + SO2 = SO3 + NO
2NO2 + 4Cu = 4CuO + N2 (500-6000C)
17.
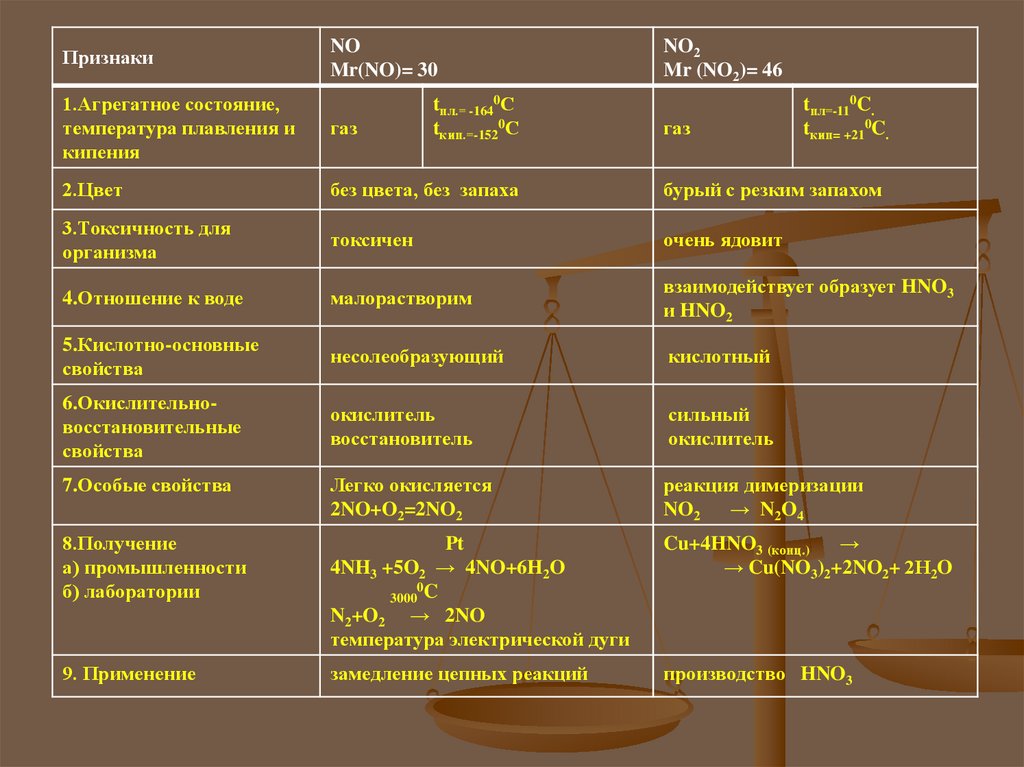
ПризнакиNO
Mr(NO)= 30
tпл.= -1640С
tкип.=-1520С
NO2
Mr (NO2)= 46
1.Агрегатное состояние,
температура плавления и
кипения
газ
2.Цвет
без цвета, без запаха
бурый с резким запахом
3.Токсичность для
организма
токсичен
очень ядовит
4.Отношение к воде
малорастворим
взаимодействует образует HNO3
и HNO2
5.Кислотно-основные
свойства
несолеобразующий
кислотный
6.Окислительновосстановительные
свойства
окислитель
восстановитель
сильный
окислитель
7.Особые свойства
Легко окисляется
2NO+O2=2NO2
реакция димеризации
NO2 → N2O4
8.Получение
а) промышленности
б) лаборатории
Pt
4NH3 +5O2 → 4NO+6H2O
0
3000 C
N2+O2 → 2NO
температура электрической дуги
Cu+4HNO3 (конц.) →
→ Cu(NO3)2+2NO2+ 2Н2O
9. Применение
замедление цепных реакций
производство HNO3
газ
tпл=-110C.
tкип= +210C.
18. Домашнее задание:
п. 29.Сообщение на тему «Очистка выхлопных
газов автотранспорта».


















 Химия
Химия








