Похожие презентации:
Уравнения химических реакций. Проставить валентность, дать названия веществам. Указать тип ХР
1.
2. Cоставить уравнения химических реакций. Проставить валентность, дать названия веществам. Указать тип ХР.
III III III
Al2O3 + 2H3PO4
Оксид
алюминия
Фосфорная
кислота
III
III
2AlPO4 + 3H2O Р.О
Фосфат
Алюминия
(соль)
вода
3.
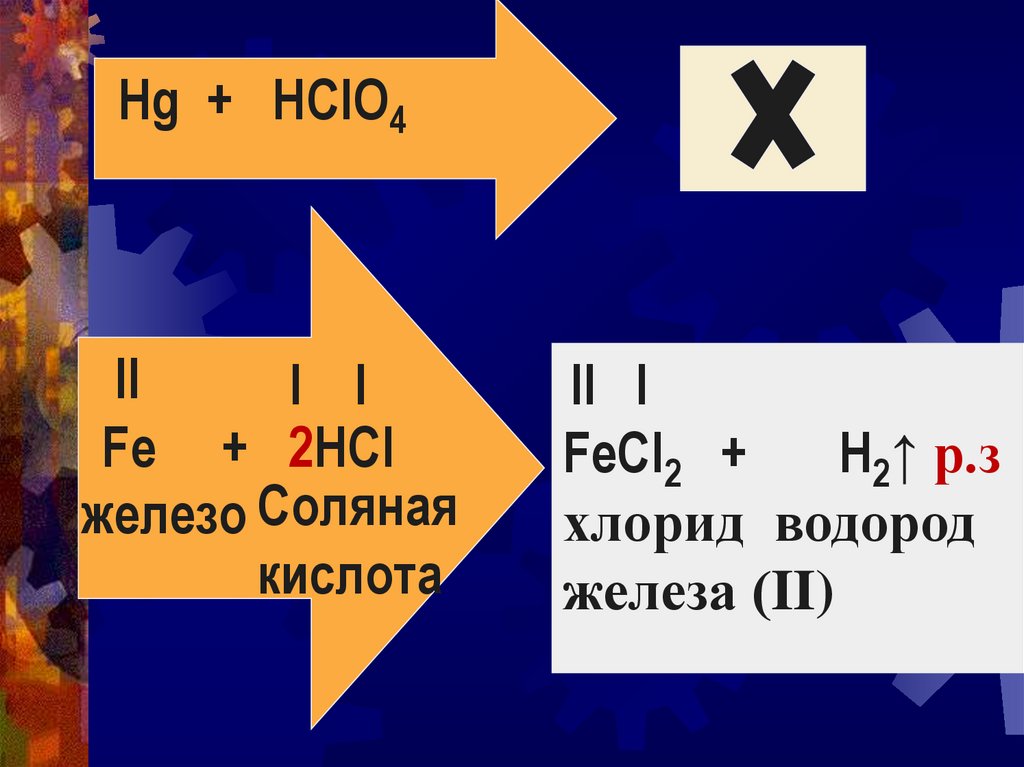
Hg + HClO4II
I I
Fe + 2HCl
железо Соляная
кислота
II I
FeCl2 +
H2↑ р.з
хлорид водород
железа (II)
4. Тема урока: «Основания. Состав, классификация, свойства.»
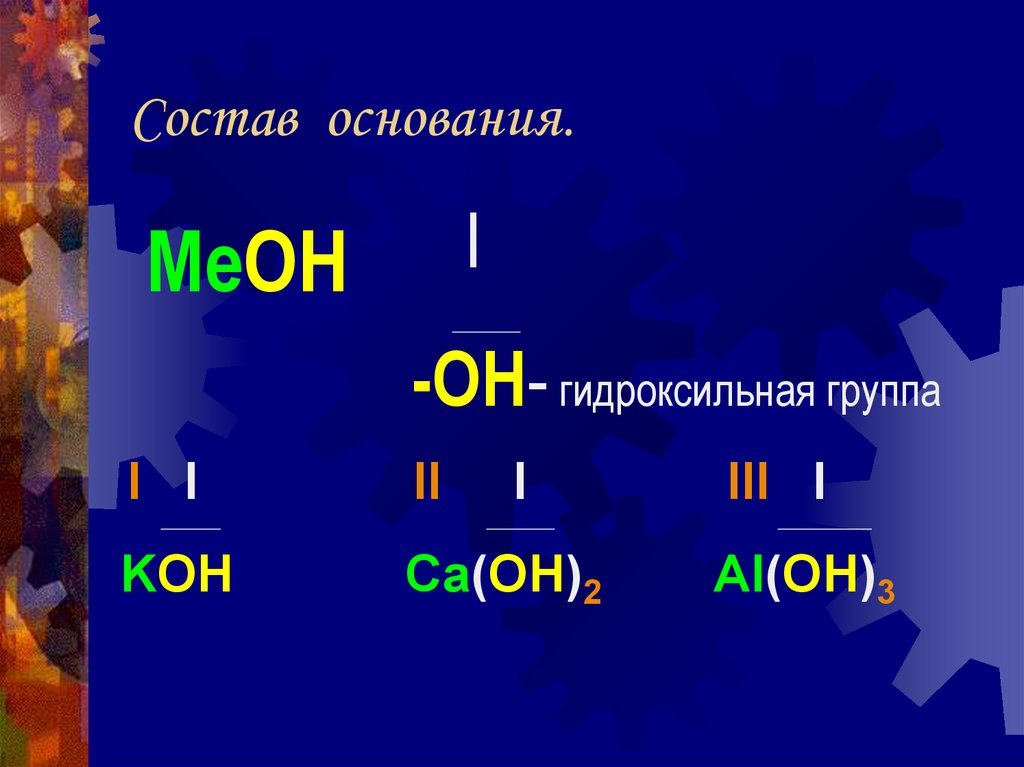
5. Состав основания.
IMeOH
-OH- гидроксильная группа
I I
II
I
KOH
Ca(OH)2
III I
Al(OH)3
6. Классификация растворимые нерастворимые (щелочи) ( ) (см. таблицу растворимости)
LiOHNaOH
Ba(OH)2
Ca(OH)2
Zn(OH)2
Cu(OH)2
Al(OH)3
Fe(OH)3
7. Номенклатура
Слово «гидроксид» + название металла,если металл имеет переменную валентность, в скобках
указываем эту валентность
NaOH
II
гидроксид натрия
I
Fe(OH)2
гидроксид железа (II)
III I
Fe(OH)3
гидроксид железа (III)
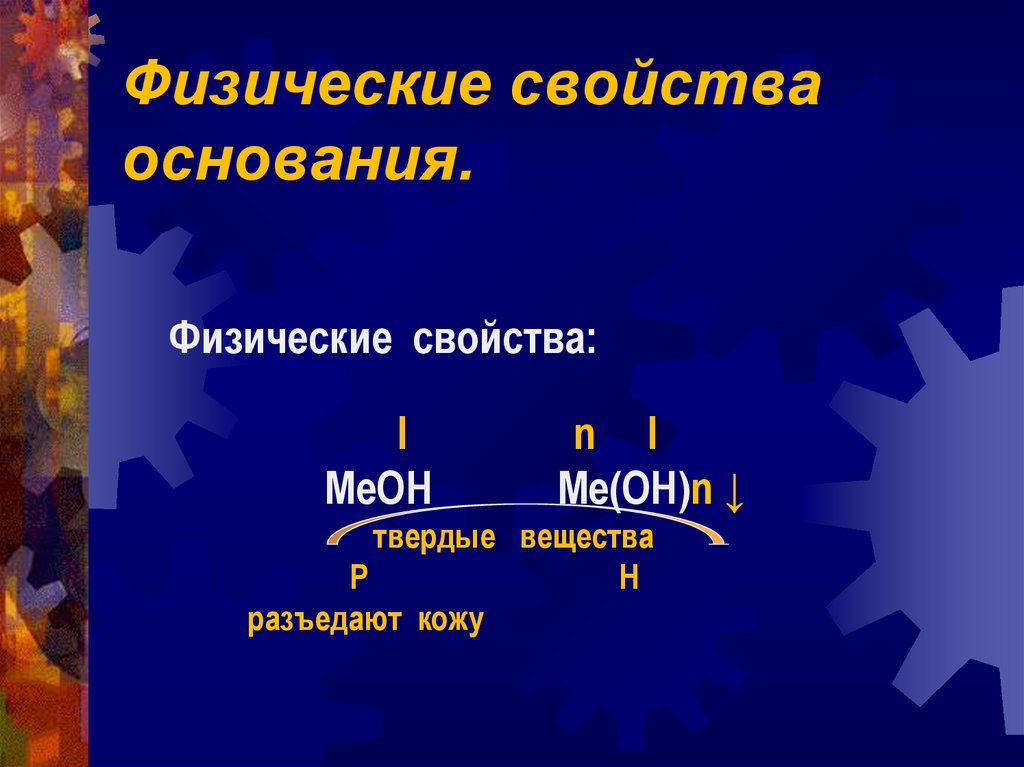
8. Физические свойства основания.
Физические свойства:I
MeOH
n I
Me(OH)n ↓
твердые вещества
Р
Н
разъедают кожу
9. Получение оснований
Растворимых:основный оксид + вода → щелочь
нерастворимых:
растворимая соль + щелочь →
нерастворимое основание + вода
10. Д/З
§ 31 стр. 93 – 95 до химическихсвойств.
? 3 стр. 99 письменно
? 2 стр. 99 устно
11.
Урок № 2.«Верю - неверю»
Я загадала основание:
2в – гидроксид марганца (II);
4в – гидроксид хрома (III)
Да –
Нет -
1в – гидроксид лития;
3в – гидроксид бария;
1. Веришь ли ты, что основания это сложные вещества,
состоящие из атомов водорода и гидроксильной группы
2. .., что основание имеет формулу:
1в – Li(OH)2, 2в - Mn(OH)2, 3в – BaOH, 4в - CrOH
3. .., что основание по классификации – растворимое?
4. Запиши формулу основания, укажи классификацию
12.
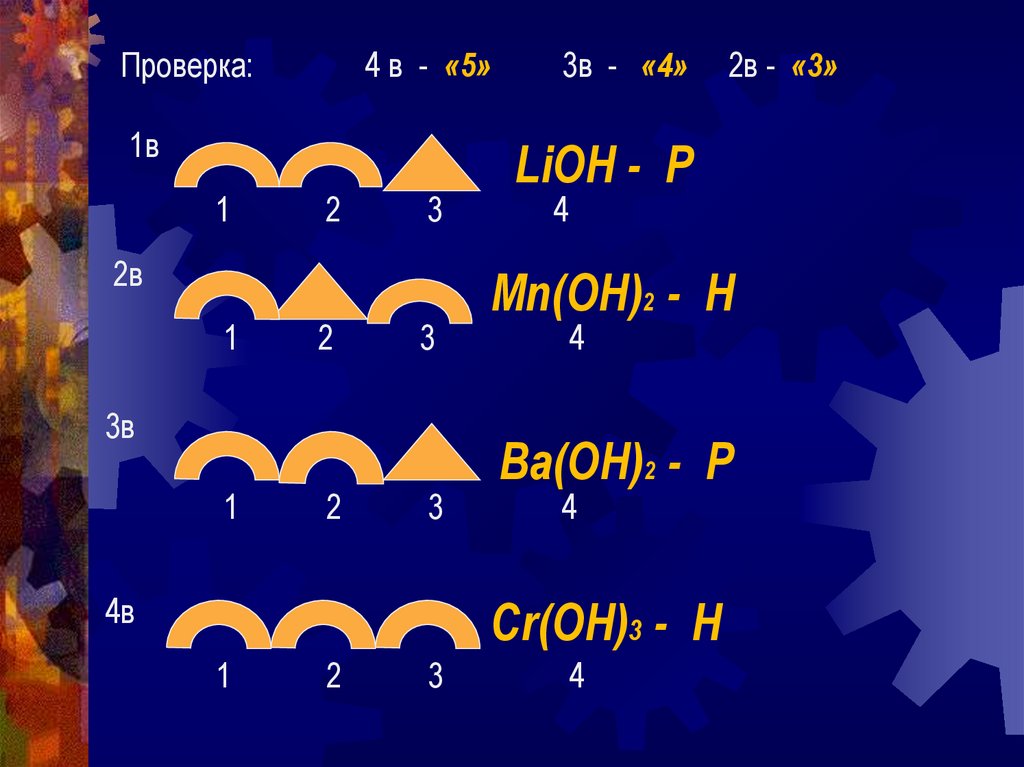
Проверка:4 в - «5»
1в
1
2
3
2в
1
2
3
3в
1
2
3
4в
3в - «4»
LiOH - Р
4
Mn(OH)2 - Н
4
Ba(OH)2 - Р
4
Cr(OH)3 - Н
1
2
3
2в - «3»
4
13.
Алгоритм №1 «Действие индикаторов»
1. Прилейте в три пробирки 1-2мл раствора
гидроксида натрия – NaOH.
2. В первую пробирку добавьте две капли –
лакмуса, во вторую – метилового оранжевого,
в третью – фенолфталеина.
3. Отметьте цвет индикаторов в пробирке.
4. Сравните полученные результаты с данными
таблицы 5 учебника (стр. 74)
5. Сделайте запись в тетрадь:
На полях записать: Действие индикаторов на растворы
щелочей (растворимых оснований)
За полями: лакмус - ?, М/О - ?, Ф/Н - ?
14. Алгоритм № 2: «Действие индикаторов на нерастворимые основания». 1. Получите нерастворимое основание: в пробирку прилейте 1
-2мл раствора соли(сульфата меди II) СuSO4
2. Добавьте к этому раствору соли 1 – 2мл
щелочи - NaOH.
3. Полученный осадок разлейте в три
пробирки.
4. В каждую из трех пробирок добавьте
индикаторы: Л, М/О, Ф/Н.
5. Что вы наблюдаете? Изменился ли цвет
индикаторов?
6. Сделайте вывод?
15. Химические свойства.
Алгоритм № 3 «Взаимодействие оснований с кислотами».1. Налейте в пробирку раствор соляной кислоты.
2. Добавьте 2-3 капли лакмуса. Как изменилась его
окраска?
3. Затем по стеклянной палочке по каплям добавьте
раствор щелочи до тех пор, пока цвет раствора не
станет фиолетовым.
4. Почему в образовавшемся растворе лакмус имеет
фиолетовую окраску?
5. Составьте уравнение химической реакции:
NaOH + HCl → ? + ?
6. Укажите признак, тип реакции нейтрализации,
назовите продукты реакции.
16.
Взаимодействуют ли с кислотами нерастворимыеоснования?
Алгоритм № 4.
1. Получите гидроксид железа (III).
2. Для этого прилейте в пробирку по 1 мл растворов гидроксида
натрия и хлорида железа (III).
3. Обратите внимание на цвет образовавшегося осадка.
4. Составьте уравнение химической реакции. Установите, какое
вещество явилось осадком? NaOH + FeCl3→ ? + ? ↓
5. К полученному осадку добавьте 1 мл
раствора серной кислоты.
6. Что вы наблюдаете? Какого цвета получился
раствор?
7. Установите признак химической реакции?
8. Составьте уравнение химической реакции:
Fe(OH)3 + H2SO4 → ? + ?
17. Домашнее задание: § 18 стр.92 – 94 ? 5 стр. 97 ? 3(а,б) стр. 97
18.
Алгоритм № 5 «Разложение нерастворимых оснований»1. Возьмите пробирку с гидроксидом железа
(III).
2. Укрепите эту пробирку в держателе или в
штативе слегка наклонно.
3. Зажгите спиртовку и осторожно прогревайте
всю пробирку, а затем ту ее часть, где
находится гидроксид железа (III).
4. Как изменился цвет вещества?
5. Что вы замечаете на стенках пробирки?
6. Какие продукты образовались, составьте
реакцию разложения: Fe(OH)3 → ? + ?
19. Вывод: Растворимые основания (щелочи) реагируют с а) кислотами б) кислотными оксидами в) изменяют окраску индикаторов.
Нерастворимые основанияреагируют с
а) кислотами;
б) разлагаются при нагревании на
основный оксид и воду.
20. Домашнее задание: § 18 стр.92 – 97 ? 1, 5(а,г) стр. 97 1 уровень ? 3(б,в) стр. 97 2 уровень
21. Закрепление: Закончите уравнения возможных реакций:
А) LiOH + P2O5 →б) KOH + FeO →
B) Cu(OH)2 + SO2 →
Г) LiOH →
Д) Cu(OH)2 →

















 Химия
Химия








