Похожие презентации:
Химический элемент – углерод, его особенности и свойства
1.
Информация к размышлениюКонспект
Работа в группе
Фронтальная работа
Работа в паре
Самостоятельная работа
1
2.
Интеллектуальная разминкаПереход на следующий слайд – гиперссылка – клик по ребусу
2
3.
Тема урока:Углерод-
3
4.
Цель урока• Рассмотреть химический элемент –
углерод, его особенности и
свойства.
4
5.
Выбор проблемного вопроса???
Ваш
вопрос
5
6.
Актуализация знанийКакой период в истории Земли носит название
КАРБОНА? Чем он характерен?
Какое явление носит название – АЛЛОТРОПИЯ?
Что такое ГРАФИТ?
Как называется МИНЕРАЛ, превосходящий все
остальные по блеску, красоте и твёрдости?
Перечислите вещества, используемые в качестве
ТОПЛИВА. Что лежит в основе всех этих веществ?
Выделенный текст – гиперссылка - самопроверка
6
7.
Задачи урокаИзучить:
Положение углерода в ПСХЭ
Строение атома углерода
Углерод в природе
Аллотропию углерода
Химические свойства углерода
Применение углерода
Роль углерода в природе
Каждый пункт – гиперссылка- переход на слайд
7
8.
8Гиперссылка – клик по таблице - самопроверка
9.
2 периодIV группа
Главная
подгруппа
А
Z=6
А (С)=12
Р11=6
n10=6
ē=6
•Природный углерод состоит из двух стабильных нуклидов:
•12С 98,892% по массе
•13C —
1,108%.
•В природной смеси нуклидов в ничтожных количествах всегда
присутствует радиоактивный нуклид 14C с периодом полураспада
5730 лет*.
Для чего используется 14C?
9
10.
Строение атома углеродаЗарисуйте строение атома
углерода и напишите
электронную формулу
Гиперссылка – клик по картинке - самопроверка
10
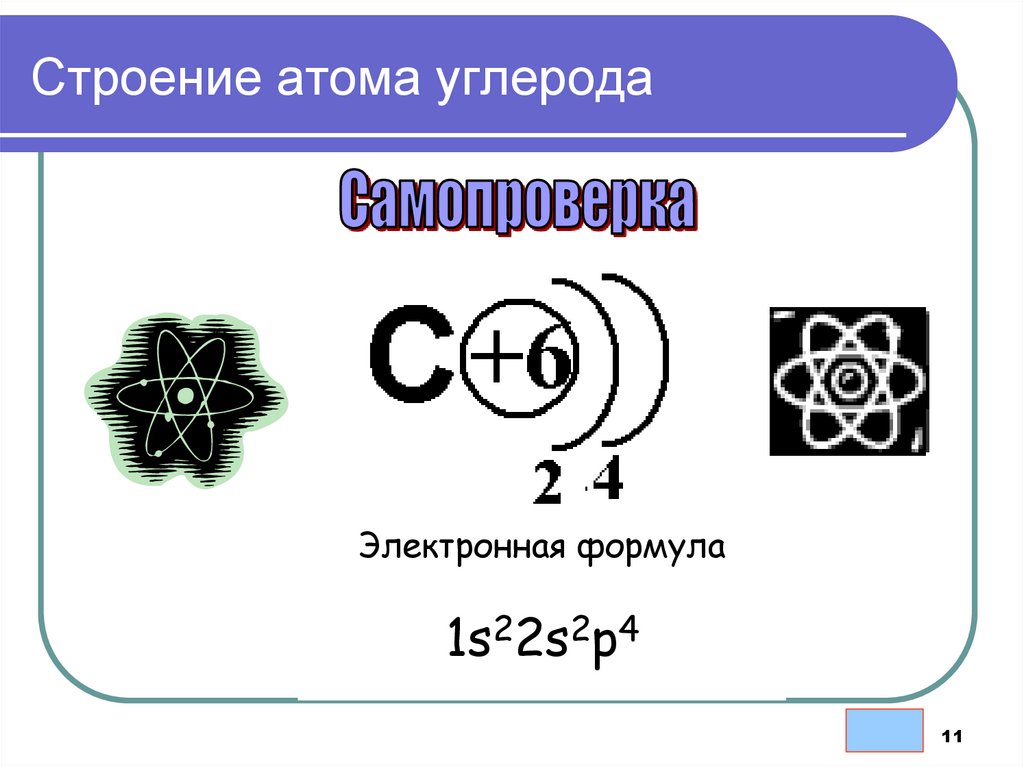
11.
Строение атома углеродаЭлектронная формула
1s22s2p4
11
12.
Расположение электроновв атоме углерода
2p2
2s2
1s2
+6
Расположение электронов в атоме углерода в
нормальном состоянии
2p3
2s1
1s2
12
Расположение электронов в атоме углерода в возбуждённом состоянии
13.
Степень окисления ССН4
-4
+4 (+2)
+2
окислитель
восстановитель
восстановитель
Са2С
С=О
СО2
СО
Назовите все вещества
Укажите тип химической связи
13
14.
Содержание в природеСодержание в земной коре 0,48% по массе.
14
15.
Углерод в природеВ свободном виде
•Графит
•Алмаз
•Аморфный
углерод
Сажа
Кокс
В соединениях
*Углекислый газ
-Все живые организмы
- Нефть
- Уголь
- Торф
Используя 10-12 слов,
Древесный составьте на следующем
слайде кроссворд
уголь
«Углерод в природе»
-Минералы
*известняк
*мел
*мрамор
*магнезит
*доломит
15
16.
__________________________________
_________________
_________________
_________________
_________________
_________________
_________________
_________________
_________________
_________________
_________________
16
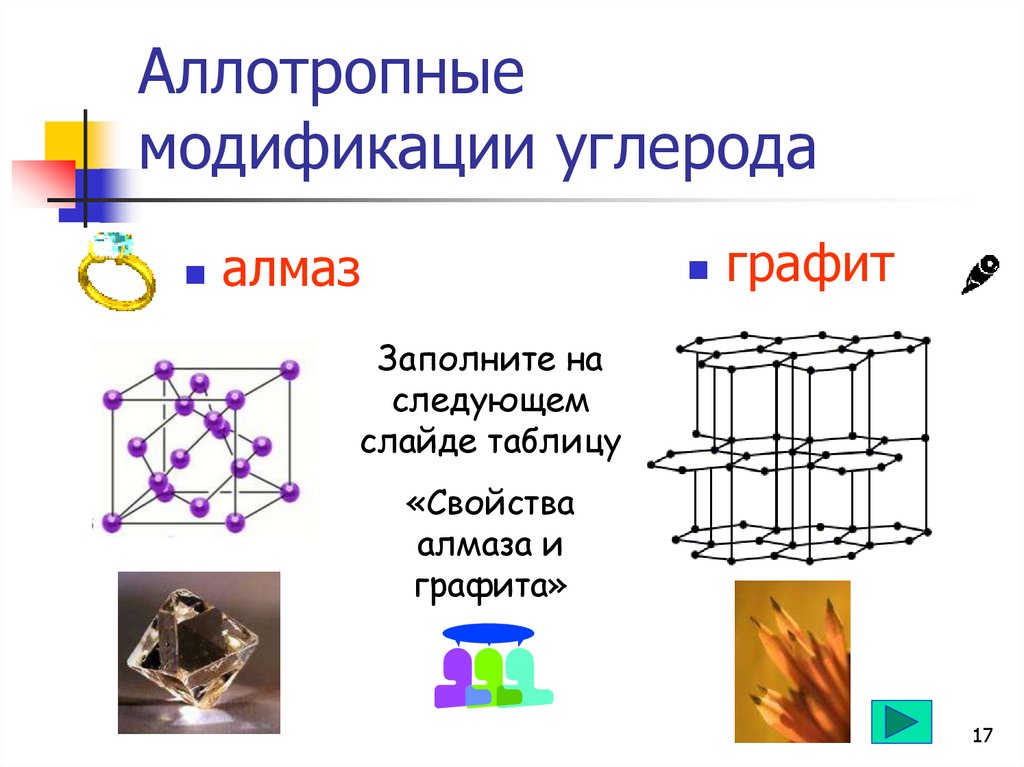
17.
Аллотропныемодификации углерода
алмаз
графит
Заполните на
следующем
слайде таблицу
«Свойства
алмаза и
графита»
17
18.
Признаки сравненияАлмаз
Графит
18
19.
Алмазалмас
адамас
арабский
ТВЕРДЕЙШИЙ
греческий
НЕСОКРУШИМЫЙ
1 карат = 0,2 грамм
ОРДЕН
Святого
Андрея
Первозванного
Алмаз «Орлов», 189,62 карат
Алмазный фонд РФ, вмонтирован в скипетр
Сколько весит этот алмаз в граммах?
19
20.
Информация кразмышлению
О ком и о
чём идёт
речь?
Составьте рассуждение на тему (3-5
предложений)
20
21.
Используя заготовки, составьте схему«Применение алмазов»
Применение
алмазов
Стеклорезы
Свёрла,
буры
Ювелирные
Шлифовка изделия
21
22.
Вопрос – ответ:1. Чему равна твёрдость
алмаза?
2. Какого цвета могут быть
кристаллы алмаза?
3. Что такое бриллиант?
4.
5.
6.
7.
8.
Составьте ещё 5-7
вопросов по
материалам учебника.
http://www.poisk.ru
Найдите в Интернете
информацию о самых
известных алмазах
Работа с учебником
22
23.
Заполните пропуски в схеме:Применение графита
Стержни карандашей
?
?
?
?
Вставьте подходящие изображения из
Коллекции картинок
23
24.
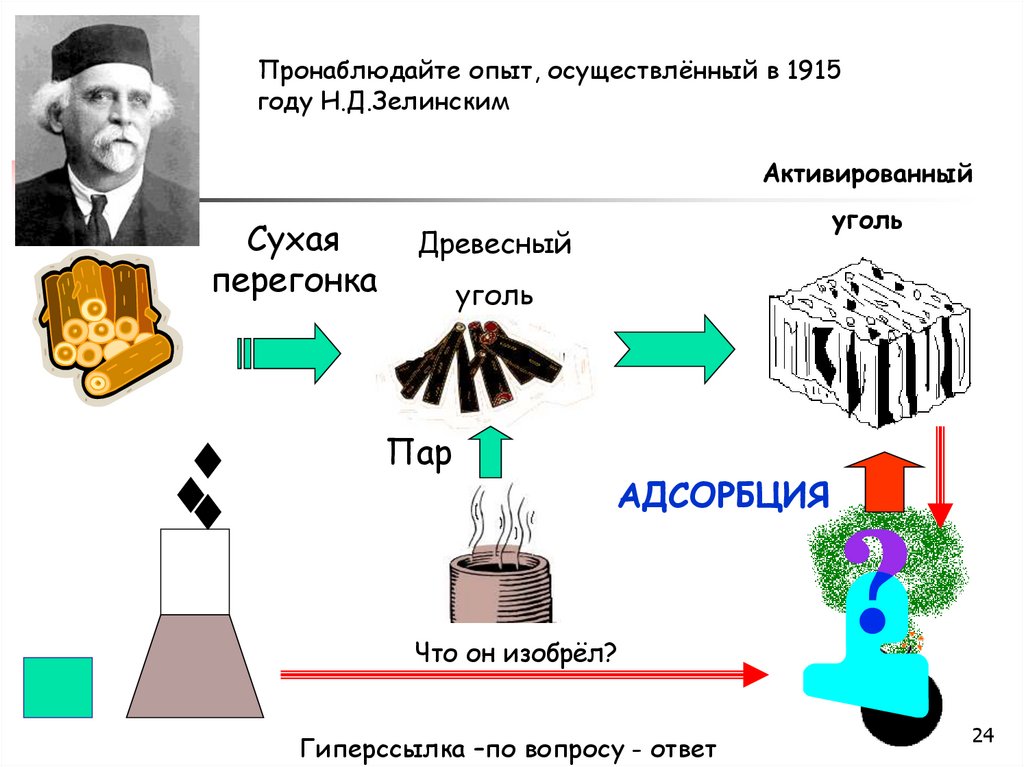
Пронаблюдайте опыт, осуществлённый в 1915году Н.Д.Зелинским
Активированный
Сухая
перегонка
уголь
Древесный
уголь
Пар
АДСОРБЦИЯ
Что он изобрёл?
Гиперссылка –по вопросу - ответ
24
25.
Химические свойства +-с водой,
углерода
С
О2
Н2
СО2
СО
СН4
+
МЕТАЛЛ
КАРБИД
+Н2О
-с оксидами
неметаллов
-с кислотами
ОКСИД
МЕТАЛЛА
МЕТАЛЛ
F2
СF4
ГАЗ
Углерод: восстановитель или окислитель?
25
26.
Работа в парах•Напишите реакции получения:
•1 в-т
2 в-т
1.
2.
3.
4.
5.
Карбида алюминия
1. Карбида кальция
(ОВР)
(ОВР)
Ацетилена
2. Метана
Цинка (ОВР)
3. Железа (II) (ОВР)
Кремния из его оксида 4. Фторида углерода,
Взаимодействия с
5. Взаимодействия с
серной кислотой
азотной кислотой (конц.)
(конц.)
Проведите взаимопроверку
Гиперссылка – по рисунку - самоконтроль
26
27.
Применение углеродаДополните схему
27
28.
На основе 3-х слайдов составьтевыводы о роли углерода для жизни
на Земле
28
29.
Биогенные элементы29
30.
Круговорот углерода30
31.
12e1.
2.
Ответы к заданиям
4e
4Al0 + 3C0=Al4+3C3-4; 2Са0+С0=Са+22С-4 ;
CaC2+2H2O=Ca(OH)2+C2H2 ↑ ;
Al4C3+12H2O=4Al (OH)3 +3CH4 ↑ ;
4е
2е
3. 2ZnО+С= 2Zn+СО2 ;FeО+С= Fe +СО ;
4. SiО2+2С= Si+2СО2 ; 2F2+С=СF4;
5. С+2Н2SО4(к)= СО2↑ +SО2↑ +2H2O;
3С+4НNО3(к)= 3СО2↑ +4NО+ 2H2O.
31
32.
Домашнее задание,
,
§ 28 стр.126-134,
№5,6,8
2,3,1
о→ы
и→ы
о→е
,β,
,
,,
Белый зайчик прыгает по черному полю. (МЕЛ, карбонат)
Отгадка спрятана в слайде
32
33.
Каменноугольный период33
34.
АЛЛОТРОПИЯ- существование химических элементов
в виде двух или более кристаллических
фаз (модификаций, разновидностей)
34
35.
Графит – это минералНаиболее распространенная и устойчивая в
земной коре модификация углерода.
Используется в производстве в литейном
деле, при изготовлении электродов,
щелочных аккумуляторов, карандашей и т.
д.
Блоки из чистого искусственного графита
используют в ядерной технике, в качестве
покрытия для сопел ракетных двигателей.
35
36.
Алмаз36
37.
Топливо•горючие вещества, применяемые для получения при
их сжигании тепловой энергии;
•основная составная часть — углерод.
•По происхождению топливо делится на:
• природное:
*искусственное
•нефть,
- кокс,
•уголь,
- моторные топлива
•природный газ,
-генераторные газы
•горючие сланцы,
и др.
•торф,
•древесина.
37
38.
Противогаз38
39.
Рефлексия1.
2.
3.
4.
5.
Без какого газообразного вещества любое
растение не может развиваться?
Что является наполнителем в производстве
резины из каучука?
Как называется соединение углерода с
любым металлом?
Какое простое вещество имеет самую
высокую температуру плавления?
Какое вещество создаёт парниковый
эффект?
39
40.
Ответы1.
2.
3.
4.
5.
Углекислый газ
Сажа
Карбид
Графит
Углекислый газ
40



































 Химия
Химия