Похожие презентации:
Фракционирование клеточных экстрактов
1. БИОТЕХНОЛОГИЯ
НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТБИОТЕХНОЛОГИЯ
Часть 2.
Фракционирование
клеточных экстрактов
2. ФРАКЦИОНИРОВАНИЕ ПРОДУКТОВ БИОСИНТЕЗА
• После завершения процесса выращиваниякультуры продуцента получается система,
содержащая наряду с целевым продуктом все
остальные компоненты: остатки питательной
среды, компоненты клеток микроорганизмов и
продукты их метаболизма. Дальнейшие стадии
процесса направлены на выделение из этой
сложной смеси целевого продукта, что часто
представляет собой достаточно сложную задачу
и требует использования разнообразных
технологических приемов.
2
3.
ОБЩАЯ СХЕМАБИОТЕХНОЛОГИЧЕСКОГО ПРОЦЕССА
ПРОДУЦЕНТ
КУЛЬТИВИРОВАНИЕ
КУЛЬТУРА
ПРОДУЦЕНТА
СЕПАРАЦИЯ
КУЛЬТУРАЛЬНАЯ
ЖИДКОСТЬ
КЛЕТОЧНАЯ
МАССА
концентрирование
дезинтеграция
КОНЦЕНТРАТ
ЦЕЛЕВОГО ПРОДУКТА
ГОМОГЕНАТ
фракционирование
ПРОДУКТЫ
ВНЕКЛЕТОЧНЫЕ
ВНУТРИКЛЕТОЧНЫЕ
3
4. СПЕЦИФИЧНОСТЬ ТЕХНОЛОГИЧЕСКИХ СТАДИЙ
• Технологический процесс – совокупность ипоследовательность технологических
процедур, приводящих к получению
целевого продукта из исходного сырья.
• При разработке промышленного
технологического процесса важными
являются некоторые критерии для
сравнения эффективности процесса и его
отдельных стадий.
4
5. СПЕЦИФИЧНОСТЬ ТЕХНОЛОГИЧЕСКИХ СТАДИЙ
log pfФазы процесса:
3,0
2,0
I – фаза грубого
фракционирования;
1,0
II – фаза основной
очистки;
1
I
2
3
II
4
5
III
Номер
технологической
стадии
Обобщенное представление
технологического процесса
III – фаза
финишной
очистки
5
6. СПЕЦИФИЧНОСТЬ ТЕХНОЛОГИЧЕСКИХ СТАДИЙ
Для сравнения специфичности отдельных стадийтехнологического процесса можно ввести величину –
коэффициент специфичности:
Этот коэффициент представляет собой
i+1 отношение степени обогащения
продукта на i+1-й стадии процесса к
степени обогащения на предыдущей i-й
i
стадии.
При этом можно условиться, что специфичной
считается стадия, для которой k ≥ 5. Эта величина
выбрана, исходя из того, что три последовательных
стадии с таким коэффициентом позволяют очистить
продукт ~ в 100 раз.
6
p
k=
p
7. ЭТАПЫ ФРАКЦИОНИРОВАНИЯ
• Полученная на стадии ферментации культурапродуцента содержит целевой продукт либо в
биомассе клеток (внутриклеточный продукт),
либо в культуральной жидкости
(внеклеточный продукт).
• В любом из этих вариантов первой стадией
фракционирования культуры является
отделение клеточной массы от жидкой фазы –
культуральной жидкости.
• Разделение твердой (биомасса) и жидкой фаз
сводится к задаче разделения суспензий.
7
8. ЭТАПЫ ФРАКЦИОНИРОВАНИЯ
• Задача разделения суспензий решаетсяобычно методами седиментации.
• Если представить себе систему в виде
суспензии малых сферических частиц в
жидкости, движение этих частиц может быть
описано (приближенно) уравнением Стокса:
2
gD
u=
ρ - ρ0
18η
u – скорость движения частиц;
g – ускорение силы тяжести;
D – диаметр частицы;
η – вязкость дисперсионной среды
ρ,ρ0 – плотность дисперсной фазы и
дисперсионной среды соответственно
8
9. ЭТАПЫ ФРАКЦИОНИРОВАНИЯ
• Для малых частиц скорость седиментации вполе силы тяжести мала, тем более, что она
снижается за счет броуновского движения.
• В связи с этим седиментацию проводят в
специальных аппаратах – центрифугах или
сепараторах, в которых система помещается в
центробежное поле, в котором ускорение
свободного падения заменяется
центробежным ускорением.
9
10. ЭТАПЫ ФРАКЦИОНИРОВАНИЯ
Конструкции роторов центрифуг – проточныероторы: осветляющий (А) и сепарирующий (Б)
Регулировочное кольцо
Выход легкой фазы
Легкая фаза
Выход тяжелой фазы
Тяжелая
фаза
А
Осадок
Б
10
11. ЭТАПЫ ФРАКЦИОНИРОВАНИЯ
Попытаемся проанализировать работу проточной центрифуги.В режиме вращения жидкость располагается в роторе в виде
цилиндра высотой h, внешним радиусом r2 и внутренним
радиусом r1. Объем этого цилиндра, очевидно, равен
V = πh r2 2 - r1 2 .
Если мы будем подавать в ротор суспензию со скоростью
Q (см3/с), то время пребывания в роторе объема суспензии V
равно t=V /Q, а путь, который преодолевает частица в
радиальном направлении под действием центробежного поля,
равен
D 2 Δρ V 2
S = ut =
ω r,
18η Q
11
12. ЭТАПЫ ФРАКЦИОНИРОВАНИЯ
Далее:D 2 Δρ ω 2 rV
Q=
= ΘΣ.
18η
S
Видно, что первый сомножитель (Θ) в правой части
этого уравнения определяется свойствами
разделяемой системы (размер частиц, различие
плотностей фаз, вязкость среды), второй (Σ) –
параметрами центрифуги (объем и диаметр ротора,
скорость его вращения). Этот критерий можно
использовать при масштабировании процессов
центрифугирования.
12
13. ЭТАПЫ ФРАКЦИОНИРОВАНИЯ
В трубчатом роторе непрерывного действия частицаперемещается в двух направлениях – вертикально,
вдоль оси ротора вместе с потоком подаваемой
суспензии, и радиально по направлению к стенке
ротора – под влиянием центробежной силы.
Для радиальной составляющей:
dr D 2 Δρ 2
=
ω r.
dt
18η
Для вертикальной составляющей:
dz Qh
Q
=
=
.
2
2
dt
V
π r2 - r1
13
14. ЭТАПЫ ФРАКЦИОНИРОВАНИЯ
Из этих уравненийdr
V D 2 Δρ 2 dr V D 2 Δρ 2
=
ω r,
=
ω dz.
dz Qh 18η
r Qh 18η
Интегрируя полученное уравнение в пределах от r1 до r2 (по r) и
от 0 до h (по z), получаем:
2
r2 V D Δρ 2
ln =
ω
r1 Q 18η
или
D 2 Δρ 2
1
Q=
ωV
.
r2
18η
ln
r1
14
15. ЭТАПЫ ФРАКЦИОНИРОВАНИЯ
Сопоставляя приведенные выше выражения, мыможем заметить, что величина Σ зависит только от
параметров центрифуги
2
и не зависит от природы разделяемой
суспензии и может
2
рассматриваться
как критерий выбора
1
режима и центрифуги.
V
r
ln
r
15
16. ЭТАПЫ ФРАКЦИОНИРОВАНИЯ
Градиентное центрифугированиеПомимо конструктивных параметров центрифуги скорость
осаждения может регулироваться путем подбора соотношения
плотностей дисперсной фазы и дисперсионной среды. Этот
способ оказывается пригодным для фракционирования
клеточных органелл или даже макромолекул.
Одним из вариантов использования этого принципа является
центрифугирование в градиенте плотности растворителя. Если в
состав растворителя ввести компонент, дающий растворы
высокой плотности, то под влиянием центробежного поля в
роторе центрифуги установится
градиент концентрации этого
2
ρ0
ω rx
M 1
ρ'
компонента в соответствии с
c
барометрической формулой Больцмана:
RT
c0
=e
,
16
17. ЭТАПЫ ФРАКЦИОНИРОВАНИЯ
Формирование градиента плотности. Утяжеляющие компонентыВ качестве «тяжелых» компонентов могут использоваться соли,
такие как CsCl (ρ = 1,905), Cs2SO4 (ρ = 1,80), RbCl (ρ = 1,35) и ряд
других.
В соответствии с уравнением для скорости движения частиц в поле
сил в зоне, где плотность дисперсной фазы станет равной
плотности среды, скорость станет равной 0, и движение частиц
прекратится. Такая плотность растворителя называется плавучей
плотностью для данного вещества. Частицы вещества,
оказавшиеся в области раствора, где плотность растворителя
превышает их плавучую плотность, всплывают в зону, где эти
плотности становятся равными.
17
18. МАКСИМАЛЬНО ДОСТИЖИМЫЕ ПЛОТНОСТИ РАСТВОРОВ ГРАДИЕНТООБРАЗУЮЩИХ ВЕЩЕСТВ
КомпонентПлотность,
г / см3
Показатель
преломления
25
1,905
1,4183
Сs2(SO4)
25
1,80
CsI
25
1,55
CsBr
25
1,50
RbCl
25
1,35
CsCl
Концентрация, Температу%
ра, oC
65
Сахароза
66
20
1,322
Метризамид
80
20
1,430
Урограффин
Фиколл
Перколл
1,4555
1,45
50
20
1,171
1,30
18
19. ЭТАПЫ ФРАКЦИОНИРОВАНИЯ
Структура урограффина – смеси натриевой и 1-дезокси-1(метиламино)-d-глюцитовой (метилглюцитовой) солейдиатризоевой кислоты.
19
20. ЭТАПЫ ФРАКЦИОНИРОВАНИЯ
Конструкции роторов центрифуг – проточныйротор препаративной лабораторной центрифуги
20
21. ЭТАПЫ ФРАКЦИОНИРОВАНИЯ
Конструкции центрифуг –проточные роторы: тарельчатый
21
22. ЭТАПЫ ФРАКЦИОНИРОВАНИЯ
Центрифуганепрерывного действия с
тарельчатым ротором.
Разделяемая суспензия
поступает в загрузочную
линию сверху, попадает
в нижнюю часть камеры
и переходит в разделительное пространство,
наполненное коническими тарелками. На
врезке показано
движение жидкой фазы
и осадка, который
собирается у стенки
камеры и вытесняется в
разгрузочный канал.
Осветленная жидкая
фаза поднимается в
верхнюю часть камеры и
выходит в выводной
канал.
22
23. РАЗДЕЛЕНИЕ СУСПЕНЗИЙ ФИЛЬТРОВАНИЕМ
Суспензии микробных культур могут бытьразделены и с помощью фильтрования. Этот прием
используется при стерилизации питательных сред и
может быть использован при разделении суспензии
микроорганизмов после культивирования.
Важное различие: в процессах стерилизации
концентрация клеток мала, так что большой нагрузки
на фильтрующий материал не возникает.
При разделении культуральной суспензии
концентрация клеток на много порядков выше.
Кроме того, в случае отделения клеток от
культуральной жидкости требования к содержанию
микробных клеток в фильтрате менее строги, чем при
стерилизации.
23
24. РАЗДЕЛЕНИЕ СУСПЕНЗИЙ ФИЛЬТРОВАНИЕМ
Конструкции фильтров довольно разнообразны.Существуют фильтры, работающие под вакуумом, под
давлением, существуют фильтрующие центрифуги, в
которых раствор продавливается через
цилиндрическую фильтрующую перегородку
действием центробежной силы.
Важным обстоятельством, снижающим
производительность работы фильтрующих аппаратов
является возрастание сопротивления потоку жидкости
через фильтрующую перегородку по мере накопления
слоя осадка на поверхности фильтра. Происходит
также «забивание» пор фильтрующего материала,
также приводящее к снижению скорости протока
через фильтрующую перегородку.
24
25. РАЗДЕЛЕНИЕ СУСПЕНЗИЙ ФИЛЬТРОВАНИЕМ
Поток фильтруемойсуспензии
Слой осадка; заметен
градиент плотности
По мере накопления осадка слой его
становится толще, а давление со стороны
потока уплотняет осадок. Сопротивление
потоку растет. Наблюдается явление
концентрационной поляризации
фильтра. Наиболее сильно проблемы
заметны, когда направление фильтрации
перпендикулярно плоскости фильтра.
Проблемы устраняются перемешиванием объема перед фильтрующей
перегородкой и созданием тангенциального потока суспензии по
25
отношению к фильтрующей поверхности
26. РАЗДЕЛЕНИЕ СУСПЕНЗИЙ ФИЛЬТРОВАНИЕМ
Ротационный вакуум-фильтр со шнуровым съёмом осадка.26
27. ОБЩИЕ ПРИНЦИПЫ ФРАКЦИОНИРОВАНИЯ ЭКСТРАКТОВ БИОЛОГИЧЕСКОГО СЫРЬЯ
• После отделения биомассы продуцента откультуральной жидкости начинается процесс
очистки целевого продукта, который содержится
либо в клеточной массе, либо в культуральной
жидкости.
• В обоих случаях исходной является весьма
сложная многокомпонентная смесь различных по
своей природе соединений, задача разделения
которых всегда достаточно сложна.
• Особенно сложна задача разделения белковых
компонентов, которые представляют собой
достаточно близкие по химической природе
соединения – полимеры аминокислот, так что
различия в их свойствах, на которых можно
строить стратегию фракционирования,
относительно невелики.
27
28. ОБЩИЕ ПРИНЦИПЫ ФРАКЦИОНИРОВАНИЯ ЭКСТРАКТОВ БИОЛОГИЧЕСКОГО СЫРЬЯ
• Если продукт находится в культуральнойжидкости (внеклеточный продукт), можно
сразу переходить к ее фракционированию.
• Если продукт находится в составе биомассы
(внутриклеточный продукт), необходимо
предварительно разрушить клетки
(процедура дезинтеграции), чтобы
получить некоторый раствор, из которого
далее можно выделять продукт.
28
29. ДЕЗИНТЕГРАЦИЯ
• Дезинтеграция клеточной массы, равно каки органов и тканей животных и растений
представляет собой один из важнейших
элементов биотехнологического процесса.
• Эту процедуру осуществляют либо
физическими, либо химическими, либо
ферментативными методами. Встречаются
случаи, когда используются и комбинации
этих приемов.
29
30. МЕХАНИЧЕСКАЯ ДЕЗИНТЕГРАЦИЯ
• Наиболее распространенными в промышленности являютсяфизические методы, среди которых, в свою очередь, чаще
всего применяются баллистические методы дезинтеграции
клеточной массы. Сущность этой группы методов состоит в
том, что биомассу подвергают воздействию удара или
истирания.
• В первом случае биомассу помещают в цилиндрический
барабан, вращающийся вокруг оси и наполненный
шариками из тяжелого твердого материала (металл или
фарфор). При вращении барабана шарики перекатываются
и ударяют по агломератам биомассы, причем эти удары
происходят достаточно часто и в разных направлениях. В
конце концов, это приводит к разрушению клеточных
стенок и получению сравнительно однородного вязкого
раствора, в котором находится содержимое клеток.
30
31. МЕХАНИЧЕСКАЯ ДЕЗИНТЕГРАЦИЯ
Механическая дезинтеграция:
вращающийся барабан с
рубашкой для охлаждения.
В барабан загружены шары из
твердого материала (керамики), а
затем загружается разрушаемая
биомасса.
При вращении барабана
происходит раздавливание клеток
за счет столкновения с шарами,
которые вращаются вокруг
собственных осей, падают сверху
на частицы биомассы.
При таких соударениях и трении
происходит разогрев содержимого
барабана, что приводит к
необходимости охлаждения,
чтобы избежать
термоинактивации компонентов
клеточного экстракта.
Ввод и вывод
охлаждения
Загрузка и выгрузка
биомассы
31
32. МЕХАНИЧЕСКАЯ ДЕЗИНТЕГРАЦИЯ
• Ход дезинтеграции в протоке можно описать уравнением:100
K
ln
=
100 - A f
-
где A - степень дезинтеграции, %
K - константа скорости дезинтеграции,
f - объемная скорость, л/час.
По этому уравнению можно рассчитывать:
Степень дезинтеграции при заданной скорости протока;
Скорость протока, обеспечивающую заданную степень
дезинтеграции
Величина К определяется природой разрушаемых клеток
32
33. МЕХАНИЧЕСКАЯ ДЕЗИНТЕГРАЦИЯ
Другим способом механической дезинтеграции клеток является
экструзия. Сущность этого способа заключается в том, что
суспензию клеточной массы под высоким давлением (до
100 ати)
продавливают через узкое отверстие в камеру с нормальным
давлением. При этом из-за большого перепада давления вода,
попавшая под действием высокого давления
в клетки, быстро
выходит из них и разрушает клеточную стенку. При создании
высокого давления и продавливании суспензии через узкое
отверстие происходит разогрев, так что во избежание потерь
продукта из-за термоинактивации и в этом случае необходимо
охлаждение суспензии. Степень разрушения клеток при таком
способе составляет до 90%.
В лабораторной практике применяется способ разрушения клеток,
основанный на чередовании быстрого замораживания и
оттаивания клеточной массы. При этом вода, входящая в состав
клеток, замерзает, образовавшиеся частицы льда, превосходящие
по объему воду в жидком состоянии, разрывают клеточную стенку.
Повторение таких процедур несколько раз приводит к достаточно
полному разрушению клеточных стенок.
33
34. УЛЬТРАЗВУКОВАЯ ДЕЗИНТЕГРАЦИЯ
Помимо механических способов разрушения клеток, используются
приемы, основанные на воздействии на клетки ультразвука. Под
действием
ультразвукового
поля
клетки
испытывают
попеременные сжатия и растяжения, скручивание в различных
направлениях, что, в конце концов, приводит к разрыву клеточной
стенки и разрушению клетки.
Как и в случае баллистических методов, операция дезинтеграции с
помощью ультразвука может осуществляться как в периодическом,
так и в непрерывном (проточном) режиме. Для этой цели
сконструированы специальные ячейки, позволяющие прокачивать
суспензию разрушаемой биомассы (со скоростью до нескольких
литров в минуту при концентрации клеток в суспензии до 20 %) и
поддерживать при этом температуру не свыше 2–4oС. Степень
разрушения и в этом случае оценивается по выходу белка в раствор
и составляет до 60 % за один цикл. Для более полного разрушения
биомассу можно возвращать в цикл.
34
35. УЛЬТРАЗВУКОВАЯ ДЕЗИНТЕГРАЦИЯ
Кинетика выделения белка в раствор описывается уравнением
1 - x = e -kt ,
где x – доля перешедшего в раствор белка от общего его количества в
клетках, k – константа скорости выделения белка в раствор (в пределах
20–60% не зависит от концентрации клеток в суспензии).
Для проточного аппарата такая зависимость имеет вид:
kvV 1 - x eq = x eq y,
где kv – константа скорости выделения белка для камеры объемом V; xeq
– доля перешедшего в раствор белка в равновесном состоянии; y –
скорость протока суспензии клеток через ячейку.
35
36. ХИМИЧЕСКАЯ ДЕЗИНТЕГРАЦИЯ
• Иногда более удобным оказывается разрушениеклеточной оболочки за счет перевода в раствор
отдельных ее компонентов – изменения ее состава и
структуры, что делает ее более проницаемой для
клеточного содержимого.
• Одним из таких методов является детергентный
лизис клеток. Биомасса продуцента обрабатывается
каким-либо из детергентов, который растворяет
липидные компоненты клеточной стенки, после
чего внутриклеточное содержимое через
образовавшиеся поры вытекает в окружающую
среду.
• Подобный процесс также может проводиться в
непрерывном режиме.
36
37. ХИМИЧЕСКАЯ ДЕЗИНТЕГРАЦИЯ
В аппарат 1 загружается суспензия
биомассы в растворе литического
агента. Этот аппарат является
резервуаром, из которого суспензия
попадает в теплообменник 2, где
подогревается до температуры, при
которой происходит лизис (в
аппарате 3). После пребывания в
реакторе 3 суспензия попадает в
другой теплообменник, где она
охлаждается – во избежание
длительного пребывания при
повышенной температуре, что
может привести к разрушению
целевого продукта.
Время контакта биомассы с
литическим агентом задается
скоростью прокачивания суспензии
через систему и рассчитывается,
исходя из скорости лизиса данной
биомассы данным литическим
агентом.
1
2
3
2
1- резервуар с суспензией
биомассы в растворе
литического агента
2 – теплообменники
3 – реактор для экстракции
37
38. ХИМИЧЕСКАЯ ДЕЗИНТЕГРАЦИЯ
• В качестве литических агентов используются детергенты, нопо аналогичной схеме могут использоваться и ферменты,
разрушающие клеточные стенки продуцента.
• Известны ферменты, пригодные для лизиса клеток
различных микроорганизмов. В случае бактерий часто
используют лизоцим куриных яиц, который расщепляет
гликопротеидный каркас клеточных стенок. Наиболее
приемлемо использование лизоцима для разрушения
клеточных стенок грам-положительных бактерий, однако и
грам-отрицательные бактерии в достаточной степени
восприимчивы к действию лизоцима.
• Клетки дрожжей к лизоциму устойчивы, так что приходится
применять другие ферменты. Такие ферменты найдены,
они продуцируются бактериями и могут с успехом
использоваться как наиболее щадящие литические агенты
для сохранения лабильных внутриклеточных продуктов.
38
39. ФРАКЦИОНИРОВАНИЕ КЛЕТОЧНЫХ ЭКСТРАКТОВ
+-+-
-
+-
+-
-
+
-
+
+
Наиболее сложным представляется
разделение белковых компонентов
клеточного содержимого.
+-
+
+-
-
+-
+-
+-
+-
+-
+-
+-
ФРАКЦИОНИРОВАНИЕ КЛЕТОЧНЫХ
ЭКСТРАКТОВ
-
+-
+
+-
+-
+-
+-
+-
+
+-
+-
+H N
3
-
+-
+++-
-OOC
+-
+-
+-
+-
+-
+-
+-
-
+
+-
+-
+-
+
+-
Рис. 10. Схематическое изображение молекулы белка в растворе
Видны фрагменты альфа-спиральной конформации, бета-структуры
(параллельные пустые стрелки), ионные (кружки со знаками «+» или «-») и
полярные (пустые кружки) группы боковой цепи аминокислотных остатков,
неполярные группы боковых цепей аминокислотных остатков и диполи
м о л е к у л в о д ы в о к р у ж а ю щ е м р а с т в о р е .
Причина в сложности и
полифункциональности белковых
молекул и в их гетерополимерной
природе, создающей условия для
внутримолекулярной подвижности
отдельных сегментов молекулы
друг относительно друга, что
приводит к возможности
возникновения близких по
энергии, но сильно отличающихся
по функциональным
возможностям состояний.
Схематическое изображение белковой молекулы в растворе. Видны спиральные
фрагменты, элементы β-структуры, гидрофильные и гидрофобные участки
39
молекулы, диполи воды во взаимодействии с белковой глобулой.
40. ФРАКЦИОНИРОВАНИЕ КЛЕТОЧНЫХ ЭКСТРАКТОВ
При сближении друг с другом частицы белка, окруженные гидратной«шубой» и ионной атмосферой
Плотная часть
двойного
электрического слоя
+
+
+
-
+
+
+
+
+
+
Диффузная часть
двойного
электрического
слоя
-
-
-
+
-
+
-
+
-
+
+
ξЭлектрокинетический
потенциал
-
Белковая глобула в растворе
представляет собой аналог
коллоидной мицеллы. На
поверхности глобулы формируется
двойной электрический слой, со
стороны раствора возникают
плотная и диффузная части
двойного слоя. Потенциал,
приходящийся на диффузную
часть, называется
электрокинетическим
потенциалом. Диффузная часть
образует ионную атмосферу.
40
41. ФРАКЦИОНИРОВАНИЕ КЛЕТОЧНЫХ ЭКСТРАКТОВ
Задача разработки процедуры очистки белка из столь сложной смесисостоит в использовании малых различий в свойствах белков для их
разделения.
Ионная атмосфера и гидратная оболочка
формируют энергетический барьер,
препятствующий слипанию белковых
глобул при их сближении.
U
φ - потенциал
кинетического
барьера
Ионная атмосфера вызывает взаимное
электростатическое отталкивание
частиц при их сближении.
r
Гидратная оболочка препятствует
взаимодействию поверхностей белковых
глобул за счет насыщения энергии
полярных и ионных группировок
взаимодействием с дипольными
молекулами воды.
41
42. ФРАКЦИОНИРОВАНИЕ КЛЕТОЧНЫХ ЭКСТРАКТОВ
• Распределение зарядов и полярных группна поверхности разных белков
существенно различается.
• Доля заряженных группировок зависит от
рН среды.
• Радиус ионной атмосферы зависит от
ионной силы раствора.
• Прочность гидратной оболочки зависит от
диэлектрической постоянной раствора.
42
43. ФРАКЦИОНИРОВАНИЕ КЛЕТОЧНЫХ ЭКСТРАКТОВ
• Все эти параметры влияют на величину энергетическогобарьера слипания, для разных белков условия преодоления
барьера наступают при разных обстоятельствах, что и позволяет
фракционировать белковые смеси.
• Белки различаются по величине изоэлектрической точки –
значении рН, при котором суммарный заряд белковой глобулы
равен 0. При этом барьер слипания преодолевается довольно
легко, частицы начинают агрегировать, белок выпадает в
осадок.
• При повышении ионной силы раствора двойной слой
сжимается, электрокинетический потенциал понижается. Это
также приводит к снижению барьера слипания и к агрегации
белковых частиц с образованием осадка.
• При добавлении в среду органических растворителей
понижается диэлектрическая постоянная, что также
способствует снижению барьера и агрегации белковых частиц.
43
44. ФРАКЦИОНИРОВАНИЕ КЛЕТОЧНЫХ ЭКСТРАКТОВ
• На этих принципах основано фракционирование белковыхсмесей ступенчатым солевым осаждением. В качестве осадителя
чаще всего используют сульфат аммония, который не вызывает
денатурацию белков и способствует длительному сохранению
их активности в осадке.
• При разработке технологии фракционирования белковых
экстрактов осаждением сульфатом аммония к раствору
добавляют твердую соль порциями, медленно, с осторожным
перемешиванием при пониженной температуре.
Концентрацию сульфата аммония выражают в долях от
концентрации насыщенного раствора (степень насыщения).
Первую порцию добавляют до момента помутнения раствора,
оставляют до созревания осадка при пониженной температуре
(на несколько часов), осадок отделяют центрифугированием,
затем добавляют новую порцию соли до момента помутнения,
далее проводятся те же операции, пока не будет достигнута
насыщающая концентрация раствора сульфата аммония.
• Получают серию осадков, в которых определяют концентрацию
(активность) целевого продукта.
44
45. ФРАКЦИОНИРОВАНИЕ КЛЕТОЧНЫХ ЭКСТРАКТОВ
• Аналогичным образом проводится разработка технологиифракционирования белковых смесей селективным осаждением
органическими растворителями. В качестве осадителей
используют этанол, ацетон, изопропанол и др. растворители.
• К сильно охлажденному раствору добавляют растворитель
порциями, медленно, с осторожным перемешиванием при
пониженной температуре. Первую порцию добавляют до
момента помутнения раствора, оставляют до созревания осадка
при пониженной температуре (на несколько часов), осадок
отделяют центрифугированием, затем добавляют новую
порцию растворителя до момента помутнения, далее
проводятся те же операции, пока не будет достигнута
концентрация раствора, при которой осаждаются все
содержащиеся в смеси белки.
• Поскольку органические растворители вызывают денатурацию
белков, перед добавлением новой порции растворителя смесь
охлаждают до возможно более низкой вплоть до отрицательных
значений температуры, что возможно из-за понижения
температуры замерзания раствора за счет добавок
органического растворителя.
• Помимо органических растворителей в качестве осадителей
могут использоваться водорастворимые полимеры.
45
46. ФРАКЦИОНИРОВАНИЕ КЛЕТОЧНЫХ ЭКСТРАКТОВ
lgM6.0
5.0
4.0
Фосфорилаза
Пируваткиназа
Альдолаза
Лактатдегидрогеназа
Энолаза
Креатинкиназа
Фосфоглицераткиназа
Миокиназа
Миоглобин
Парвальбумин
Приблизительные области
осаждения некоторых белков из
20
40
60
80
Концентрация ацетона, % (v / v) экстрактов мышц различными
концентрациями ацетона при 5° С, рН
6,5, I = 0,1
46
47. АФФИННОЕ ОСАЖДЕНИЕ
• Для повышения эффективности осаждения могутприменяться аффинные методы. В случае, например,
ферментов, связывающихся с нуклеиновыми кислотами
(ДНК-полимераза 1, РНК-полимераза из E. сoli) при
осаждении НК катионными агентами происходит
соосаждение ферментов. В других ситуациях аффинные
процедуры можно конструировать на основе информации о
свойствах фермента.
• При очистке ферментов, способных связываться с
полисахаридами, предложено использовать в качестве
осадителя альгиновую кислоту. Фермент связывается с этим
осадителем, а затем в раствор добавляют соль кальция, с
которым альгиновая кислота образует гель, выпадающий в
осадок вместе со связавшимся с ним ферментом.
• После отделения от раствора к осадку добавляют ЭДТА,
которая связывает ионы Са, гель растворяется и фермент
освобождается из комплекса.
47
48. АФФИННОЕ ОСАЖДЕНИЕ
Аффинное осаждение амилазы изпроростков пшеницы:
Дорожка 1 – сырой препарат (экстракт
проростков)
Дорожка 2 – очищенный препарат
Количество белка на геле одинаковое;
Элюция мальтозой.
COOH
COOH
O
O
O
OH
OH
O
OH
OH
Альгиновая
(поли-D-манO
нуроновая)
n кислота
M. Sardar & M. N. Gupta. Alginate beads as an
affinity material for alpha amylases//
Bioseparation 7: 159–165, 1998.
48
49. РАСПРЕДЕЛИТЕЛЬНЫЕ МЕТОДЫ
• Одним из такого рода приемов является распределениевещества между двумя несмешивающимися жидкими
фазами, использующееся в технологии так называемого
противоточного
распределения,
в
ходе
которого
осуществляется
последовательное
многократное
распределение вещества между двумя жидкими фазами.
c1
α - коэффициент распределения
c2
Состав фаз подбирается таким образом, чтобы
коэффициенты распределения компонентов смеси были
удобными для разделения
49
50. РАСПРЕДЕЛИТЕЛЬНЫЕ МЕТОДЫ
Устройство для противоточногораспределения состоит из множества
ячеек (1,2,3 на схеме), в которые залита
«тяжелая» неподвижная фаза.
Перенос подвижной фазы
В ячейку 1 заливают «легкую»
подвижную фазу, вводят разделяемую
смесь, встряхивают полученную
систему, дают расслоиться.
Осуществлено первое распределение –
компонентов смеси между фазами в
соответствии с коэффициентами
распределения.
1
2
3
Затем подвижная фаза переносится из
ячейки 1 в ячейку 2 – первый перенос.
Далее операции распределения
повторяются, производится перенос в
ячейку 3 и процесс продолжается.
50
51. РАСПРЕДЕЛИТЕЛЬНЫЕ МЕТОДЫ
• Послераспределения
вещества
между
фазами
концентрация нашего вещества в верхней фазе будет
равна c1, в нижней фазе – c2.
• Пусть концентрация вносимого с подвижной фазой
вещества равна c0, объем подвижной фазы – V. Тогда
количество растворенного вещества равно c0V. Будем
считать, что объемы жидких фаз в ячейках равны. Тогда
после установления равновесного распределения будет
соблюдаться следующее условие материального баланса:
c1V + c 2V = c0V
c 1 + c 2 = c0 .
Концентрации компонента в каждой фазе:
α
1
c1 =
c0 , c2 =
c0 .
1+ α
1+ α
51
52. РАСПРЕДЕЛИТЕЛЬНЫЕ МЕТОДЫ
• После первого переноса общее количествовещества в ячейках 1 и 2 будет равно
соответственно:
1
α
c0 и
с0 .
1+α
1+α
Аналогичным образом можно описать и последующие переносы
и распределения. Однако из уже приведенных данных можно
видеть, что количество вещества в ячейках распределяется по
биномиальному закону
n
α
1
+
c0
1+ α 1+ α
52
53. РАСПРЕДЕЛИТЕЛЬНЫЕ МЕТОДЫ
Номер ячейки1
2
Подвижная фаза
α
с
2 0
(1 + α )
α2
с
2 0
( 1 + α)
Неподвижная фаза
1
с
2 0
(1 + α )
α
с
2 0
(1 + α )
1
с0
(1 + α )
α
с0
(1 + α )
Общее количество
вещества в ячейке
53
54. РАСПРЕДЕЛИТЕЛЬНЫЕ МЕТОДЫ
• При этом количество вещества Q после n переносов в k-йячейке
определяется
по
формуле
общего
члена
биномиального распределения:
n!
1
Qn,k =
n
k
!k!
1
+
α
n-k+1
α
1
+
α
k -1
c0 .
В зависимости от величин a и n при некотором k будет
наблюдаться максимальное значение Q. Очевидно, что разные
компоненты разделяемой смеси имеют различные значения a и,
следовательно, максимальное значение Q будет для разных
компонентов смеси достигаться при разных k.
Таким образом и достигается разделение компонентов смеси.
54
55. РАСПРЕДЕЛЕНИЕ В СИСТЕМАХ С НЕСМЕШИВАЮЩИМИСЯ ВОДНЫМИ РАСТВОРАМИ ПОЛИМЕРОВ
• Растворы полимеров, каждый из которыххорошо растворим в воде, при смешении
часто образуют две фазы.
• Впервые такое явление наблюдал Байеринк
в 1896 г.: смесь желатина, агара и воды в
определенном диапазоне концентраций
разделяется на две фазы, причем верхняя
фаза богата желатином, нижняя – агаром.
• Альбертсон показал, что такие системы
могут быть эффективно использованы для
фракционирования белковых смесей.
55
56. СИСТЕМЫ С НЕСМЕШИВАЮЩИМИСЯ ВОДНЫМИ РАСТВОРАМИ ПОЛИМЕРОВ
Полимер QСИСТЕМЫ С НЕСМЕШИВАЮЩИМИСЯ
ВОДНЫМИ РАСТВОРАМИ ПОЛИМЕРОВ
B
A
C
D
Полимер P
В и С – узловые точки
• Описанная система может
быть представлена на
фазовой диаграмме.
Кривая – бинодаль.
• Выше кривой система
двухфазна, ниже кривой –
однофазна.
• Прямая, соединяющая
точки A,B и C, строится по
экспериментальным
данным. Точка В
соответствует составу
нижней фазы, точка С –
составу верхней фазы.
• Соотношение отрезков АВ
и ВС отражает
соотношение объёмов фаз.
56
57. СИСТЕМЫ С НЕСМЕШИВАЮЩИМИСЯ ВОДНЫМИ РАСТВОРАМИ ПОЛИМЕРОВ
Полимер QСИСТЕМЫ С НЕСМЕШИВАЮЩИМИСЯ
ВОДНЫМИ РАСТВОРАМИ ПОЛИМЕРОВ
B
A
C
D
Полимер P
Такая система подвержена
влиянию многих факторов.
Их вклад в процессы в системе
можно отразить в уравнении:
• ln α = ln α0 + ln αel +ln αhfob +
ln αbiosp + lnαsize + lnαconf
• Индексы обозначают вклад
электростатических,
гидрофобных,
биоспецифических
взаимодействий,
молекулярного размера и
конформационных свойств
в величину коэфициента
распределения.
• Точно описать
термодинамику такой
системы невозможно.
57
58.
ВОДНЫЕ ДВУХФАЗНЫЕ СИСТЕМЫНеионный полимер
Неионный полимер
Полипропиленгликоль
Полиэтиленгликоль
Поливиниловый спирт
Оксипропилдекстран
Декстран
Полиэтиленгликоль
Поливиниловый спирт
Поливинилпирролидон
Декстран
Фиколл
58
59.
ВОДНЫЕДВУХФАЗНЫЕ СИСТЕМЫ
ВОДНЫЕ
ДВУХФАЗНЫЕ
СИСТЕМЫ
Неионный полимер
Неионный полимер
Поливиниловый спирт Метилцеллюлоза
Декстран
Поливинилпирролидон Метилцеллюлоза
Декстран
Метилцеллюлоза
Полимер
Декстран
Низкомолекулярный компонент
Полипропиленгликоль Фосфат калия
Глицерин
59
60.
ВОДНЫЕДВУХФАЗНЫЕ СИСТЕМЫ
ВОДНЫЕ
ДВУХФАЗНЫЕ
СИСТЕМЫ
Полимер
Низкомолекулярный
компонент
Полиэтиленгликоль Неорганические соли
Декстран
Глюкоза, мальтоза и
т.п.
Бутилцеллозольв
Пропанол,
изопропанол
60
61.
ВОДНЫЕ ДВУХФАЗНЫЕ СИСТЕМЫПолиэлектролит
Неионный полимер
ДЭАЭ-декстран, HCl
Поливиниловый спирт
Метилцеллюлоза
Na-декстран
cульфат
Полипропиленгликоль
Полиэтиленгликоль,
NaCl
Декстран, NaCl
61
62.
ВОДНЫЕ ДВУХФАЗНЫЕСИСТЕМЫ
Полиэлектролит
Полиэлектролит
Na-декстран
cульфат
Na – карбоксиметилдекстран
Карбоксиметилцеллюлоза
62
63.
ВОДНЫЕ ДВУХФАЗНЫЕ СИСТЕМЫКоэффициенты распределения белков в системах Декстран 500/ПЭГ
Белок
Цитохром С
Овальбумин
БСА
ЛДГ
Каталаза
Мол. вес
белка
Декстран 500 (9%)- ПЭГ:
мол вес ПЭГ
4000 6000 20000 40000
12384 0,17 0,17 0,13
0,12
45000 1,25 0,85 0,50
0,50
69000 0,52 0,34 0,14
0,11
140000 0,13 0,08 0,05
0,10
250000 0,82 0,38 0,16
0,10
Зависимости от мол. веса ПЭГ и от размеров белков не прослеживается
63
64.
ВОДНЫЕ ДВУХФАЗНЫЕ СИСТЕМЫТехнологическое оборудование для двухфазного распределения
Схематическое представление дискового
тарельчатого контактора.
Непрерывная выгрузка
внутриклеточных продуктов с
центрифугальной экстракцией в системе
ПЭГ/соль
Схема колонного экстрактора с
перфорированными тарелками
Описаны и другие устройства подобного
типа.
Teresa Cunha and Raquel Aires-Barros. LargeScale Extraction of Proteins//MOLECULAR
BIOTECHNOLOGY Volume 20, 2002, Р. 29-4064
65. АФФИННЫЕ МЕТОДЫ В ДВУФАЗНОМ РАСПРЕДЕЛЕНИИ
• Специфичность очистки белковраспределением в двухфазных системах
удается повысить применением аффинных
принципов.
• Один из полимеров подвергается
модификации путем присоединения к нему
аффинного лиганда, специфичного к
определенному белку или классу белков.
При этом может происходить даже
обращение коэффициента распределения.
65
66. АФФИННЫЕ МЕТОДЫ В ДВУФАЗНОМ РАСПРЕДЕЛЕНИИ
При конструировании продуцентов
белков методами генной
инженерии возможно создание
конструкций, специально
предусмотренных для эффективной
очистки продуктов путем
использования аффинных
подходов. При конструировании
суперпродуцента белка А
Staphylococcus aureus, широко
используемого в
иммуноферментном анализе, к
последовательности гена были
присоединены фрагменты,
кодирующие пептиды,
обогащенные остатками
триптофана. Это обеспечивало
преимущественное
концентрирование
рекомбинантного белка в одной из
фаз.
Kristina Berggren, Folke Tjerneld,
Andres Veide. Peptide fusion tags
with tryptophan and charged
residues for control of protein
partitioning in PEG–potassium
phosphate aqueous two-phase
systems//Bioseparation 9: 69–80,
2000.
66
67. ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ
• При конструировании процессов очисткипродуктов биотехнологического процесса
как правило приходится использовать
несколько последовательных процедур
фракционирования, основанных на
различных принципах.
• Широкое применение нашли методы
хроматографического фракционирования
сложных смесей.
67
68. ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ
• Слово “хроматография” состоит издвух греческих корней: хромос
(цвет) и графо (пишу). Перевод его
может звучать как “цветопись”.
Изобрел этот метод русский
ботаник Михаил Семёнович Цвет
при попытках разделения
растительных пигментов, в
частности, хлорофиллов. В качестве
сорбента он использовал окись
алюминия, в процессе разделения
на колонке формировались
окрашенные зоны, что и
послужило основанием для
введения термина.
Михаил Семёнович Цвет
(1872—1919)
68
69. ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ
• В настоящее время используются различные видыхроматографического разделения, основанные на
различных типах взаимодействия компонентов
разделяемой смеси и сорбента:
• Распределительная хроматография;
• Хроматография в обращенных фазах;
• Ионообменная хроматография;
• Адсорбционная хроматография;
• Хроматография на молекулярных ситах (гельпроникающая хроматография).
69
70. ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ
• Ионообменная хроматография является одним из наиболеераспространенных типов хроматографического разделения.
• Сорбент - твердый носитель, содержащий ионизируемые в
водных растворах функциональные группы, с которыми
связываются с тем или иным сродством компоненты
разделяемой смеси.
• Распределительная хроматография – сорбент представляет
собой нейтральный твердый носитель, на котором
сорбирована неподвижная фаза. Подвижной фазой в данном
случае является растворитель, процесс основан на
распределении компонентов смеси между подвижной и
неподвижной жидкими фазами, разделение достигается за
счет различия в коэффициентах распределения
компонентов разделяемой смеси между подвижной и
неподвижной фазами. Обычно неподвижная фаза более
полярна. Если неподвижная фаза более гидрофобна –
хроматография в обращенных фазах (RPC – Reversed Phase
Chromatography).
70
71. ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ
Адсорбционная хроматография - сорбент представляет собой
твердый носитель, на котором происходит обратимая сорбция
компонентов разделяемой смеси за счет дисперсионного
взаимодействия их с поверхностными структурами твердой фазы;
разделение достигается за счет различия в константах равновесия
связывания компонентов смеси с поверхностью сорбента;
Хроматография на молекулярных ситах (гель-проникающая
хроматография, гель-фильтрация); сорбент представляет собой
гранулы геля, имеющие поры, в которые могут проникать
молекулы компонентов с размером ниже некоторой величины и не
могут проникать молекулы большего размера. При этом в колонке
объем растворителя, доступный для молекул разного размера,
оказывается различным: относительно малые молекулы
диффундируют как в межгранульном, так и во внутригранульном
объеме, крупные молекулы могут диффундировать лишь в
межгранульном пространстве. Разделение достигается за счет
разной скорости перемещения частиц с разными размерами
молекул по колонке, при этом частицы большего размера движутся
с большей скоростью;
71
72. ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ
• Аффинная хроматография. Сорбент представляетсобой твердый носитель, к которому химически
присоединены специальные группировки лиганды, избирательно связывающие какой-либо
из компонентов разделяемой смеси; остальные
компоненты раствора не взаимодействуют с
носителем и выходят в свободном объеме
колонки).
• Существуют приемы хроматографии, основанные
и на других принципах, так что арсенал
хроматографических методов достаточно
разнообразен.
72
73. ИОНООБМЕННАЯ ХРОМАТОГРАФИЯ
• В ионообменной хроматографии наиболее частоиспользуются следующие типы носителей:
– гранулированные сополимеры стирола и
дивинилбензола. В качестве ионообменных групп в
такие полимеры вводят либо аминогруппы с
последующим превращением их в четвертичные
аммониевые группировки (для получения сильных
анионитов), либо сульфогруппы (для получения
сильных катионитов); используются также
сополимеры акриловой кислоты и дивинилбензола,
являющиеся слабыми катионитами.
– гранулированные полисахариды: целлюлоза,
поперечно-сшитые производные декстрана, агарозы,
модифицированные химически с введением
ионогенных группировок кислотного или основного
характера.
73
74. ИОНООБМЕННАЯ ХРОМАТОГРАФИЯ
• Для синтетических полимерных сорбентовхарактерны высокая ионообменная емкость при
существенной гидрофобности матриц, высокая
жесткость и малый размер пор в гранулах.
Преимущественно используются для разделения
низкомолекулярных компонентов (аминокислоты,
нуклеотиды, антибиотики и т. п.).
• Биополимеры (белки, нуклеиновые кислоты,
полисахариды) на таких ионообменниках
фракционировать неудобно из-за высокой
неспецифической и практически необратимой
сорбции и малой емкости этих носителей для
высокополимерных соединений.
74
75. ИОНООБМЕННАЯ ХРОМАТОГРАФИЯ
• Фракционирование белков предпочтительноосуществлять на полисахаридных сорбентах,
которые содержат многочисленные
гидроксильные группы и, таким образом,
имитируют водное окружение – наиболее
благоприятное для белковых веществ. Такое
окружение минимизирует денатурирующее
воздействие со стороны окружающей среды.
• Выбор сорбента для хроматографической
очистки существенно облегчается, если имеется
предварительная информация о свойствах
целевого продукта.
75
76. ИОНООБМЕННАЯ ХРОМАТОГРАФИЯ
ФОРМУЛАНАЗВАНИЕ
ОБОЗНАЧЕНИЕ
СИЛЬНЫЕ КАТИОНИТЫ
-SO3-
Сульфо-
S-
-CH2SO3-
Сульфометил-
SM-
-C2H4SO3-
Сульфоэтил-
SE-
-C3H6SO3 -
Сульфопропил-
SP-
-PO32-
Фосфо-
Р-
СЛАБЫЕ КАТИОНИТЫ
-СОО-
Карбокси-
С-
-СН2СОО-
Карбоксиметил-
СМ76
77. ИОНООБМЕННАЯ ХРОМАТОГРАФИЯ
ФОРМУЛАНАЗВАНИЕ
ОБОЗНАЧЕНИЕ
СИЛЬНЫЕ АНИОНИТЫ
-CH2 N+(CH3)3
Триметиламинометил-
ТАМ-
-C2H4 N+(C2H5)3
Триэтиламиноэтил-
ТЕАЕ-
-C2H4N+(C2H5 )2
СH2СH(OH)CH3
Диэтил-2-оксипропиламиноэтил-
QAE-
СЛАБЫЕ АНИОНИТЫ
-С2H4NH3+
Аминоэтил-
АЕ-
-С2Н4N+H(C2H5)2
Диэтиламиноэтил-
DEAE-
-(C2H4 N
СH2)nC2H4N+H2
Полиэтиленимин-
PEI-
-CH2-C6H4 -N+H3
Парааминобензил-
PAB77
78. ГЕЛЬ-ФИЛЬТРАЦИЯ
• Гель-фильтрация используется прифракционировании компонентов
клеточных экстрактов достаточно широко,
и во многих случаях коэффициент
специфичности этой процедуры высок.
Однако, для направленного применения
гель-фильтрации в биотехнологии опятьтаки необходимо располагать
дополнительной информацией - на этот
раз о размерах частиц целевого продукта
78
79. АФФИННАЯ ХРОМАТОГРАФИЯ
• Аффинная хроматография характеризуется наиболеевысокими коэффициентами специфичности.
Используемые сорбенты относятся к двум большим
группам. Сорбенты первой группы в качестве аффинных
лигандов включают присоединенные к нерастворимому
носителю субстраты или ингибиторы ферментов. Сюда же
можно отнести и иммуносорбенты, представляющие собой
иммобилизованные антитела к целевому продукту или его
фрагментам. Принципы конструирования таких сорбентов
достаточно просты и понятны. Следует отметить, что
сорбенты эти обладают относительно узкой
специфичностью и, следовательно, для каждого продукта
необходимо конструировать свой сорбент. Это может
приводить к удорожанию как технологического процесса,
так и продукта.
79
80. АФФИННАЯ ХРОМАТОГРАФИЯ
• Ко второй группе аффинных сорбентов относятсяматериалы, содержащие в качестве лигандов далекие
по строению от субстратов и кофакторов ферментов и
вообще от природных лигандов белков группировки,
с которыми, тем не менее, эти белки связываются
достаточно прочно и селективно. Соответствующие
соединения зачастую оказываются сильными
ингибиторами ферментов. Среди таких сорбентов в
течение последнего десятилетия получили
распространение иммобилизованные (обычно на
полисахаридных матрицах) красители. Известны
примеры, когда за одну стадию сорбции и элюции
достигается очистка почти в 1 500 раз практически без
потерь активности.
80
81. АФФИННАЯ ХРОМАТОГРАФИЯ
OSO3Na
NH2
SO3Na
NH
O
HN
N
N
NH
SO3Na
N
O
(полимер)
Цибакрон F3GA - широко используемый аффинный лиганд,
хромофор "голубого декстрана"
Ферменты, связывающиеся с нуклеотидами, имеют
повышенное сродство к триазиновым красителям, которые и
используются в качестве аффинных лигандов.
81
82. АФФИННАЯ ХРОМАТОГРАФИЯ
• В качестве матриц для синтеза аффинных сорбентовиспользуются нейтральные полимеры, чаще всего
полисахариды.
• Некоторые требования к матрицам сформулированы
Поратом:
- нерастворимость в воде;
- достаточная проницаемость и большая удельная
поверхность;
- высокая жесткость и подходящая форма частиц;
- нулевая (или минимальная) сорбционная ёмкость;
- химическая стабильность в условиях присоединения
лиганда, осуществления хроматографии и регенерации;
- устойчивость к микробной и ферментативной
деградации;
- гидрофильность.
82
83. АФФИННАЯ ХРОМАТОГРАФИЯ
CH2OHOH
O
O
OH
OH
O
O
CH2OH
Б)
OH
n
А)
Основные типы полисахаридных
носителей для синтеза аффинных
сорбентов:
А) декстран; Б) целлюлоза; В) агароза
В)
Те же носители могут использоваться
для синтеза ионообменников,
молекулярных сит и других
сорбентов
83
84. АФФИННАЯ ХРОМАТОГРАФИЯ
• Использование технологий конструированиярекомбинантных белков позволило встраивать в их
структуру элементы, облегчающие их последующую
эффективную очистку.
• К таким элементам относятся специальные
аминокислотные последовательности (“тэги”- tags) на
концах полипептидной цепи белка, повышающие сродство
к определенным лигандам, присоединенным к матрицам –
аффинным сорбентам.
• Одним из наиболее распространенных фрагментов
являются последовательности, богатые остатками
гистидина. Эта аминокислота за счет имидазольного цикла
хорошо и достаточно прочно связывается с сорбентами,
содержащими ионы Ni2+ или Co2+.
84
85. АФФИННАЯ ХРОМАТОГРАФИЯ
• Целевой продукт с высокойспецифичностью извлекается таким
сорбентом из клеточного экстракта,
выделяется в чистом виде. “Зацепка”
может не сказываться на функции белка.
В некоторых случаях она оказывается
нежелательной, и тогда ее можно удалять
с помощью специальной ферментной
системы, в частности, разработанной
компанией “Novozym”.
85
86. АФФИННАЯ ХРОМАТОГРАФИЯ
QQ
H
-K
M
H
Q
H
Q
Q
H
H
Q
-K
Q
Q
H
M
H
H
В качестве “зацепки” используется
а
богатый гистидином пептид
MKHQHQHQHQ,
присоединяемый к N-концу
NH Целевой белок
целевого белка. После
выделения целевого белка
а) “зацепка” удаляется обработкой
дипептидиламинопептидазой.
дипептидиламинопептидаза
NH2 Целевой белок
Если последовательность целевого
б
белка оказывается
неустойчивой к действию этого
Q NH- Целевой белок
фермента, “зацепка”
Стадия 1
циклаза
б) дополняется еще одним
остатком Q, который далее
дипептидиламинопептидаза
превращается в пироглутаматпиро-Q NH- Целевой белок
ный остаток (с помощью
пироглутамиламинопептидаза
глутаминциклазы), а затем
Стадия 2
удаляется пироглутамиламинопептидазой; в итоге
NH2 Целевой белок
получается нативный целевой
белок.
Pedersen J., Lauritzen C., Madsen M.T., Dahl S.W. Protein
Expression and Purification 1999. Vol. 15. P. 389–400.
86
87. АФФИННАЯ ХРОМАТОГРАФИЯ
Помимо гистидиновых тэгов используются и другие пептидные фрагменты:«Якорная группа»
Размер
(а. к.)
Последовательность
Размер (kDa)
Поли-Arg
5–6
(обычно 5)
RRRRR
0.80
Поли-His
2–10
(обычно 6)
HHHHHH
0.84
FLAG
8
DYKDDDDK
1.01
Strep-tag II
8
WSHPQFEK
1.06
c-myc
11
EQKLISEEDL
1.20
S-пептид РНКазы
А
15
KETAAAKFERQHMDS
1.75
HAT
19
KDHLIHNVHKEFHAHAHNK
2.31
3x FLAG
22
DYKDHDGDYKDHDIDYKDDDDK
2.73
87
88. АФФИННАЯ ХРОМАТОГРАФИЯ
«Якорная группа»Размер
(а. к.)
Калмодулинсвязывающий
пептид
26
Целлюлозосвязывающие
домены
27–189
Последовательность
KRRWKKNFIAVSAANRFKKISSSGAL
Домены
Размер
(kDa)
2.96
3.00-20.00
SBP
38
MDEKTTGWRGGHVVEGLAGELEQLRARLE
HHPQGQREP
4.03
Хитинсвязывающий домен
51
TNPGVSAWQVNTAYTAGQLVTYNGKTYKCL
QPHTSLAGWEPSNVPALWQLQ
5.59
88
89.
МАТРИЦЫ И УСЛОВИЯ ЭЛЮЦИИ ДЛЯ РАЗЛИЧНЫХАФФИННЫХ ФРАГМЕНТОВ
АФФИННЫЙ
ФРАГМЕНТ
МАТРИЦА
УСЛОВИЯ ЭЛЮЦИИ
Poly-Arg
Катионообменная
смола
Линейный градиент NaCl (0
to 400 mM), pH>8.0
Poly-His Ni2+ -NTA
Co2+-CMA (Talon)
Имидазол 20-250 mM или
низкий pH
FLAG
анти-FLAG
моноклональные АТ
pH 3.0 or 2-5 mM EDTA
Strep-tag (AWRHPQFGG)
Strep-Tactin
(модифицированный
стрептавидин)
2.5 mM дестиобиотин
c-myc (EQKLLSEEDLN)
МАТ
низкий pH
S
S-фрагмент РНКазы
А
3 M гуанидинизотиоцианат,
0.2 M цитрат, pH 2, 3 M
MgCl2
HAT (природный
гистидиновый фрагмент)
Co2+ -CMA (Talon)
150 mM имидазол или
низкий pH
89
90. МАТРИЦЫ И УСЛОВИЯ ЭЛЮЦИИ ДЛЯ РАЗЛИЧНЫХ АФФИННЫХ ФРАГМЕНТОВ
Аффинный фрагментМатрица
Условия элюции
Калмодулинсвязывающий пептид
Калмодулин
EGTA или EGTA с 1 M NaCl
Целлюлозосвязывающий домен
Целлюлоза
Семейство I: гуанидин HCl
или мочевина >4 M; Семейства
II/III: этиленгликоль
SBP
Стрептавидин
2 mM биотин
Хитинсвязывающий
домен
Хитин
Фьюз с интеином: 30-50 mM
дитиотреит, β-меркаптоэтанол или цистеин
Глутатион Sтрансфераза
Глутатион
5-10 mM восстановленный
глутатион
Мальтозосвязывающий белок
Поперечно
сшитая
амилоза
10 mM мальтоза
90
91. ИНТЕИНОВЫЕ КОНСТРУКЦИИ
В 1990 г. в группе Анраку при исследовании структуры гена αсубъединицы мембранной АТФазы пекарских дрожжей былообнаружено, что N- и C-концевые участки гена гомологичны
известным генам других организмов, в то время как центральная
часть гена такой гомологии не проявляет. Этот фрагмент гена АТФазы весьма близок по первичной структуре гену НО дрожжей,
кодирующему эндонуклеазу. Ген не содержал интронов. Авторы
предложили гипотезу о новом типе посттрансляционного
процессинга белков, в ходе которого происходит белковый сплайсинг:
внутренние фрагменты продукта трансляции, названные
впоследствии «интеинами», выщепляют себя из полипептидной цепи
с одновременным соединением концевых фрагментов «экстеинов» и
образованием конечного белкового продукта.
R. Hirata, Y. Ohsumi, A. Nakano, H. Kawasaki, K. Suzuki, Y. Anraku.
Molecular structure of a gene, VMA1, encoding the catalytic subunit of H+translocating adenosine triphosphatase from vacuolar membranes of
Saccharomyces cerevisiae//J. Biol. Chem. Vol. 265, No. 12, pp. 6726-6733,1990
91
92. ИНТЕИНОВЫЕ КОНСТРУКЦИИ
Схема образованияфункционально
активного белка в
процессе белкового
сплайсинга
A
Домен сплайсинга
B
G
интеин
Домен сплайсинга
Nэкстеин
Сэкстеин
Блок-схема интеиновой
структуры.
92
93. ИНТЕИНОВЫЕ КОНСТРУКЦИИ
AДомен сплайсинга
Nэкстеин
B
интеин
G
Домен сплайсинга
Сэкстеин
Некоторые аминокислоты в домене сплайсинга
высококонсервативны. Первая аминокислота N-концевого
интеина (А) и С-концевого экстеина – серин, цистеин или
треонин, хотя встречаются и остатки аланина в N-позиции сайта
сплайсинга. Аминокислота на С-конце интеина (блок G) – чаще
всего аспарагин, предшествует ему гистидин. И, наконец, в блоке
N-концевой части интеина обычно присутствует
последовательность Thr-x-x-His. Эти аминокислоты играют
специфическую роль в структуре интеина и механизме
белкового сплайсинга.
93
94. ИНТЕИНОВЫЕ КОНСТРУКЦИИ
Четыре независимых стадии внутримолекулярныхреакции. Первые три катализирует сам интеин по
единственному сайту. Финальная стадия –
спонтанная перегруппировка с образованием
нормальной пептидной связи.
1. N-X-ацильная миграция: нуклеофильная атака
первого остатка интеина, консервативной
аминокислоты cys/ser, на соседний карбонильный
углерод экстеина
2. Переэтерификация: консервативный остаток
cys/ser/thr на N-конце С-экстеина в продукте 1
атакует вновь образованную сложноэфирную
группу в сайте сплайсинга
3. Циклизация аспарагина. Амидная группировка
боковой цепи аспарагина на С-конце узла
сплайсинга атакует собственный карбонильный
углерод .Остаток аспарагина циклизуется с
образованием С-концевого аминосукцинимида
4. Миграция ацильного остатка от кислорода к азоту
с образованием нормальной амидной
(пептидной) связи
5. Экстеин в виде функционально активного белка
94
95. АППАРАТУРНОЕ ОФОРМЛЕНИЕ ХРОМАТОГРАФИЧЕСКИХ ПРОЦЕССОВ
• Несмотря на большое разнообразиехроматографических методов по принципам
разделения большинство процессов удается
организовать в сходной аппаратуре.
• Основными элементами аппаратурного
оформления хроматографического процесса
являются:
Хроматографическая колонна;
Резервуар с элюентом;
Насос для подачи элюента;
Детектирующее устройство для регистрации выхода с
колонки компонентов разделяемой смеси;
Коллектор фракций.
95
96. АППАРАТУРНОЕ ОФОРМЛЕНИЕ ХРОМАТОГРАФИЧЕСКИХ ПРОЦЕССОВ
• Несмотря на большое разнообразиехроматографических методов по принципам
разделения большинство процессов удается
организовать в сходной аппаратуре.
• Основными элементами аппаратурного
оформления хроматографического процесса
являются:
Хроматографическая колонна;
Резервуар с элюентом;
Насос для подачи элюента;
Детектирующее устройство для регистрации выхода с
колонки компонентов разделяемой смеси;
Коллектор фракций.
96
97. АППАРАТУРНОЕ ОФОРМЛЕНИЕ ХРОМАТОГРАФИЧЕСКИХ ПРОЦЕССОВ
Схема установки выглядит
следующим образом:
Процесс разделения происходит
на колонке с сорбентом 1, куда
сверху наносится разделяемая
смесь;
Для поддержания оптимальной
для разделения температуры
колонка снабжена рубашкой 4;
Раствор элюента подается из
сосуда 5 (смеситель), а в сосуде 6
(резервуар) также содержится
элюент в концентрации, которая
должна обеспечивать полное
вытеснение с колонки всех
компонентов смеси. За счет
последовательного соединения
смесителя и резервуара в
смесителе концентрация элюента
постепенно меняется, так что
компоненты смеси вытесняются с
колонки постепенно – в
зависимости от прочности их
связывания с сорбентом.
2
5
6
1
4
3
Система градиентной
элюции
Аппаратурная схема установки
для хроматографии:
1 – слой сорбента; 2,3 – устройства
ввода элюента и вывода элюата
соответственно; 4 – рубашка для
термостатирования колонки;
5 – смеситель; 6 – резервуар.
97
98. АППАРАТУРНОЕ ОФОРМЛЕНИЕ ХРОМАТОГРАФИЧЕСКИХ ПРОЦЕССОВ
• Ход изменения концентрации элюентазадается формой и соотношением размеров
смесителя и резервуара, начальными
концентрациями элюента в смесителе и
резервуаре и может быть рассчитан.
Пусть в некоторый момент концентрация
элюирующего агента в смесителе равна C
(исходная концентрация C0). Пусть сосуды
являются цилиндрическими, но имеют
различные радиусы и соответственно
площади поперечного сечения (S1 и S2).
98
99. АППАРАТУРНОЕ ОФОРМЛЕНИЕ ХРОМАТОГРАФИЧЕСКИХ ПРОЦЕССОВ
• Представим себе ход процесса в следующем виде.Из смесителя, временно разобщенного с
резервуаром, на колонку подается порция
раствора с концентрацией элюента C. Уровень
жидкости в смесителе понижается на величину
Δh1. При этом объем вытекающей жидкости равен
V = S1Δh1. Затем подача раствора на колонку
временно прекращается и восстанавливается
сообщение смесителя с резервуаром. Часть
жидкости из резервуара (с концентрацией C1)
перетекает в смеситель до выравнивания уровня в
обоих сосудах. Общее понижение уровня составит
величину Δh. Обратим внимание на то, что Δh и
Δh1 < 0, а Δh < Δh1. Объем жидкости, перешедшей
из резервуара в смеситель, будет равен S2Δh.
99
100. АППАРАТУРНОЕ ОФОРМЛЕНИЕ ХРОМАТОГРАФИЧЕСКИХ ПРОЦЕССОВ
• Очевидно, чтоS1 Δh1 - Δh = S2 Δh .
S2
Δh1 = 1+ Δh .
S1
Попытаемся рассчитать изменение концентрации
ΔC элюирующего агента в смесителе после
описанных событий.
100
101. АППАРАТУРНОЕ ОФОРМЛЕНИЕ ХРОМАТОГРАФИЧЕСКИХ ПРОЦЕССОВ
Объём жидкости в смесителе будет равен S1(h – Δh).Из смесителя на колонку ушло количество вещества,
равное
S2
CS1 Δh1 - Δh = CS1 Δh = CS2 Δh .
S1
Из резервуара в смеситель поступило количество
вещества, равное C1S2 Δh = C1S1 (Δh1 - Δh).
Разница между этими количествами вещества,
отнесенная к объему жидкости в смесителе, есть
изменение концентрации элюирующего агента в
смесителе.
101
102. АППАРАТУРНОЕ ОФОРМЛЕНИЕ ХРОМАТОГРАФИЧЕСКИХ ПРОЦЕССОВ
Помня о знаке Δh, получаем:S1 (h - Δh)ΔC = -S2 (C1 - C)Δh, ΔC = -
C1S2 Δh - CS2 Δh
.
S1 h - Δh
Переходя от конечных разностей к дифференциалам
и отбрасывая слагаемое dhdC как бесконечно малую
величину второго порядка малости, получаем:
S1hdC = -S2 C1 - C dh,
S2 dh
dC
=
.
C1 - C S1 h
102
103. АППАРАТУРНОЕ ОФОРМЛЕНИЕ ХРОМАТОГРАФИЧЕСКИХ ПРОЦЕССОВ
Интегрируя в соответствующих пределах, получаем:C
h
S2 dh
dC
-
=
,
C1 - C h0 S1 h
C0
S2
C1 - C h S1
=
,
C1 - C0 h0
S2
h S1
C 1 - C = C 1 - C0
,
h0
S2
h S1
C = C 1 - C 1 - C0 .
h0
C 1 - C S2
h
ln
= ln ,
C1 - C0 S1 h0
Полученное уравнение
позволяет рассчитать ход
изменения концентрации
элюирующего агента в
смесителе по мере
прокачивания раствора через
хроматографическую колонку
(в зависимости от соотношения
диаметров смесителя и
резервуара).
103
104. АППАРАТУРНОЕ ОФОРМЛЕНИЕ ХРОМАТОГРАФИЧЕСКИХ ПРОЦЕССОВ
• Рассмотренные выше системы смеситель/резервуароснованы на принципе сообщающихся сосудов и
поэтому называются равноуровенными.
• Однако в практике используют и другой тип этих
систем – герметично закрытый сосуд с
перемешиванием (смеситель), в который поступает
раствор элюента конечной концентрации из
резервуара. В этом случае объем раствора в смесителе
остается постоянным в течение всего процесса
элюции, точнее до тех пор, пока в резервуаре еще
остается элюент. При этом форма смесителя никакой
роли в создании формы градиента не играет.
104
105. АППАРАТУРНОЕ ОФОРМЛЕНИЕ ХРОМАТОГРАФИЧЕСКИХ ПРОЦЕССОВ
На колонкуИз резервуара
• Концентрация
раствора элюента в
смесителе С,
резервуаре – С1.
• Раствор с помощью
насоса подается на
колонку, смеситель
закрыт герметично,
объем жидкости в
смесителе
постоянный.
105
106. АППАРАТУРНОЕ ОФОРМЛЕНИЕ ХРОМАТОГРАФИЧЕСКИХ ПРОЦЕССОВ
• Рассмотрим, каким законом определяетсяизменение концентрации элюента в таком
смесителе. Если из смесителя вышло количество
вещества CdV, то за это же время в смеситель из
резервуара перетекло количество вещества CedV
(Се – концентрация элюента в резервуаре).
Изменение количества вещества в смесителе
можно, таким образом, записать в следующем
виде:
CedV - CdV = VmdC ,
• где Vm – объем смесителя.
106
107. АППАРАТУРНОЕ ОФОРМЛЕНИЕ ХРОМАТОГРАФИЧЕСКИХ ПРОЦЕССОВ
• Из этого соотношения получаем:dC
dV
=
.
Ce - C Vm
• Начальные условия для интегрирования этого уравнения:
при V = 0 (элюент из смесителя еще не вытекал на колонку)
C = C0 (начальная концентрация элюента в смесителе).
Интегрируя уравнение с учетом этих начальных условий,
получаем
Ce - C
V
ln
=
,
Ce - C0 Vm
C = Ce - Ce - C0 e
-
V
Vm
.
Такой градиент называется экспоненциальным.
107
108. ПРЕПАРАТИВНЫЕ ХРОМАТОГРАФИЧЕСКИЕ КОЛОННЫ
108109. ПРЕПАРАТИВНЫЕ ХРОМАТОГРАФИЧЕСКИЕ КОЛОННЫ
109110. ХРОМАТОГРАФИЯ С СИМУЛЯЦИЕЙ ПОДВИЖНОГО СЛОЯ СОРБЕНТА
Принцип хроматографиис симуляцией
подвижного слоя
сорбента
Черепаха и котенок бегут
по полотну транспортера,
лента которого движется
им навстречу. Скорость
ленты меньше, чем
скорость котенка, но
больше, чем скорость
черепахи. Котенок
оказывается впереди
транспортера, черепаха
отбрасывается назад.
110
111. ХРОМАТОГРАФИЯ С СИМУЛЯЦИЕЙ ПОДВИЖНОГО СЛОЯ СОРБЕНТА
Хроматографическаяколонка с непрерывной
подачей разделяемой смеси
и элюента. Разделяемая
смесь подается в центр
колонки, растворитель
движется слева направо,
сорбент перемещается
справа налево.
Смесь разделяется: быстро
движущийся компонент (с
малым временем
удерживания) оказывается
в «раффинате», компонент
с большим временем
удерживания – в
«экстракте».
111
112. ХРОМАТОГРАФИЯ С СИМУЛЯЦИЕЙ ПОДВИЖНОГО СЛОЯ СОРБЕНТА
Четырехсекционная системахроматографических
колонок с непрерывной
подачей разделяемой смеси
и элюента. Разделяемая
смесь подается в центр
системы, растворитель и
сорбент движутся в
противоположных
направлениях.
Разделение компонентов А
и В происходит в секциях 2
и 3, секция 1 регенерирует
сорбент, секция 4 – очищает
растворитель.
112
113. ХРОМАТОГРАФИЯ С СИМУЛЯЦИЕЙ ПОДВИЖНОГО СЛОЯ СОРБЕНТА
Выход рафината(малое время
удерживания)
Секция 4, Q4
Секция 3, Q3
Направление
переключения
портов и потока
жидкой фазы
Подача
элюента
Секция 1,
Q1
Схема производственной
установки для хроматографии с
симуляцией подвижного слоя:
Четырехсекционная система с
изменением функции портов
ввода.
Подача разделяемой смеси
осуществляется в левый
нижний порт, через
определенное время
происходит переключение так,
что смесь подается в левый
верхний порт и так далее.
Синхронно переключаются и
порты подачи растворителя,
вывода раффината и экстракта.
В итоге разделение упрощается
и ускоряется. Симуляция
подвижного слоя сорбента
достигается переключением
портов.
Секция 2, Q2
Подача
разделяемой
смеси
Выход экстракта
(большое время
удерживания)
Операционная схема четырех-секционной
установки для хроматографии с симуляцией
подвижного слоя сорбента
113
114. МЕМБРАННЫЕ ТЕХНОЛОГИИ
• Ранее мы рассматривали процессфильтрации как способ стерилизации
питательных сред, а также разделения
суспензий. По сути, процесс заключается в
том, что на пути потока суспензии
устанавливается полупроницаемая
перегородка - фильтр, через которую
свободно проникает дисперсионная среда жидкость или газ - и не проникает
дисперсная фаза - пыль, частицы осадка и
т.п.
114
115. МЕМБРАННЫЕ ТЕХНОЛОГИИ
• Простейшими материалами,используемыми для приготовления
полупроницаемых перегородок являются
ткани, специальные сорта бумаги, слои
волокнистых материалов (вата, асбест,
стекловолокно), которые задерживают
достаточно крупные частицы дисперсной
фазы. Однако с прогрессом науки и
технологии появились материалы,
способные задерживать все более мелкие
частицы и даже относительно крупные
молекулы.
115
116. МЕМБРАННЫЕ ТЕХНОЛОГИИ
• В итоге сформировался специальныйраздел техники фракционирования
сложных смесей - мембранные технологии.
С их помощью появляется возможность не
только разделять суспензии, но и
фракционировать смеси белков по
размерам молекул, концентрировать
белковые фракции различного
молекулярного веса, производить
обессоливание воды и т.п.
116
117. МЕМБРАННЫЕ ТЕХНОЛОГИИ
ТЕХНОЛОГИЯПРЕДЕЛЫ,
мкм
ПРИМЕРЫ
ОБЪЕКТОВ
ОБЛАСТИ
ПРИМЕНЕНИЯ
Диализ,
обратный осмос
5•10-4 -5 •10-2
Аминокислоты,
сахара, прочие
низкомолекулярные
метаболиты
Обессоливание
воды, очистка
низкомолекулярных продуктов
Ультрафильтрация
5 •10-3-5•10-1
Биополимеры вирусы,
рибосомы, мелкие
бактерии
Очистка биополимеров, стерилизация
питательных сред и
продуктов
Микрофильтрация
10-1 – 10
Крупные бактерии,
микроскопические
грибы, культивируемые эукариотические
клетки
Удаление мелких
частиц примесей,
предварительная
стерилизация
Обычная
фильтрация
>1,0 мкм
Механические
частицы, пыльца
растений
Удаление механических примесей
117
118. МЕМБРАННЫЕ ТЕХНОЛОГИИ
В нашем случае системы раствор - растворитель,разделенной полупроницаемой перегородкой так,
что по одну сторону этой перегородки находится
раствор, а по другую - растворитель, причем через
эту перегородку может проникать только
растворитель, возникает следующая ситуация.
Слева от перегородки, где находится чистый
растворитель, его мольная доля х = 1, и,
следовательно, его химический потенциал μL = μo.
Справа от перегородки – раствор, химический
потенциал растворителя μR равен μR =μ o + RTlnx,
где RTln x < 0 (х < 1). μL >μR – химический потенциал
растворителя справа меньше, чем слева.
118
119. МЕМБРАННЫЕ ТЕХНОЛОГИИ
pL
R RTlnx L
p>p
p > p
Направления
потока
растворителя
При р>π возникает поток
растворителя из части системы с
более концентрированным
раствором в часть системы с
менее концентрированным
раствором. Это явление
называют обратным осмосом.
Растворенное вещество при этом
остается там, где его
концентрация выше.
Технология используется для
концентрирования растворов, в
том числе для обессоливания
растворителя, в частности – для
опреснения морской воды.
119
120. МЕМБРАННЫЕ ТЕХНОЛОГИИ
Возникшая разность химических потенциалов темвыше, чем ниже х, то есть чем выше концентрация
раствора. Под влиянием этой разности возникает
поток растворителя в раствор через
полупроницаемую перегородку, и интенсивность
этого потока тем выше, чем выше концентрация
растворенного вещества. Это явление получило
название осмос. Молекулы растворителя могут
переходить и в обратном направлении, однако
преимущественным направлением переноса
является перенос растворителя из части с бóльшим
химическим потенциалом в часть с меньшим его
значением.
120
121. МЕМБРАННЫЕ ТЕХНОЛОГИИ
На практике при использовании мембранных технологийвстречаются некоторые осложнения. Одним из таковых является
«концентрационная поляризация» мембраны – явление
аналогичное концентрационной поляризации фильтров. Если
давление направлено перпендикулярно поверхности мембраны,
то в приповерхностном слое жидкости возникает локальное
повышение концентрации растворенного вещества. Это приводит
к повышению сопротивления мембраны, которое приходится
компенсировать повышением избыточного давления. Преодолеть
эту ситуацию можно путем либо разрушением приповерхностного
слоя, либо предотвращения его образования.
Первая задача решается посредством эффективного
перемешивания раствора, вторая - путем проведения процесса в
циркуляционном режиме с тангенциальным потоком жидкости
по отношению к поверхности мембраны.
121
122. МЕМБРАННЫЕ ТЕХНОЛОГИИ
Исходныйпродукт
Направление фильтрации (→)
перпендикулярно направлению
потока (↓)
Поток раствора продукта смывает
слой концентрационной
поляризации мембраны, вихри
Тейлора усиливают массообмен
концентрат
Фильтрат
Вихри Тейлора
122
123. МЕМБРАННЫЕ ТЕХНОЛОГИИ
•В последние годы интенсивно разрабатывается технологияпрепаративной очистки различных продуктов биосинтеза с
использованием ионообменных или содержащих аффинные лиганды
мембран (мембранная хроматография). Применение мембранной
хроматографии позволяет обеспечить высокую производительность по
потоку в сочетании с высокой селективностью. Повышенная по
сравнению с гранульными хроматографическими материалами
производительность по потоку у мембранных адсорберов достигается за
счет снятия диффузионных ограничений для разделяемых компонентов.
В типичном эксперименте за одну стадию на адсорбере с поверхностью
мембраны 16 м2 и продолжительностью цикла 7 мин может быть
очищено 60 г гемоглобина из бычьей крови.
•Gottschalk U., Fischer-Freuhholz S., Reif O. Membrane Adsorbers. A Cutting
Edge Process Technology at the Threshold // BioProcess International. 2004. Vol.
2. No.5. P. 56-65. http://www.bioprocessintl.com/
123
124. КОНЦЕНТРИРОВАНИЕ
Другим способом удалениявлаги является распылительная сушка. Раствор продукта
подается в форсунку, через
которую распыляется в
противоположно направленный поток горячего воздуха.
Мелкие капли раствора быстро
испаряются, продукт при этом
нагревается мало за счет отдачи
тепла на испарение, термоинактивации не происходит.
Имеет место унос продукта
током воздуха, необходимо
улавливание
Выход
горячего
воздуха
Подача
раствора
продукта
Форсунка
для
распыления
раствора
Поток
горячего
воздуха
Выход
сухого
продукта
на
фасовку
124
125. КОНЦЕНТРИРОВАНИЕ
Для особо чувствительных к температуре продуктовприменяется лиофильная сушка - сушка
вымораживанием. Раствор продукта замораживается и
помещается в вакуумную камеру, в которой происходит
возгонка льда. Переход льда в газовую фазу
сопровождается сильным отводом тепла и
охлаждением продукта в процессе высушивания.
Процедура весьма дорогая, используется лишь при
производстве препаратов медицинского назначения,
специальная высоко автоматизированная аппаратура
позволяет осуществлять процесс в стерильных
условиях, продукт после выгрузки оказывается в
состоянии, готовом к контролю и реализации.
125
126. ТОВАРНАЯ ФОРМА ПРОДУКТА
Готовая форма продукта – сложнаякомпозиция.
Состав готовой формы определяется
основными требованиями к товарному
продукту:
• Обеспечение сохранности активности
действующего начала продукта в процессе
хранения;
• Обеспечение возможности проявления
активности действующего начала в
процессе применения.
126
127. ТОВАРНАЯ ФОРМА ПРОДУКТА
Полныйсостав
готовой
называют РЕЦЕПТУРОЙ.
формы
Рецептура товарной формы продукта
включает
помимо
действующего
начала соответствующие компоненты
и наполнители.
127
128. ТОВАРНАЯ ФОРМА ПРОДУКТА
• Для продуктов, предназначенных для длительногохранения в крупных фасовках, в качестве наполнителя
в составе товарной формы должны присутствовать
компоненты, препятствующие слеживанию продукта.
• Для продуктов, предназначенных для применения в
виде распыляемых порошков или растворов
(микробиологические средства защиты растений и т.п.)
в состав рецептур вводят компоненты,
обеспечивающие смачивание поверхности, на которой
продукт должен находиться для проявления своих
свойств (например, поверхностно активные вещества).
• Для ферментных и других белковых препаратов в
качестве наполнителей используются компоненты,
стабилизирующие белковые вещества по отношению к
внешним воздействиям.
128
129. ТОВАРНАЯ ФОРМА ПРОДУКТА
• В рецептуру товарного продукта,предназначенного для введения в
организм как лекарственного средства, в
качестве дополнительных компонентов
могут быть введены также вещества,
защищающие действующее начало от
воздействия сред организма по пути к
месту действия.
• Во всех случаях компоненты рецептуры НЕ
ДОЛЖНЫ НАНОСИТЬ УЩЕРБ
ОКРУЖАЮЩЕЙ СРЕДЕ.
129
130. ОРГАНИЗАЦИЯ ПРОИЗВОДСТВЕННОГО ПРОЦЕССА И КОНТРОЛЯ КАЧЕСТВА ПРОДУКЦИИ В БИОТЕХНОЛОГИИ
• Как биотехнологическая продукция, так и процесс еепроизводства подвергаются строгому контролю
качества.
• Наиболее строгий контроль за качеством продукции
осуществляется при производстве лекарственных
средств и их компонентов.
• Для оказания помощи органам здравоохранения
импортирующих стран в оценке технического уровня
производства и качества закупаемых ими
лекарственных средств создана «Система
удостоверения качества фармацевтических
препаратов в международной торговле» - особый вид
многостороннего международного соглашения.
130
131. ОРГАНИЗАЦИЯ ПРОИЗВОДСТВЕННОГО ПРОЦЕССА И КОНТРОЛЯ КАЧЕСТВА ПРОДУКЦИИ В БИОТЕХНОЛОГИИ
• Впервые эта система введена в действиеВсемирной организацией
здравоохранения (ВОЗ, WHO – World
Health Organization) в 1969 г.
Действующий в настоящее время
вариант системы принят в 1975 г.
• В настоящее время к системе
присоединилось более 80 государств.
131
132. ОРГАНИЗАЦИЯ ПРОИЗВОДСТВЕННОГО ПРОЦЕССА И КОНТРОЛЯ КАЧЕСТВА ПРОДУКЦИИ В БИОТЕХНОЛОГИИ
Для участия в системе необходимоналичие в стране трех условий:
• 1) государственная система регистрации
лекарственных средств;
• 2) государственное инспектирование
фармацевтических предприятий;
• 3) наличие правил GMP (Good
Manufacturing Practices –Правил
правильного производства).
132
133. ОРГАНИЗАЦИЯ ПРОИЗВОДСТВЕННОГО ПРОЦЕССА И КОНТРОЛЯ КАЧЕСТВА ПРОДУКЦИИ В БИОТЕХНОЛОГИИ
• GMP – единая система требований к организациипроизводства и контролю качества лекарственных
средств от начала переработки сырья до получения
готовых продуктов.
• Существуют национальные Правила GMP,
региональные (Правила стран Европейского
Экономического Сообщества, Правила странучастников «Соглашения по фармацевтическому
контролю» – Pharmaceutical Inspection Convention, PIC,
Правила стран-членов Ассоциации стран ЮгоВосточной Азии) и международные правила GMP –
Правила Всемирной организации здравоохранения.
133
134. ОРГАНИЗАЦИЯ ПРОИЗВОДСТВЕННОГО ПРОЦЕССА И КОНТРОЛЯ КАЧЕСТВА ПРОДУКЦИИ В БИОТЕХНОЛОГИИ
• В России действует НАЦИОНАЛЬНЫЙ СТАНДАРТРОССИЙСКОЙ ФЕДЕРАЦИИ «ПРАВИЛА
ПРОИЗВОДСТВА И КОНТРОЛЯ КАЧЕСТВА
ЛЕКАРСТВЕННЫХ СРЕДСТВ» (ГОСТ Р 52249-2009),
утвержденный Приказом Федерального агентства по
техническому регулированию и метрологии от 20 мая
2009 г №159ст. Дата введения 01.01 2010.
Этот документ обязателен для всех предприятий,
выпускающих готовые лекарственные средства
медицинского назначения и лекарственные вещества,
предназначенные для изготовления готовых
лекарственных средств.
134
135. ОРГАНИЗАЦИЯ ПРОИЗВОДСТВЕННОГО ПРОЦЕССА И КОНТРОЛЯ КАЧЕСТВА ПРОДУКЦИИ В БИОТЕХНОЛОГИИ
Правила включают в себя следующие разделы:•Определения;
•Управление качеством;
•Персонал;
•Здания и помещения;
•Оборудование;
•Процесс производства;
•Валидация;
•Рекламации и отзыв продукта с рынка;
• Самоинспекция .
135
136. ОРГАНИЗАЦИЯ ПРОИЗВОДСТВЕННОГО ПРОЦЕССА И КОНТРОЛЯ КАЧЕСТВА ПРОДУКЦИИ В БИОТЕХНОЛОГИИ
Раздел «Определения» определяет толкование терминов, используемых впроизводственной лексике. Примеры определения терминов:
• Предприятие - производитель лекарственных средств - организация,
осуществляющая производство лекарственных средств в соответствии с
требованиями Федерального закона "О лекарственных средствах".
• Лекарственные средства - вещества, применяемые для профилактики,
диагностики, лечения болезни, предотвращения беременности,
полученные из крови, плазмы крови, а также органов, тканей человека
или животного, растений, микроорганизмов, минералов, методами
синтеза или с применениям биологических технологий. К
лекарственным средствам относятся также вещества растительного,
животного или синтетического происхождения, обладающие
фармакологической активностью и предназначенные для производства
и изготовления лекарственных средств.
• Лекарственные препараты - дозированные лекарственные средства,
готовые к применению.
• Качество лекарственных средств - соответствие лекарственных средств
государственному стандарту качества лекарственных средств.
136
137. ОРГАНИЗАЦИЯ ПРОИЗВОДСТВЕННОГО ПРОЦЕССА И КОНТРОЛЯ КАЧЕСТВА ПРОДУКЦИИ В БИОТЕХНОЛОГИИ
Раздел «Управление качеством» определяеткомплекс мероприятий, обеспечивающих
качество выпускаемой продукции. При этом
должны учитываться требования GLP (Good
Laboratory Practices – Правила доклинической
оценки безопасности фармакологических
средств), GCP (Good Clinical Practices – Правил
проведения клинических испытаний) и GMP.
Здесь же устанавливается ответственность
предприятия за качество выпускаемых
лекарственных средств.
137
138. ОРГАНИЗАЦИЯ ПРОИЗВОДСТВЕННОГО ПРОЦЕССА И КОНТРОЛЯ КАЧЕСТВА ПРОДУКЦИИ В БИОТЕХНОЛОГИИ
• Раздел «Персонал» устанавливает требования к персоналу, занятомув процессе организации производства и контроля качества
выпускаемой продукции, порядок и направления подготовки
персонала и правила личной гигиены персонала, включая
требования об обязательном прохождении медицинского осмотра,
требования к состоянию здоровья и порядок приема пищи, ее
хранения (запреты принимать пищу, курить и хранить еду,
курительные материалы и личные лекарства в производственных
помещениях и на складах готовой продукции).
• Отдельно устанавливаются обязанности персонала «чистых
помещений», в числе которых ограничение входа и выхода в
«чистые» помещения и требование разработки специальных
инструкций. Производственный процесс в «чистых» помещениях
должен осуществляться минимальным количеством персонала с
ограничением проведения в этих помещениях инспекционных
мероприятий и контрольных процедур.
• Здесь же устанавливаются требования к уровню квалификации
персонала и определяется порядок повышения квалификации и
профессиональной переподготовки персонала, в том числе и
руководящего звена.
138
139. ОРГАНИЗАЦИЯ ПРОИЗВОДСТВЕННОГО ПРОЦЕССА И КОНТРОЛЯ КАЧЕСТВА ПРОДУКЦИИ В БИОТЕХНОЛОГИИ
• Раздел «Здания и помещения» содержит описаниеконструктивных особенностей зданий и сооружений, входящих
в комплекс фармацевтического предприятия, требования к
размещению фармацевтических предприятий относительно
жилых зон и других производств, отрицательно влияющих на
качество продукции.
• Производственные здания должны быть спроектированы и
построены так, чтобы свести к минимуму запыление,
загрязнение и исключить проникновение в них насекомых и
животных.
• В разделе устанавливаются общие требования к планировке
производственных зданий и к их инженерному оснащению,
нормы по допустимому содержанию в воздухе
производственных помещений микроорганизмов и
механических частиц. К помещениям для производства
стерильных лекарственных средств предъявляются
повышенные требования к их чистоте.
139
140.
КЛАССИФИКАЦИЯ ПОМЕЩЕНИЙ ПРОИЗВОДСТВАЛЕКАРСТВЕННЫХ СРЕДСТВ
Класс
чистоты
помещений
или зон
Максимально допустимое количество
частиц в 1 м3 воздуха размером, мкм
≥ 0,5
≥5
Оснащенное
состояние
≥ 0,5
≥5
Макс.
допустимое
кол-во жизнеспособных
микроорганизмов в 1
м3 воздуха
Функционирующее состояние
А
3500
0
3500
0
Менее 1
В
3500
0
350000
2000
10
С
350000
2000
3500000
20000
100
D
500000
20000
Не определено
200-500
140
141. ОРГАНИЗАЦИЯ ПРОИЗВОДСТВЕННОГО ПРОЦЕССА И КОНТРОЛЯ КАЧЕСТВА ПРОДУКЦИИ В БИОТЕХНОЛОГИИ
Раздел «Оборудование» устанавливает требования к оборудованию, используемомув производственном процессе. Эти требования направлены на то, чтобы
конструкция и размещение оборудования максимально облегчали его
подготовку к работе, эксплуатацию и обслуживание.
• - поверхности оборудования должны быть гладкими и изготовленными из
стойкого к коррозии материала, который выдерживает обработку
дезинфицирующими средствами и/или стерилизацию;
• - все детали оборудования, контактирующие с используемыми сырьем,
материалами и полупродуктами, должны быть съемными для облегчения их
мойки, обработки дезинфицирующими средствами или стерилизации;
Оборудование должно быть размещено таким образом, чтобы:
• - оптимизировать потоки исходного сырья, материалов;
• - предотвратить возможность загрязнения лекарственных средств в процессе их
производства;
• - предотвратить риск смешивания разных продуктов или исключения какой либо из стадий производственного процесса;
• - облегчить мойку, обработку, эксплуатацию и обслуживание оборудования.
Для работы в "чистых" помещениях оборудование, по возможности, должно быть
сконструировано и размещено таким образом, чтобы его эксплуатацию,
обслуживание и ремонт можно было проводить за пределами "чистых"
помещений.
Для работы в асептических условиях оборудование должно иметь регистрирующие
устройства для контроля параметров процесса и обеспечено устройствами
сигнализации, извещающими о неисправности.
141
142. ОРГАНИЗАЦИЯ ПРОИЗВОДСТВЕННОГО ПРОЦЕССА И КОНТРОЛЯ КАЧЕСТВА ПРОДУКЦИИ В БИОТЕХНОЛОГИИ
Раздел «Процесс производства» устанавливает требования к исходномусырью, его хранению и подготовке, подготовке и использованию
материалов первичной упаковки, к собственно производственному
процессу, маркировке и вторичной упаковке, хранению готового
продукта, обращению с остатками продукта, возвращению и
переработке брака, контролю процесса производства, порядку
регистрации процессов производства и контроля.
Неотъемлемой частью системы обеспечения качества готовых продуктов
является составленная надлежащим образом документация.
Основными документами, которые должны использоваться в процессе
производства, являются: технологические регламенты; инструкции;
производственные регистрационные записи; аналитические
методики, спецификации качества и другие стандарты предприятия.
Операции технологического процесса должны выполняться и контролироваться квалифицированным персоналом с использованием необходимого оборудования и приборов в специально предназначенных
для этих целей помещениях.
С целью предотвращения выпуска готового продукта, не соответствующего требованиям нормативной документации, должен проводиться
постадийный контроль процесса производства.
142
143. ОРГАНИЗАЦИЯ ПРОИЗВОДСТВЕННОГО ПРОЦЕССА И КОНТРОЛЯ КАЧЕСТВА ПРОДУКЦИИ В БИОТЕХНОЛОГИИ
Валидация заключается в документированномподтверждении соответствия оборудования, условий
производства, технологического процесса, качества
полупродукта и готового продукта действующим
регламентам и/или требованиям нормативной
документации.
Основными элементами валидации являются:
- оценка монтажа и работоспособности основного
технологического и вспомогательного оборудования, в
том числе компьютерных систем;
- оценка условий и параметров технологического
процесса;
- оценка предела возможного отклонения в ведении
процесса;
- оценка методов анализа;
- составление протоколов и отчета, аттестующих
технологический процесс.
143
144. ОРГАНИЗАЦИЯ ПРОИЗВОДСТВЕННОГО ПРОЦЕССА И КОНТРОЛЯ КАЧЕСТВА ПРОДУКЦИИ В БИОТЕХНОЛОГИИ
РЕКЛАМАЦИИ И ОТЗЫВ ПРОДУКТОВ С РЫНКАНа предприятии должен быть определен сотрудник, ответственный за
рассмотрение рекламаций и принимающий решение о подлежащих
осуществлению мероприятиях. Он должен иметь возможность
привлекать к работе необходимое количество сотрудников. Если этот
сотрудник не является руководящим сотрудником или ответственным
специалистом, то он должен довести до сведения последних каждую
рекламацию, ход ее расследования или отзыв с рынка лекарственных
веществ или готовых лекарственных средств.
На предприятии должен быть определен сотрудник, ответственный за
сбор и учет отзывов с рынка лекарственных веществ и готовых
лекарственных средств. Он имеет возможность привлекать к работе
необходимое количество сотрудников для безотлагательного
рассмотрения всех аспектов отзыва продуктов с рынка. Этот сотрудник,
как правило, независим от руководителя по реализации продукции.
Если этот сотрудник не является руководящим сотрудником или
ответственным специалистом, то он доводит до сведения последних
информацию о каждом случае отзыва продукта с рынка.
Осуществление отзыва продукта с рынка должно быть зафиксировано и
отражено в соответствующих производственных регистрационных
записях. Отчет и производственные регистрационные записи должны
быть включены в досье на препарат.
144
145. ОРГАНИЗАЦИЯ ПРОИЗВОДСТВЕННОГО ПРОЦЕССА И КОНТРОЛЯ КАЧЕСТВА ПРОДУКЦИИ В БИОТЕХНОЛОГИИ
САМОИНСПЕКЦИЯЦелью самоинспекции является оценка производителем
соответствия его фармацевтического производства всем
аспектам Правил. Программа проведения самоинспекции
должна быть поставлена таким образом, чтобы выявить любые
недостатки в выполнении Правил и рекомендовать
мероприятия, необходимые для их устранения. Самоинспекция
должна проводиться по плану и, кроме того, может быть
проведена дополнительно, например в случае отзыва продукта
с рынка. Проведение самоинспекции должно быть
запротоколировано.
На предприятии формируется группа по проведению
самоинспекции. Членами группы могут быть как сотрудники
предприятия, являющиеся высококвалифицированными
специалистами в своей области и хорошо знающие Правила, так
и независимые эксперты.
145


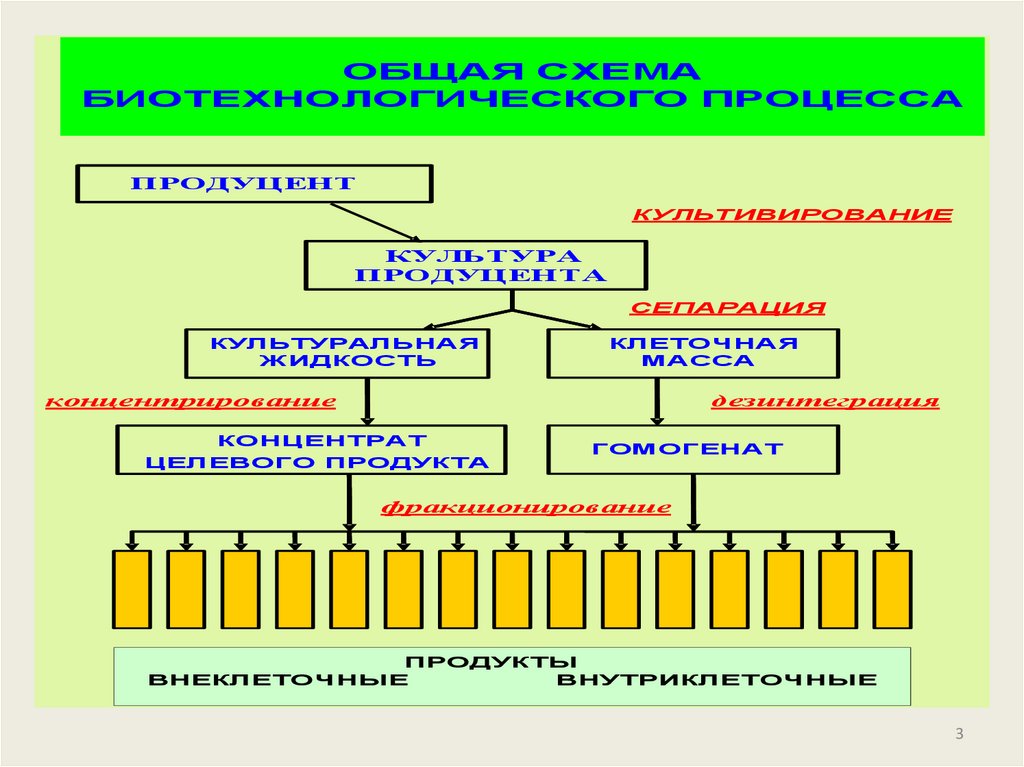

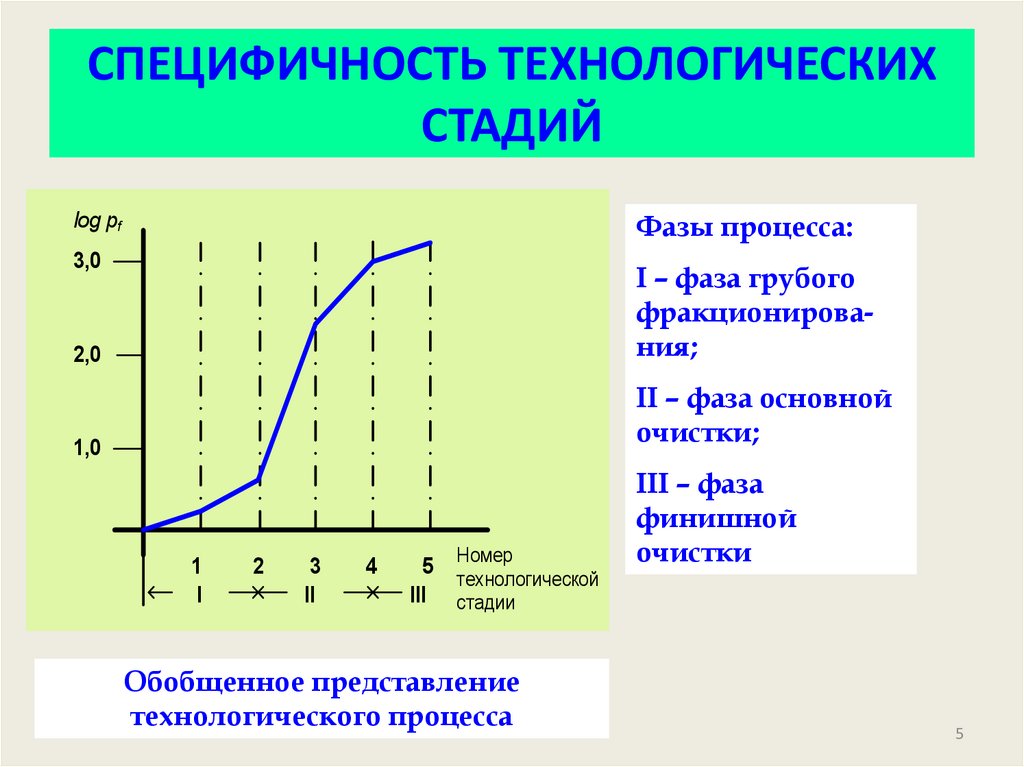




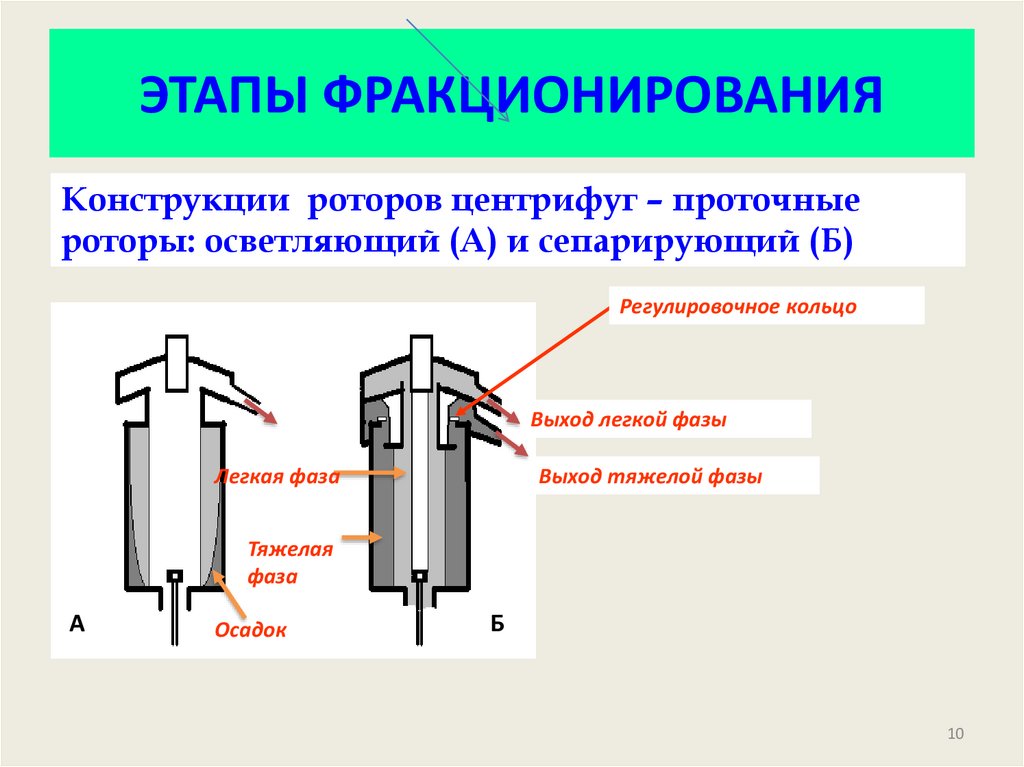







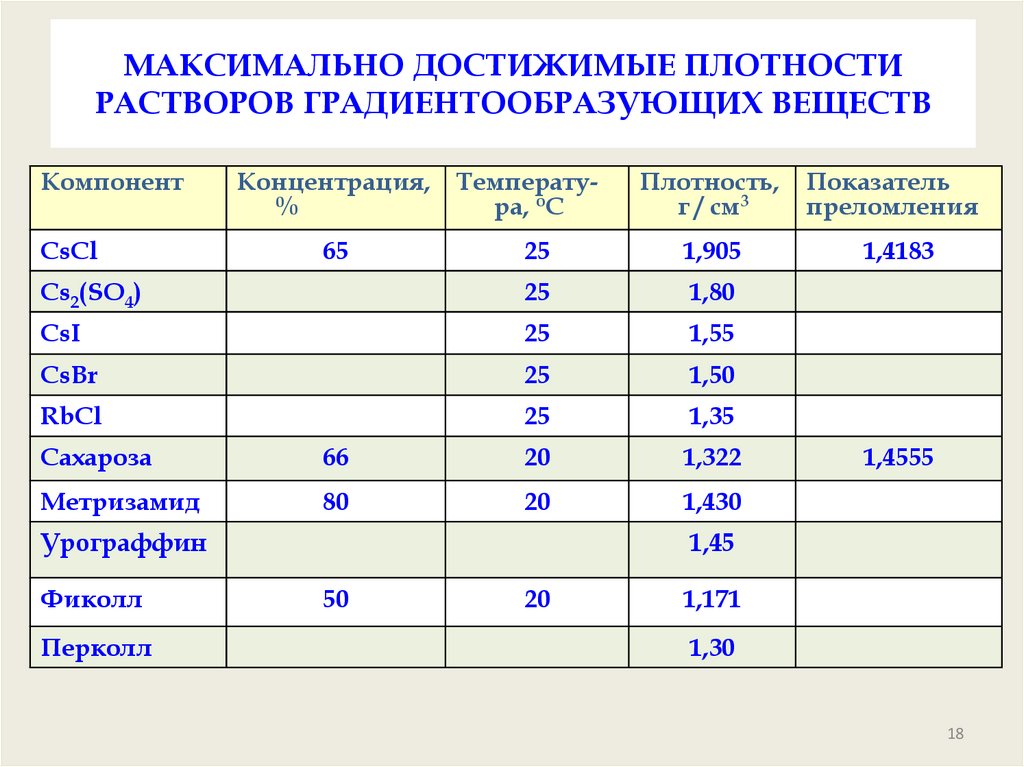
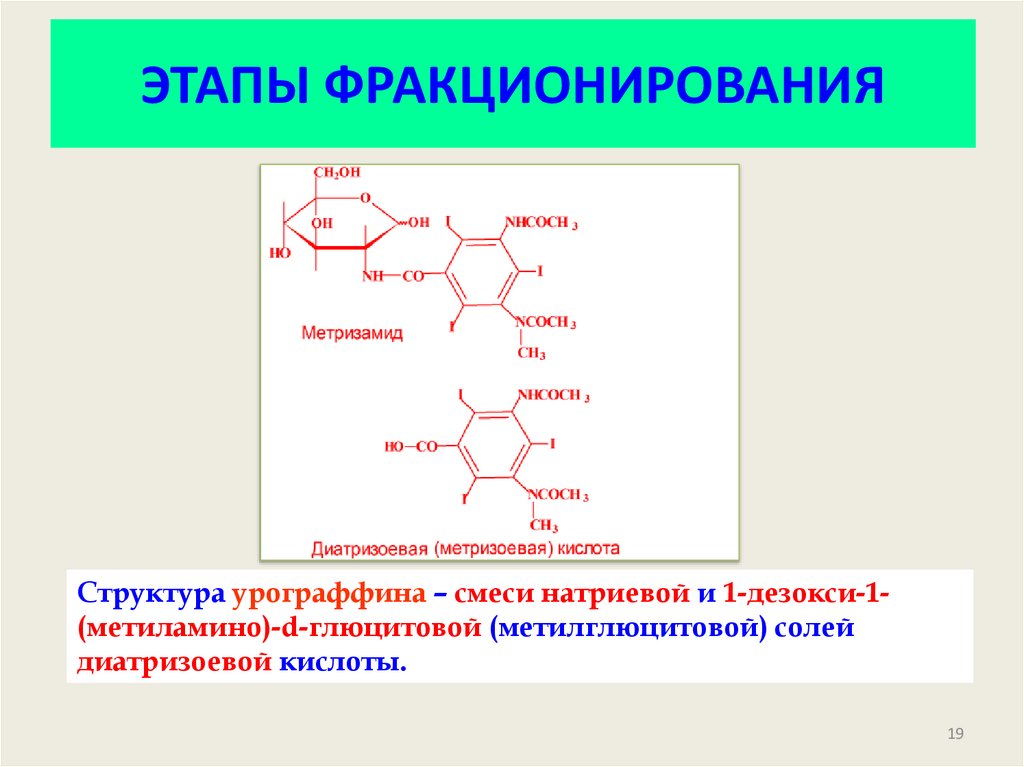

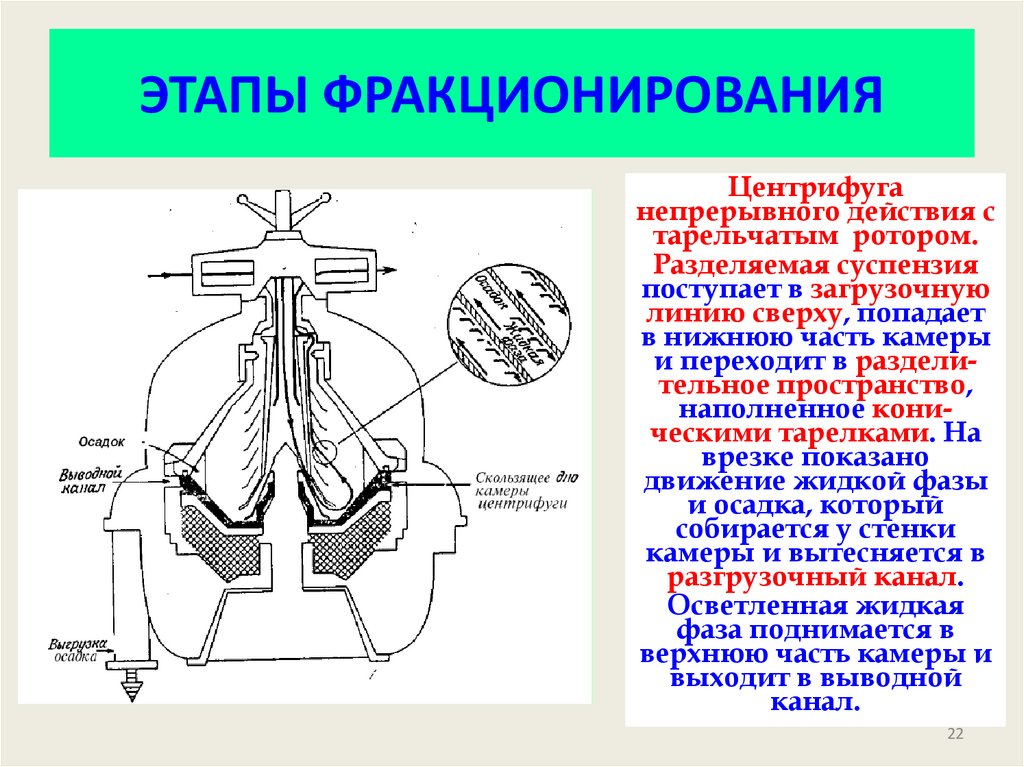



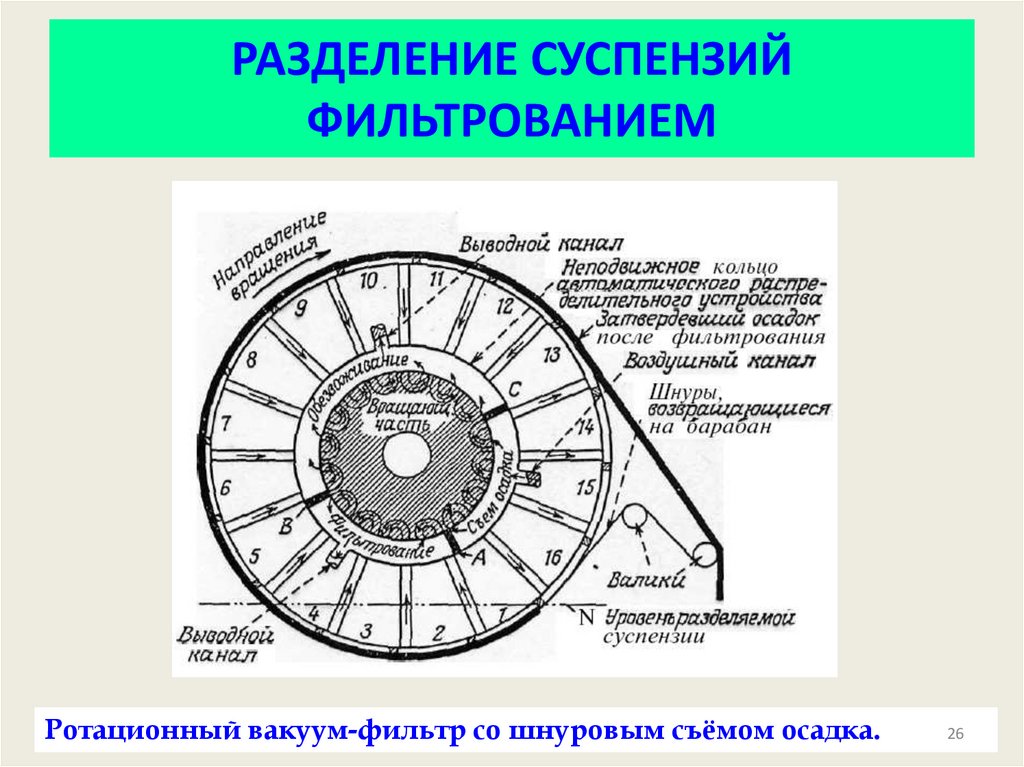













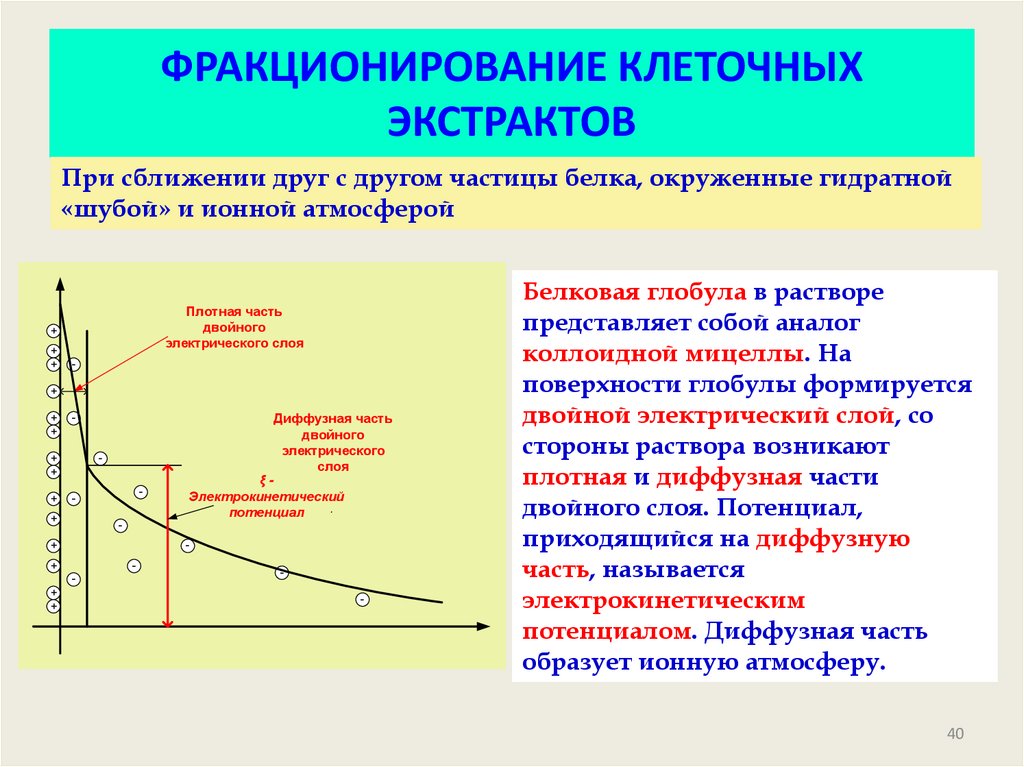
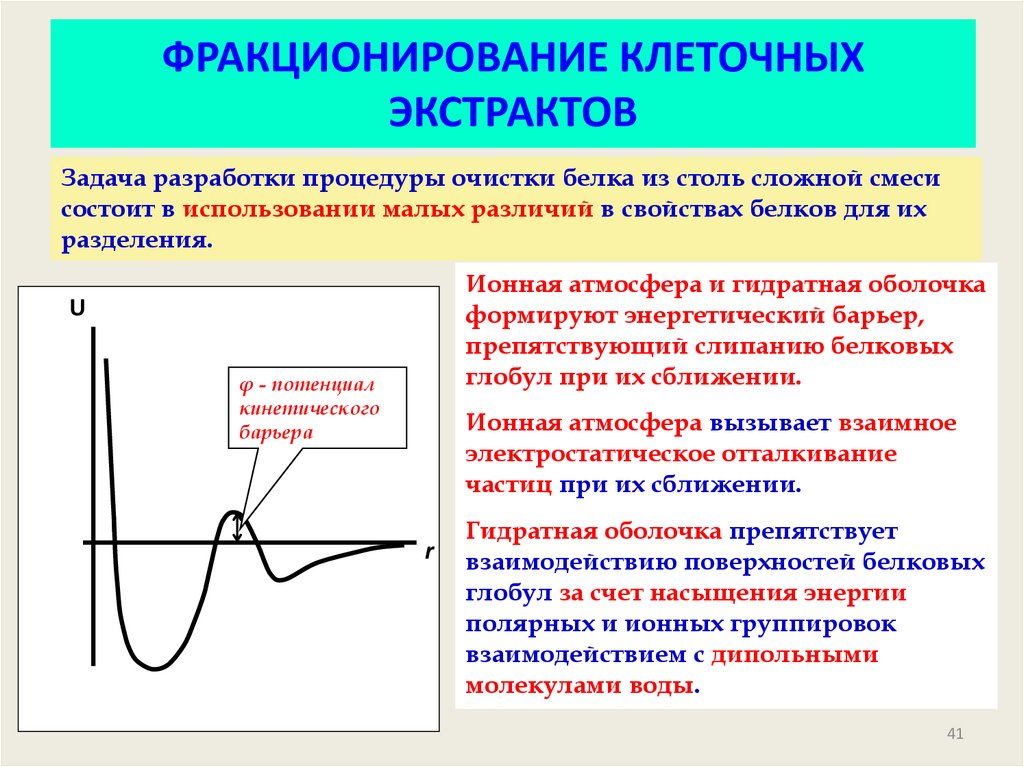




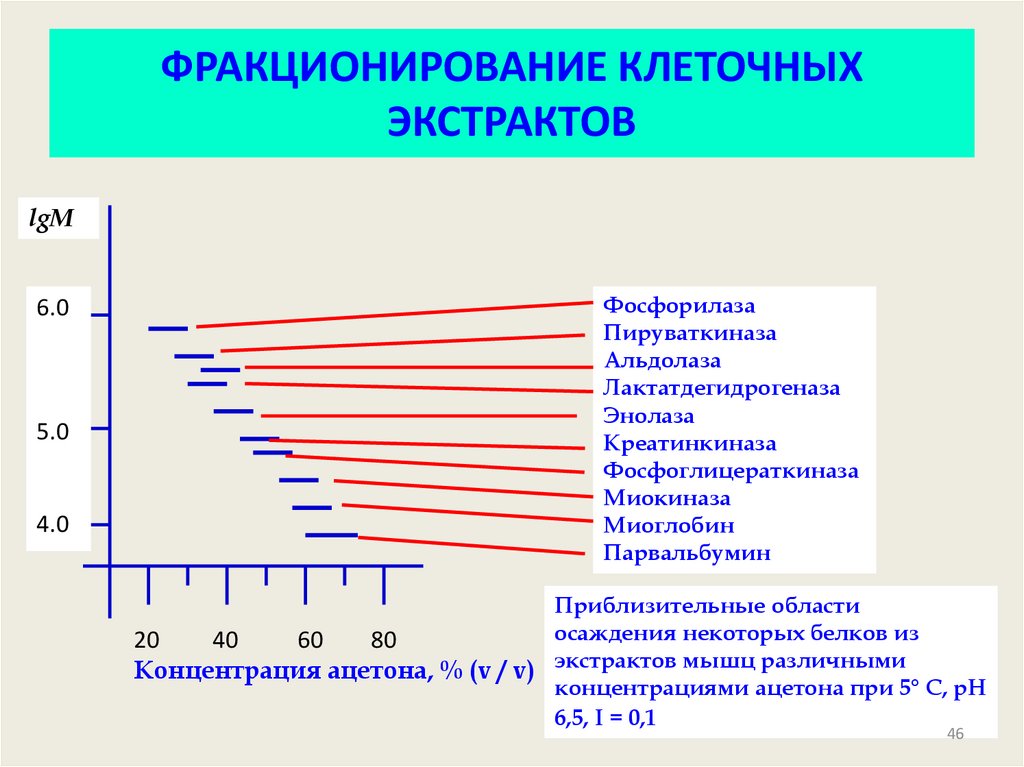

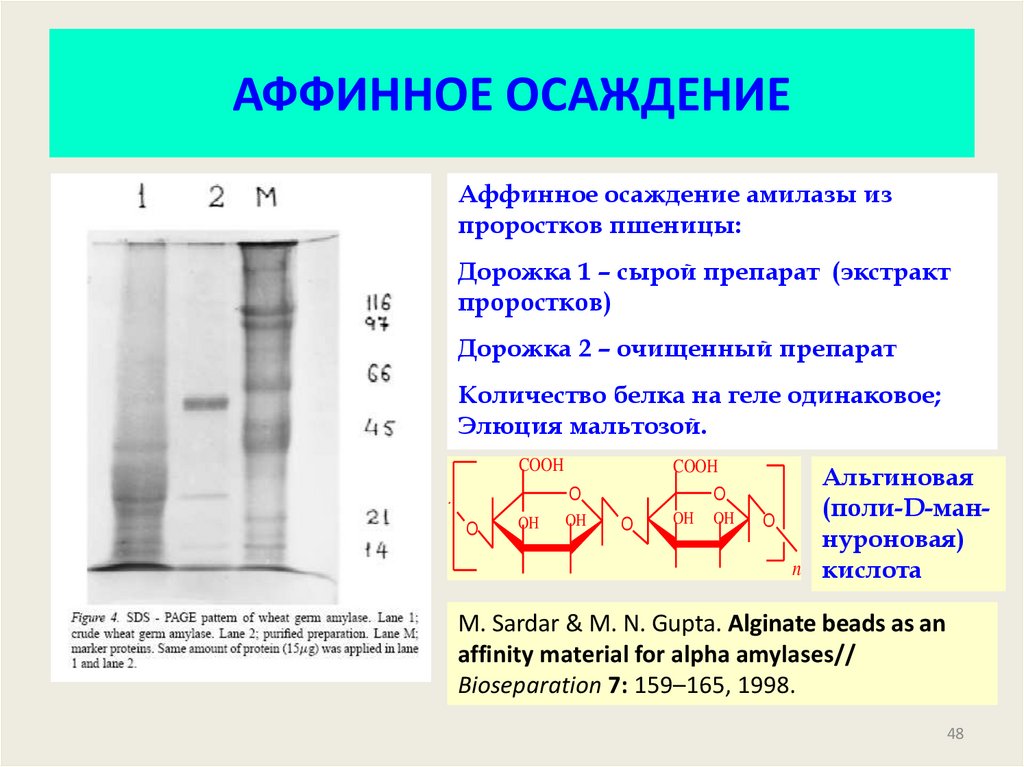







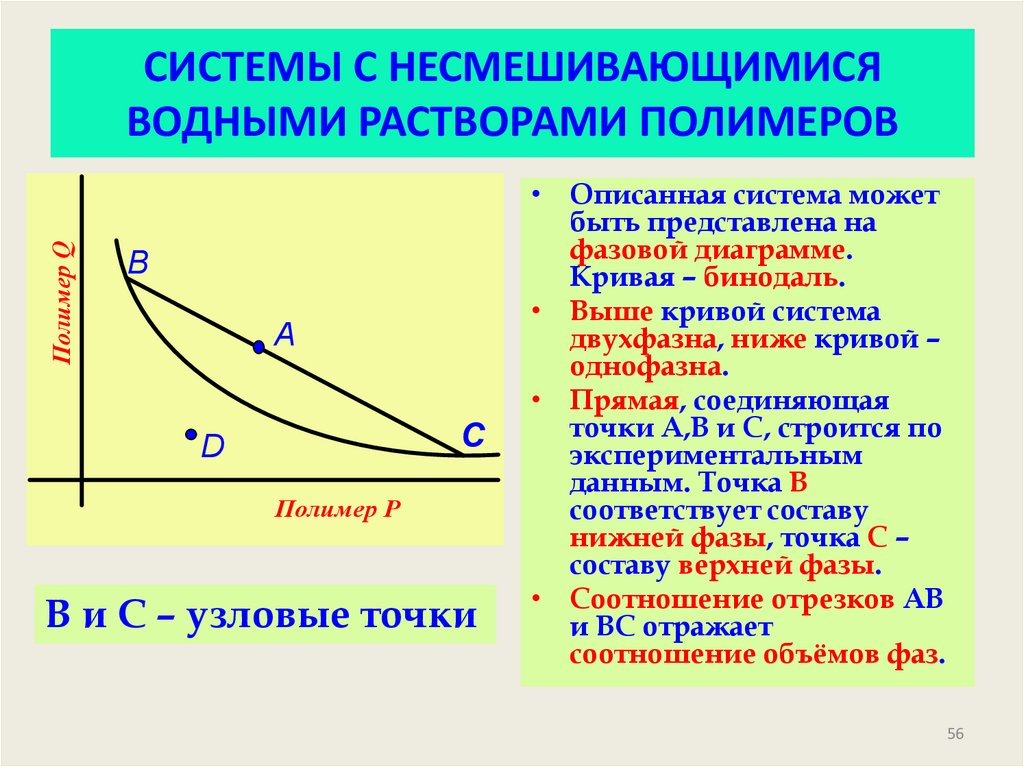


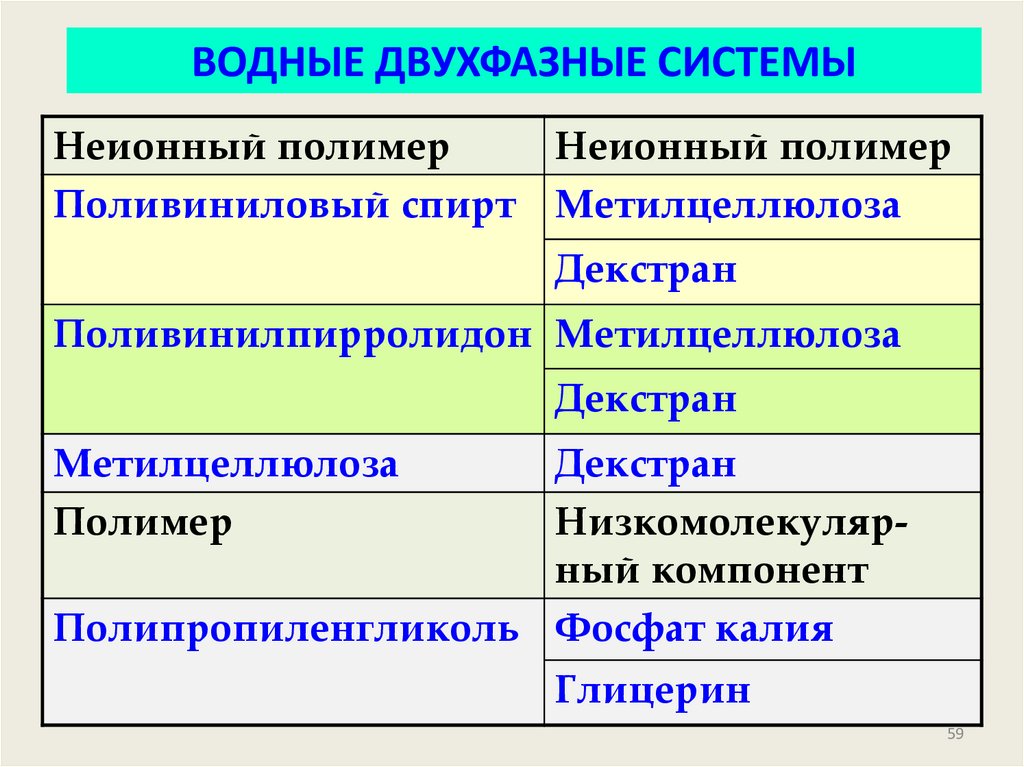
















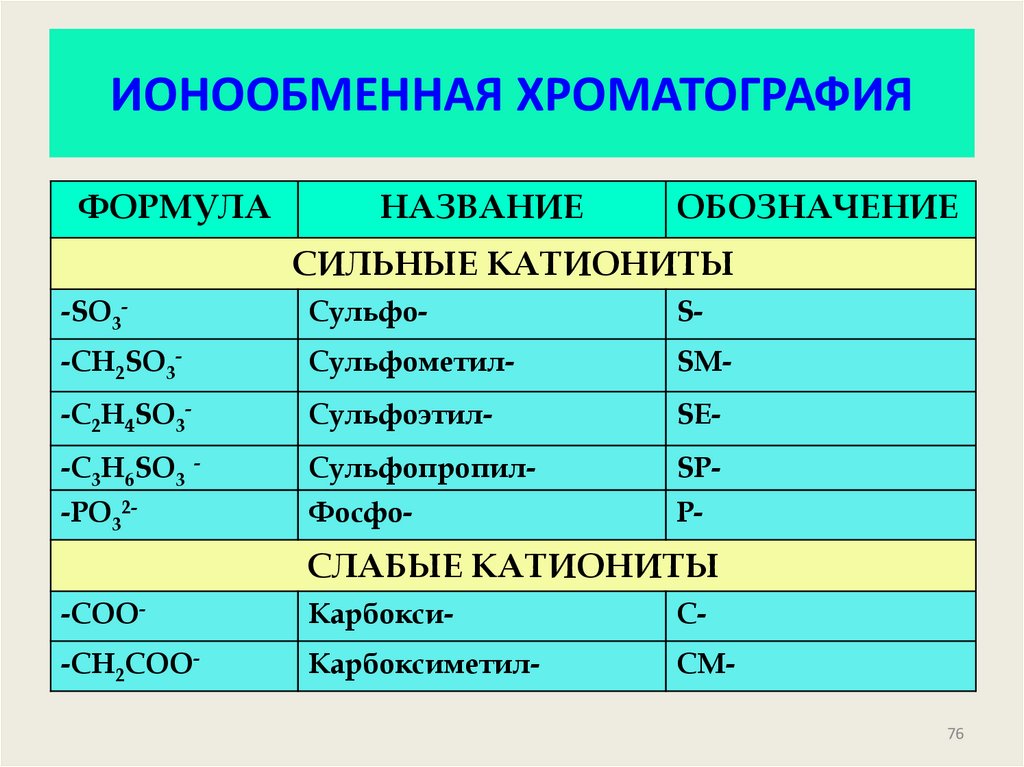
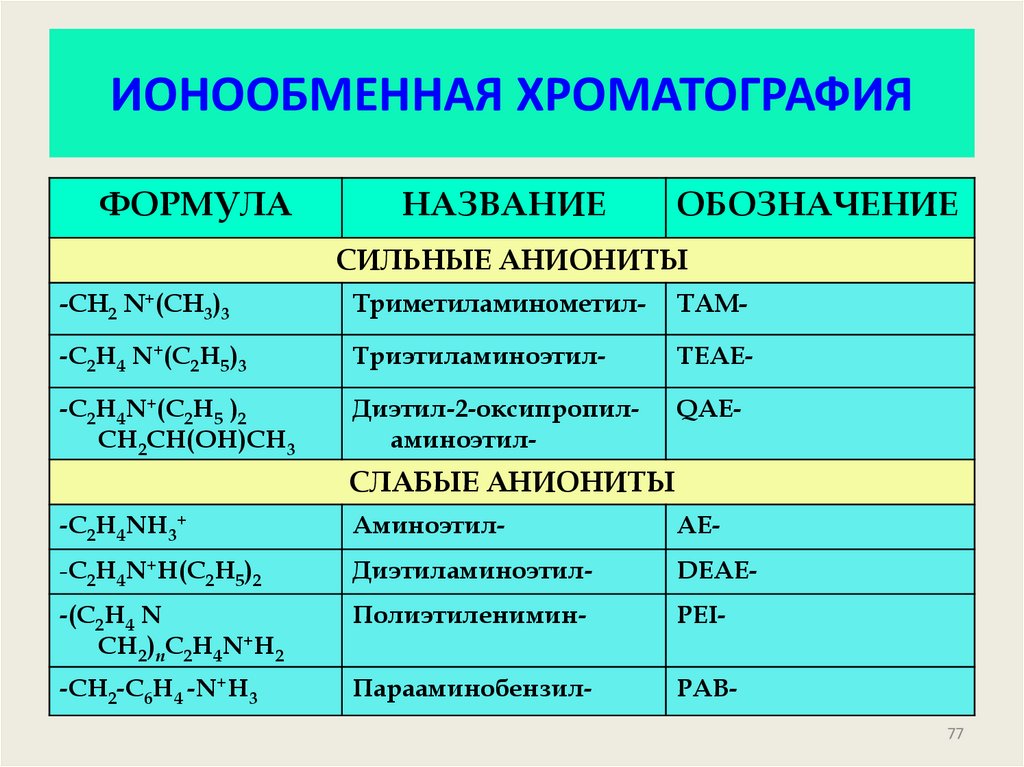



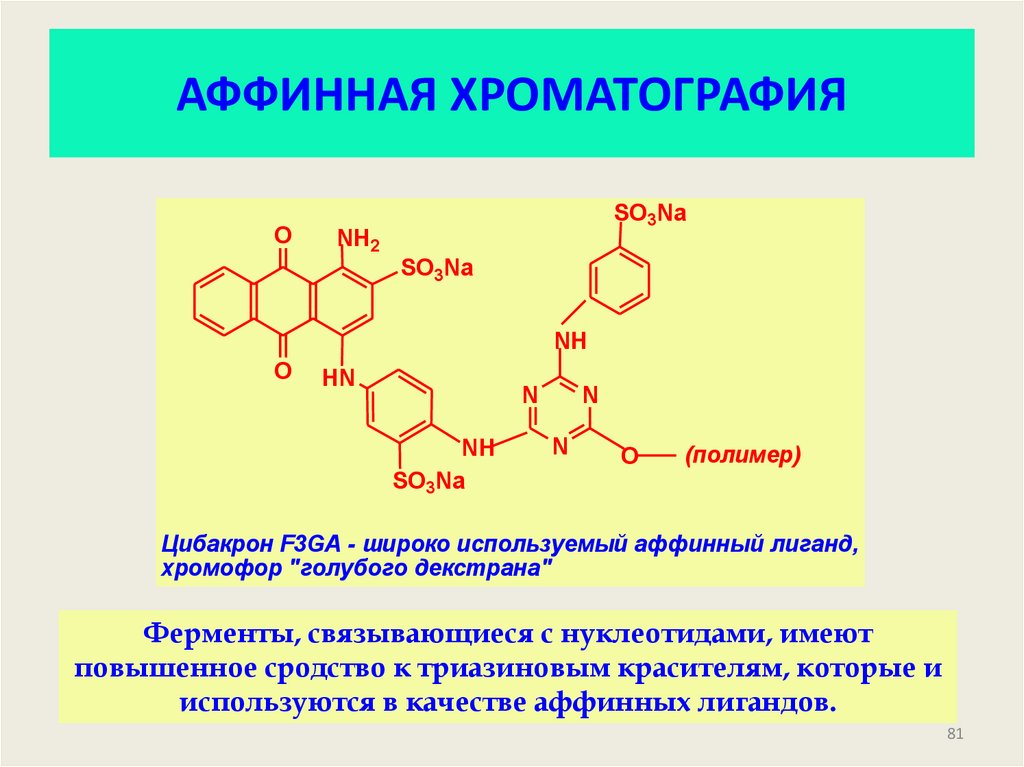

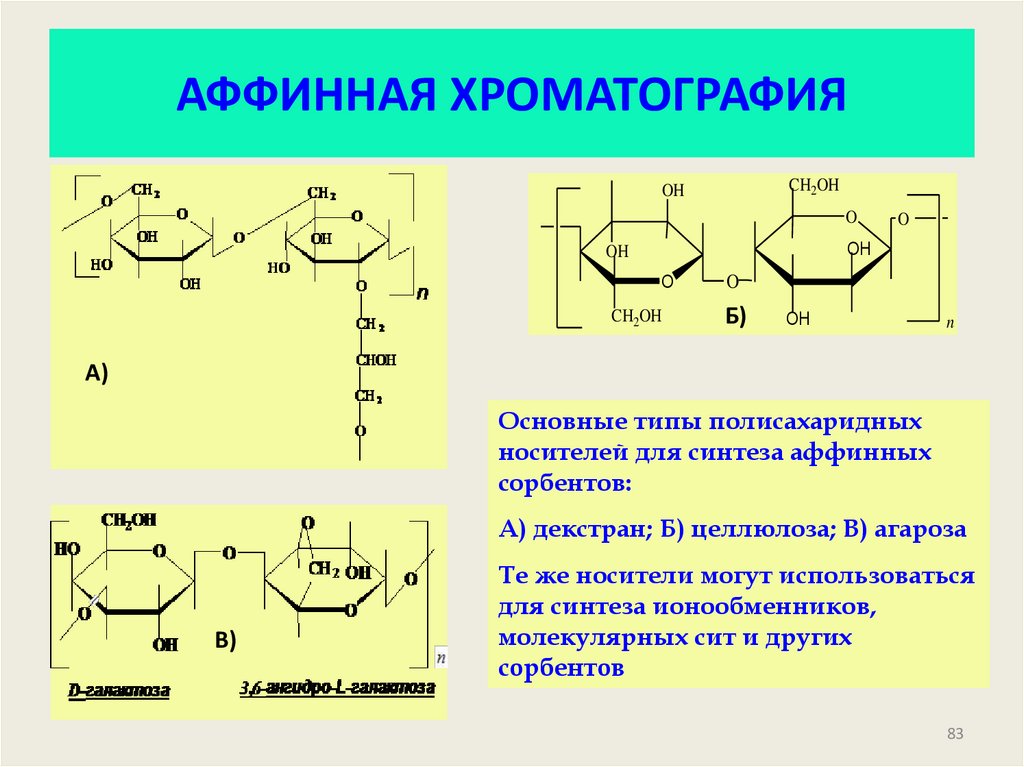


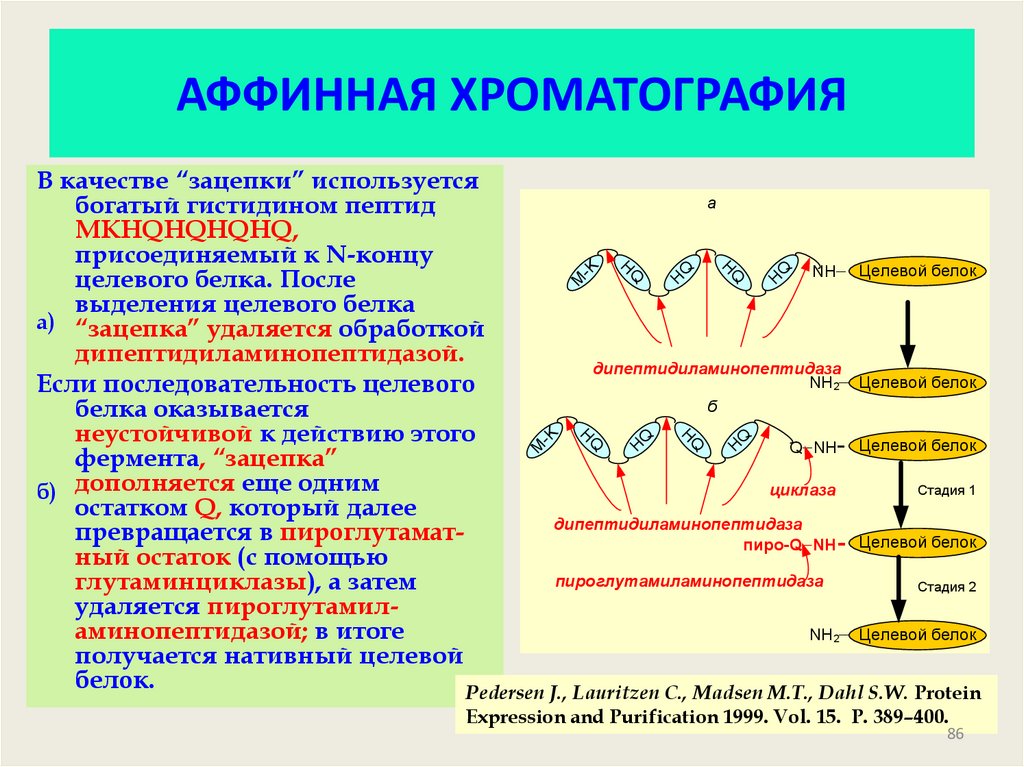
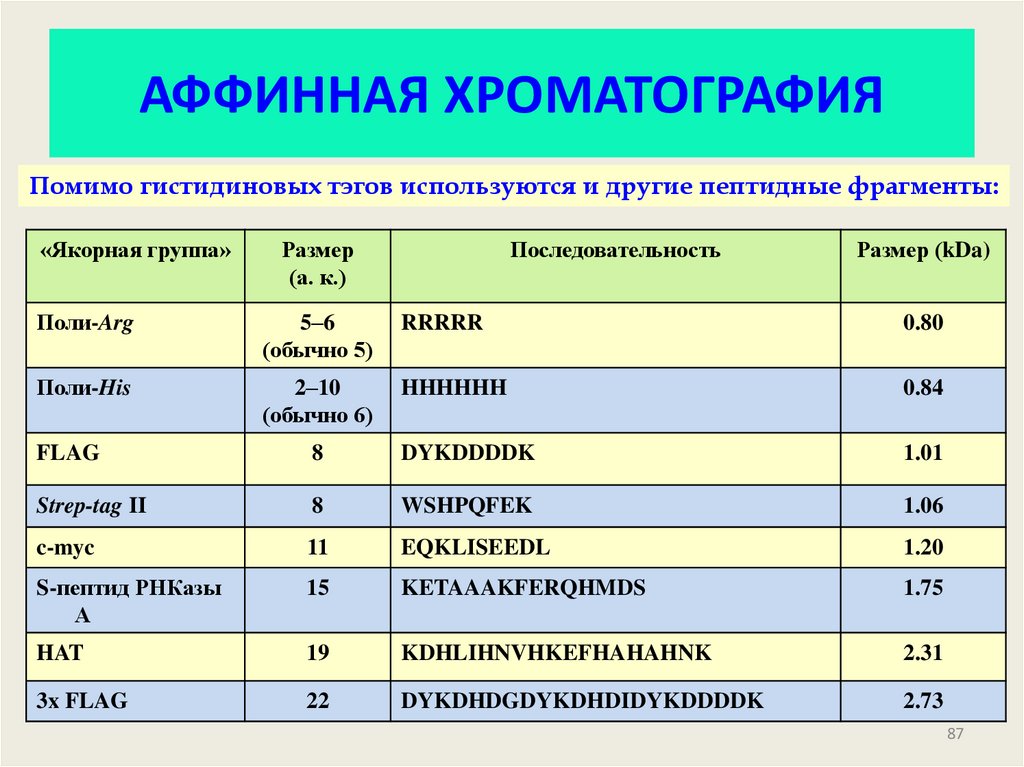

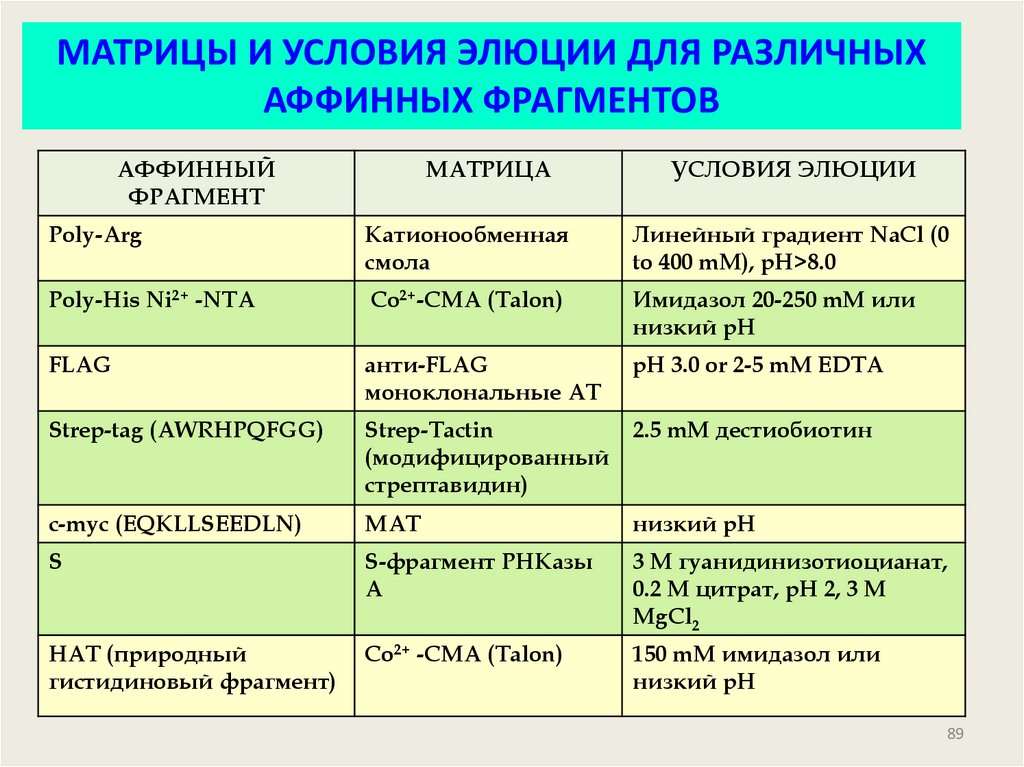
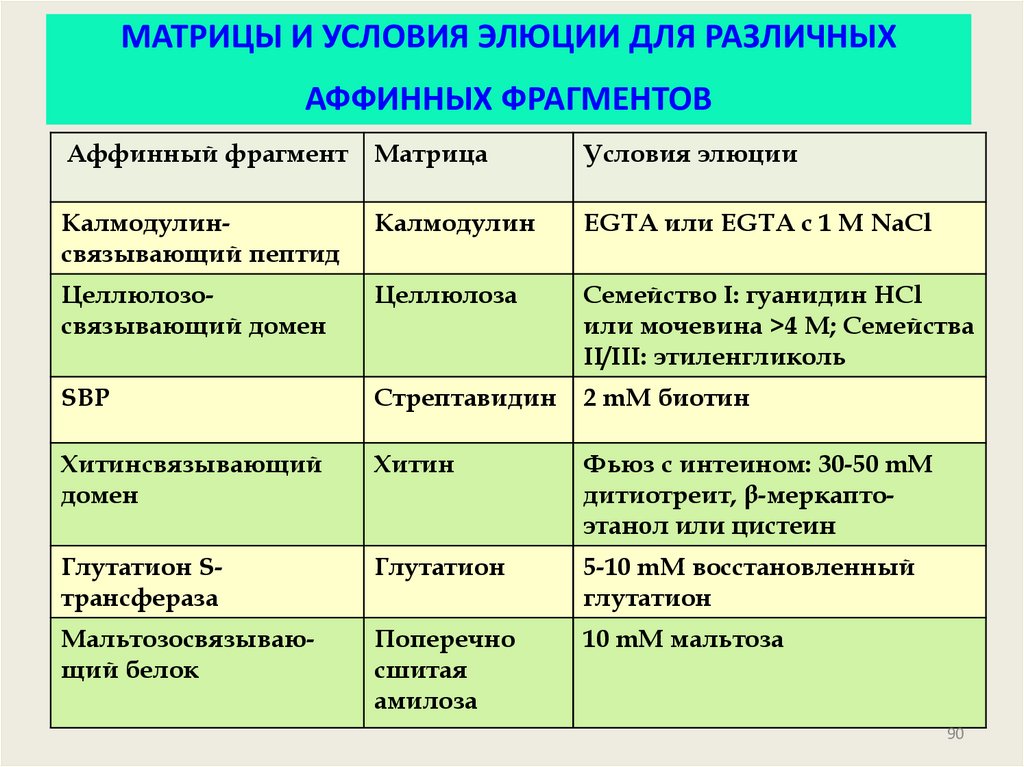

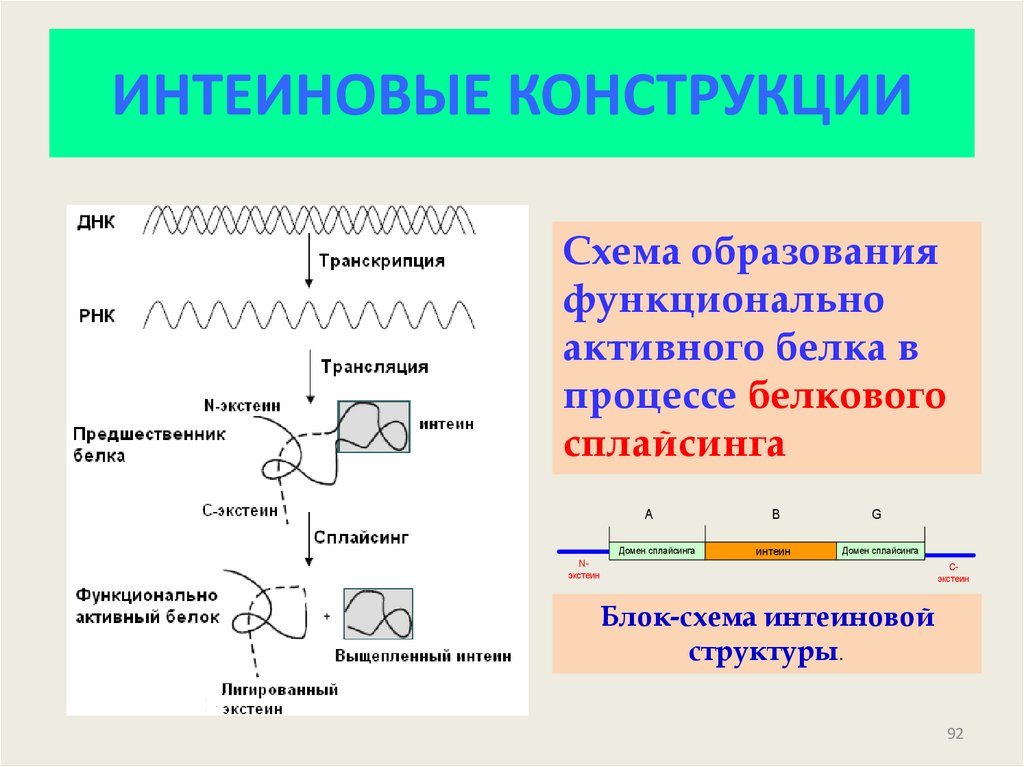

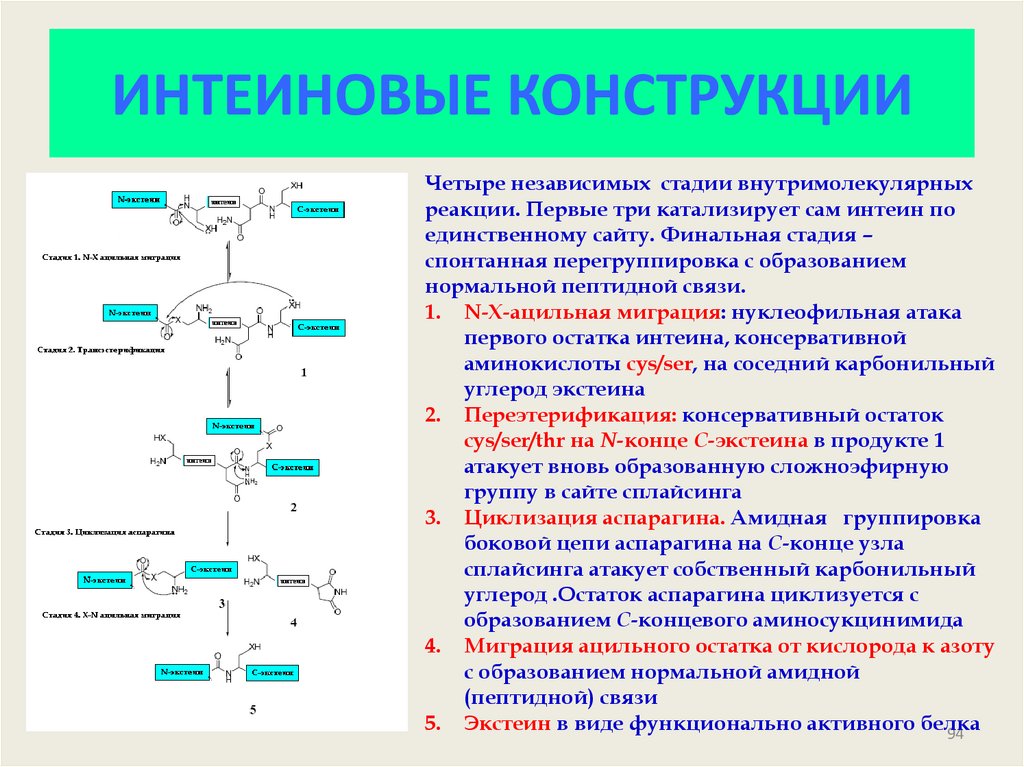










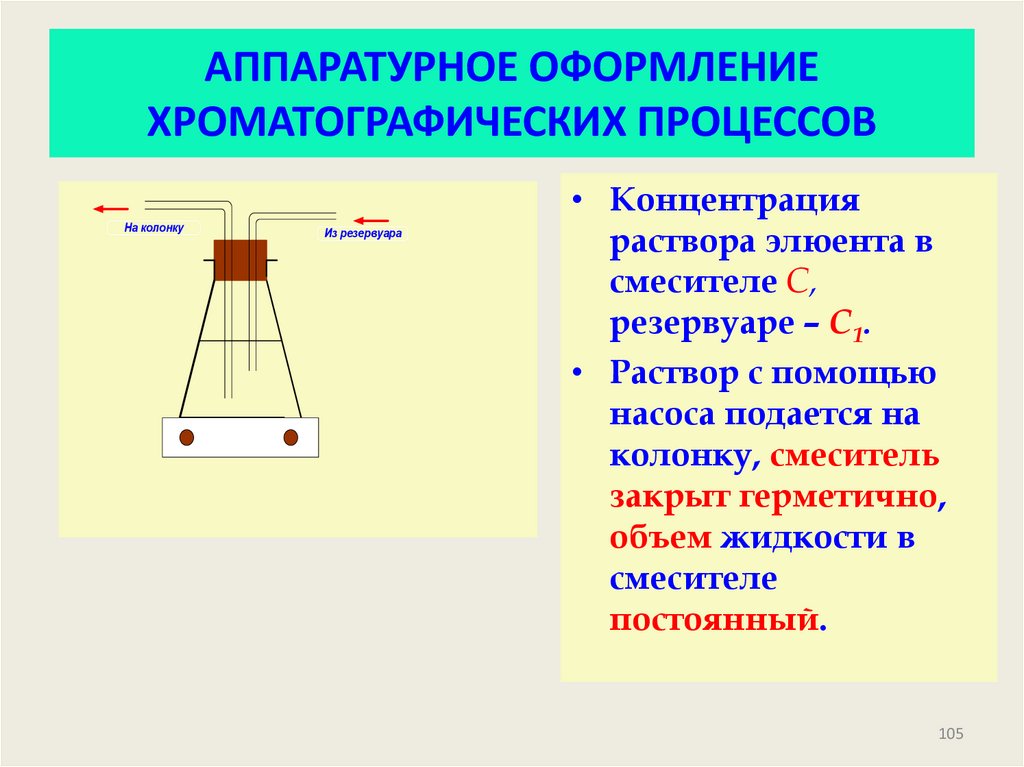



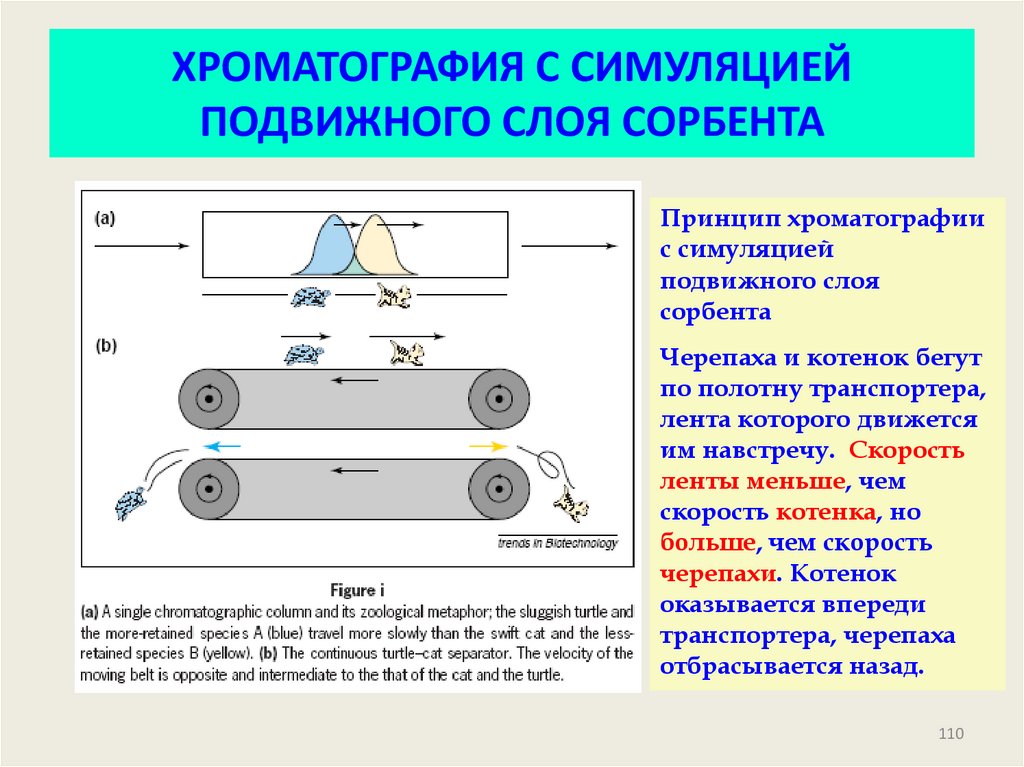
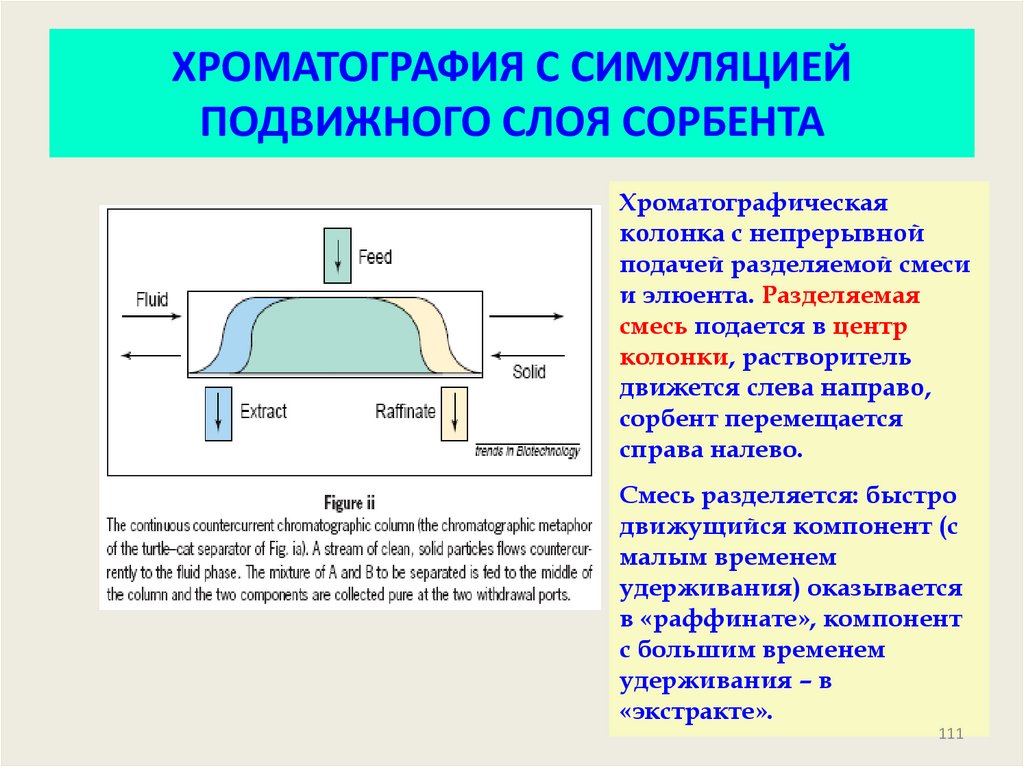
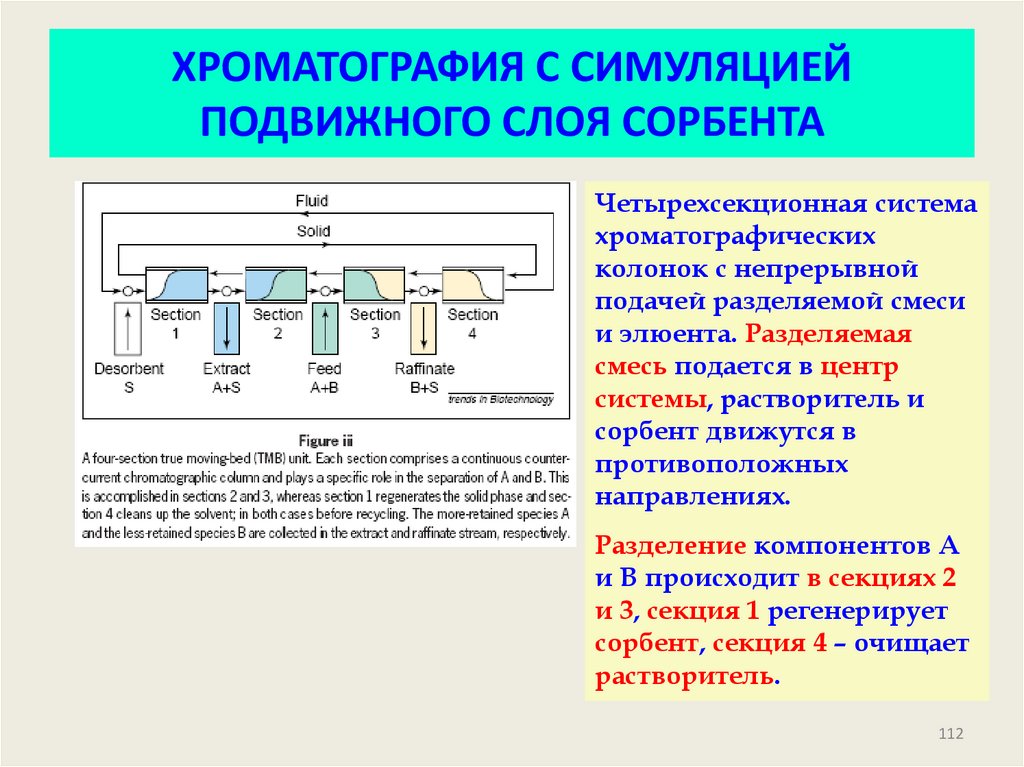
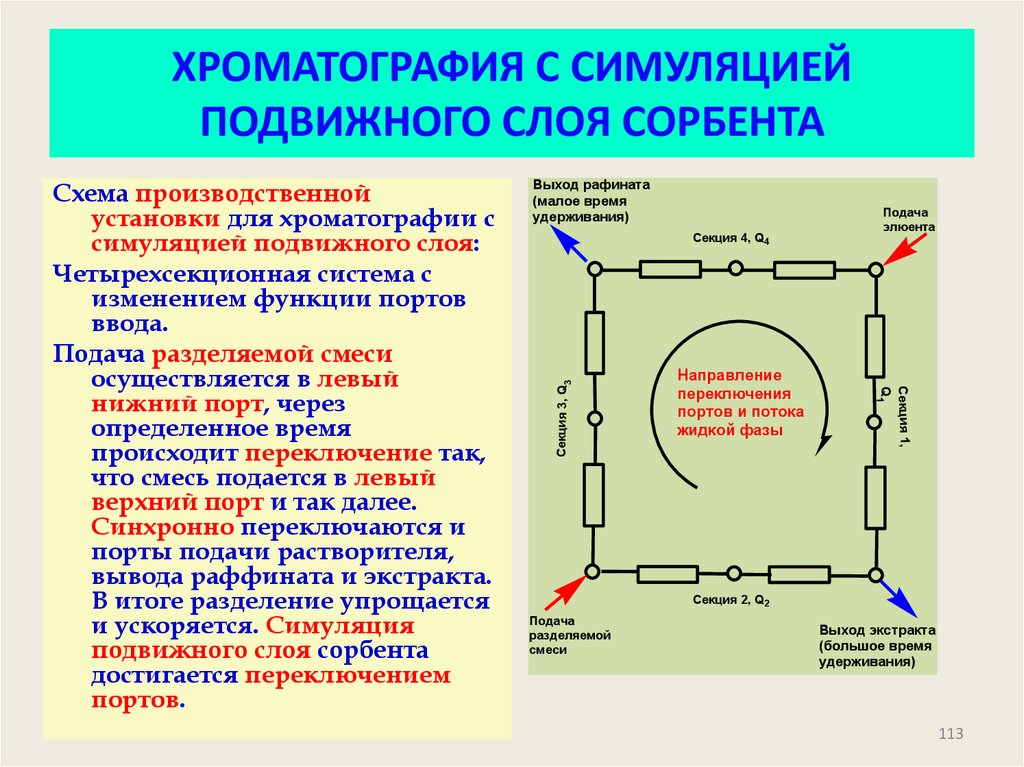



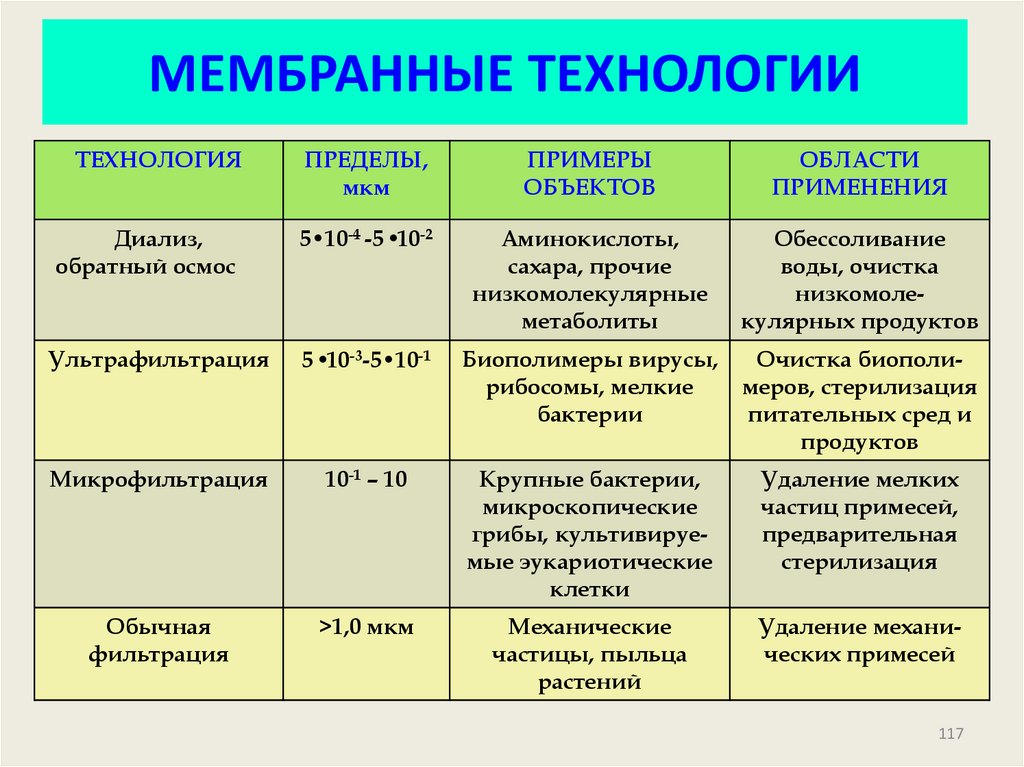

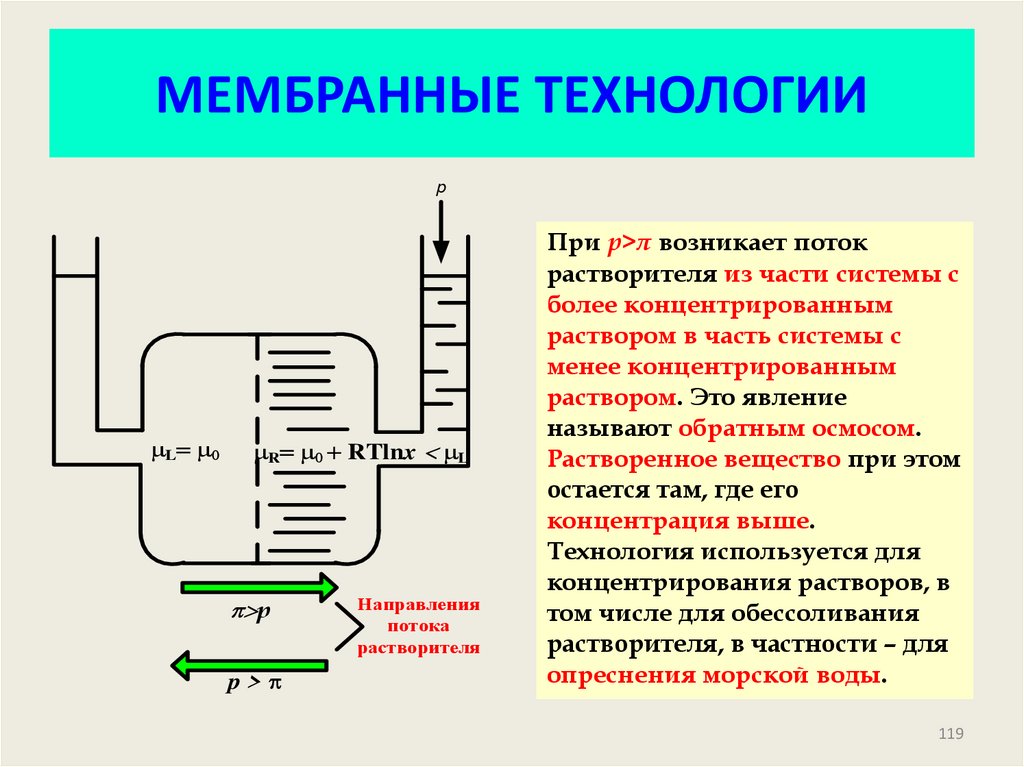


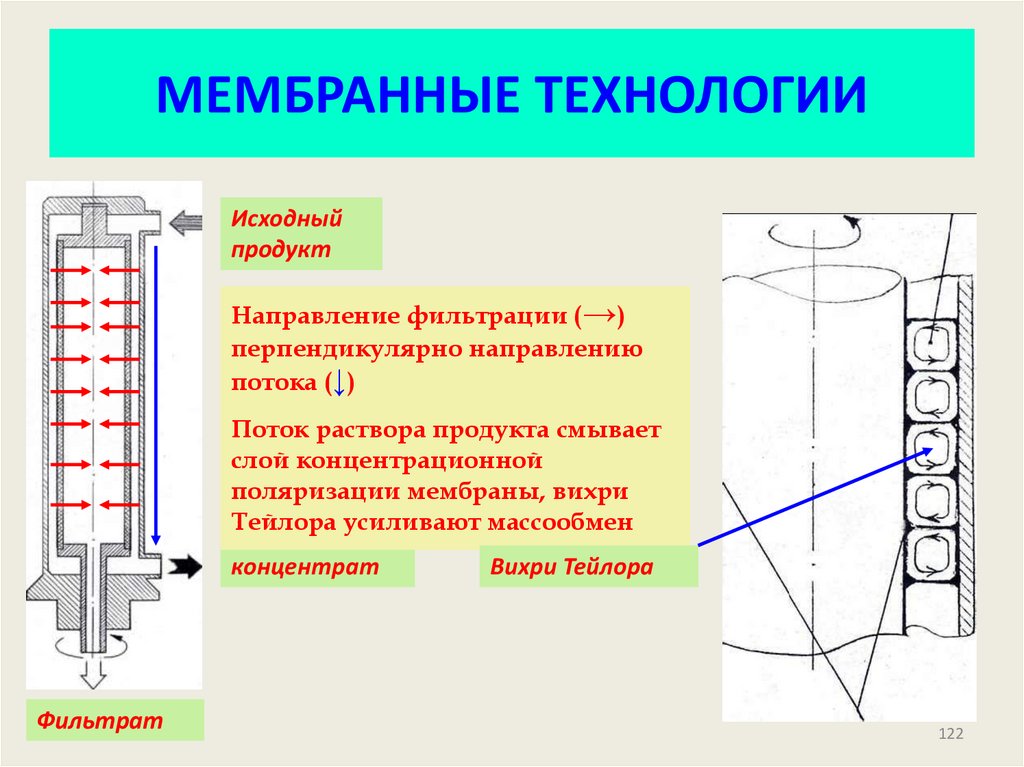






















 Химия
Химия








