Похожие презентации:
Характеристика химических элементов IV группы, главной подгруппы. Углерод
1. Характеристика химических элементов IVгруппы, главной подгруппы. УГЛЕРОД.
2.
Элементы IV группыГлавной подгруппы
Увеличивается размер
атома и электроположительность
Усиливаются
восстановительные
металлические
свойства
С
Si
Ge
Sn
Pb
Неметаллы
(не образуют свободных катионов в
растворах и расплавах)
Металлы
Обладают кислотообразующими
свойствами
3.
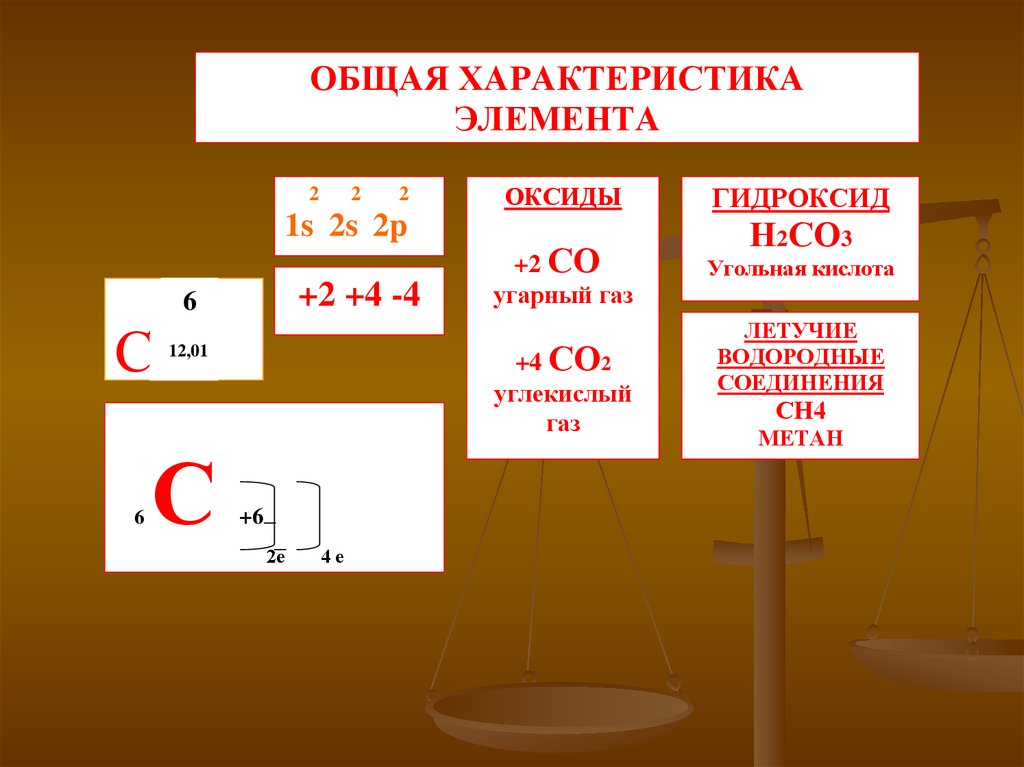
ОБЩАЯ ХАРАКТЕРИСТИКАЭЛЕМЕНТА
2
2
2
1s 2s 2p
+2 +4 -4
6
С
6
+2 СО
угарный газ
+4 СО2
углекислый
газ
12,01
С
ОКСИДЫ
+6
2е
4е
ГИДРОКСИД
Н2СО3
Угольная кислота
ЛЕТУЧИЕ
ВОДОРОДНЫЕ
СОЕДИНЕНИЯ
СН4
МЕТАН
4.
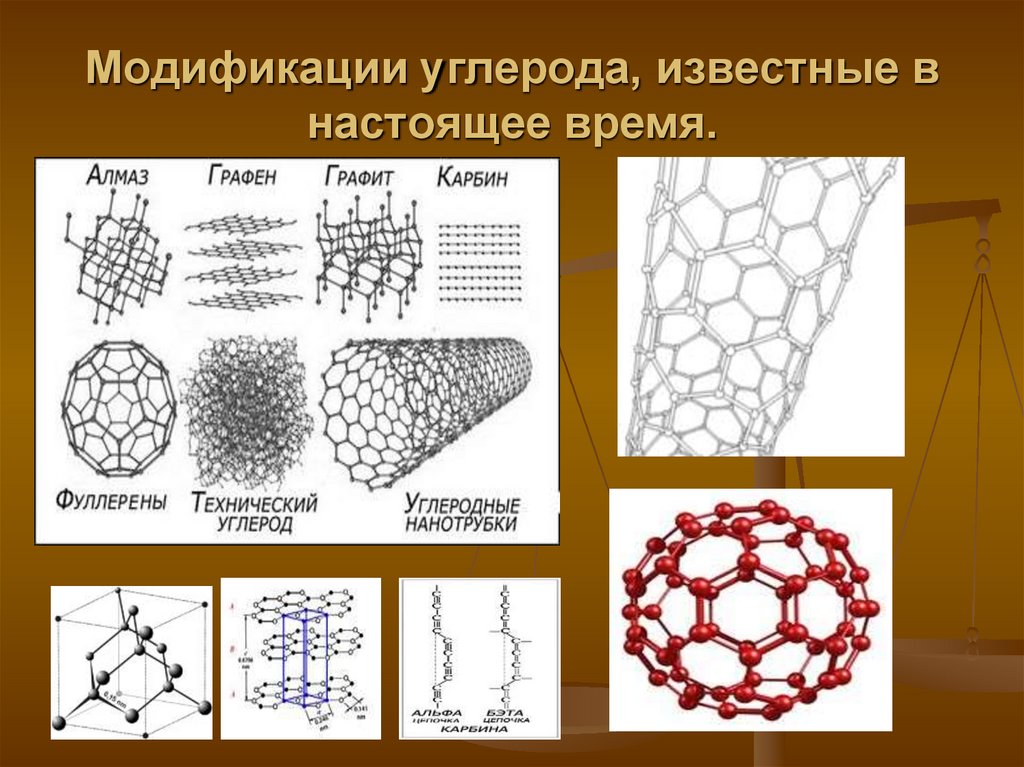
УГЛЕРОД САллотропные модификации
АЛМАЗ
Sp 3-гибридизация,
тетраидрические сигма связи,
прочные ковалентные
неполярные связи.
Бесцветное кристаллическое
вещество очень твердое, плохо
проводит тепло, не проводит
электрический ток.
ГРАФИТ
КАРБИН
Sp 2-гибридизация, слоистая
Sp-гибридизация,
структура, непрочные связи
между слоями.
Темно-серое кристаллическое
вещество со слабым
металлическим блеском, жирное
на ощупь, тугоплавкое, проводит
электрический ток.
линейный полимер.
Мелкий кристаллический
порошок черного цвета,
более твердый, чем графит,
полупроводник.
5.
ХИМИЧЕСКИЕ СВОЙСТВАУГЛЕРОДА
С- ОКИСЛИТЕЛЬ
1. 4Al + 3C=Al4C3
( Карбид алюминия)
2. CaO + 2C=CO2 +CaC2
( Карбид кальция)
С- ВОССТАНОВИТЕЛЬ
1. C+ O2=CO2 (ниже 500 градусов)
2C+ O2=2CO2 (выше 900 градусов)
2. C+H2O=CO+H2 (выше 1200 градусов)
C+ 2H2O=CO2+ 2H2 (ниже 1200
градусов)
3. Ca+2C= CaC2
4. 2H2 + C=CH4
( Метан)
3. C+ 2ZnO=2Zn+ CO2 (Cu, Fe, Pb…)
4. 3C+ 4HNO3=3CO2+4NO+2H2O
6.
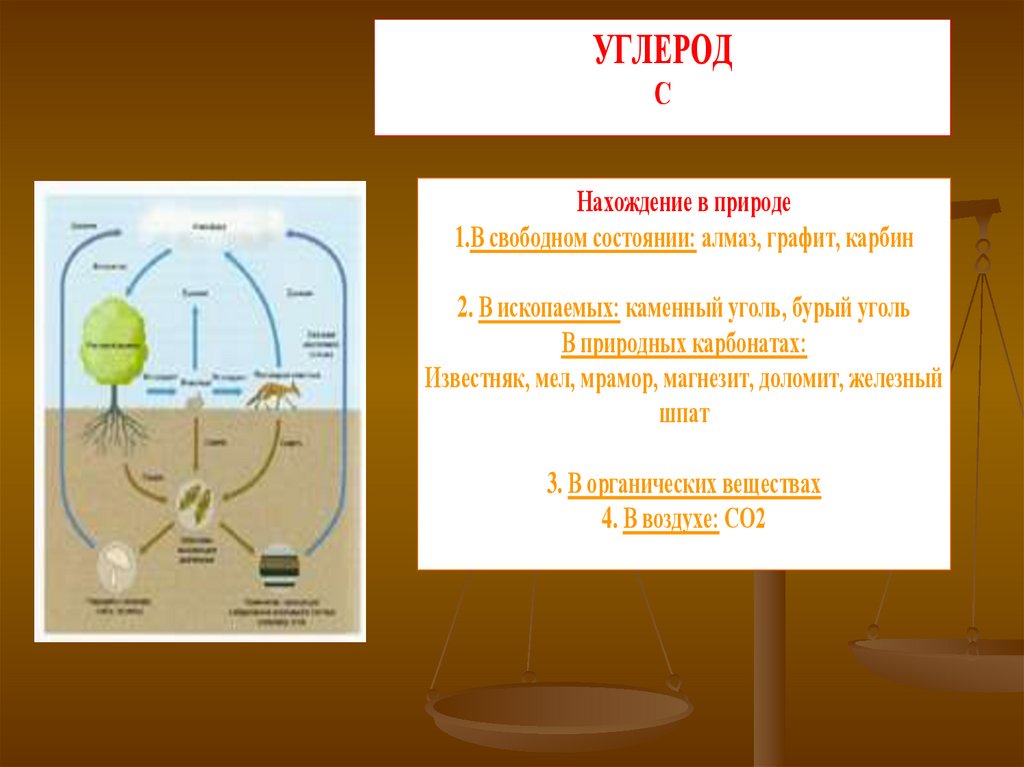
УГЛЕРОДС
Нахождение в природе
1.В свободном состоянии: алмаз, графит, карбин
2. В ископаемых: каменный уголь, бурый уголь
В природных карбонатах:
Известняк, мел, мрамор, магнезит, доломит, железный
шпат
3. В органических веществах
4. В воздухе: СО2
7.
ОКСИДЫ УГЛЕРОДАСО – несолеобразующий
получение:
В промышленности
СО2- кислотный
Получение:
В промышленности
CaCO3=CaO+CO2
СО2+С=2СО
В лаборатории
В лаборатории
CaCO3+2HCl= CaCl2+CO2+H2O
НСООН=Н2О+ СО
Физические свойства
Газ, без цвета, без запаха, очень ядовит
(соединяется с гемоглобином крови),
плохо растворим в воде.
Химические свойства
СО - восстановитель.
СО+СuО=Cu+ CO2
2CO+ O2=2CO2
H=-572 кДж
(горит, синим пламенем)
Физические свойства
Бесцветный газ, тяжелее воздуха, не
поддерживает дыхание, растворим в
воде, при t=-76 сухой лед.
Химические свойства
1. Кислотный оксид:
CO2+H2O=H2CO3
2CO2+ 2NaOH=Na2CO3+H2O
2. Окислитель:
CO2+C=2CO
CO2+Mg=MgO+C
8.
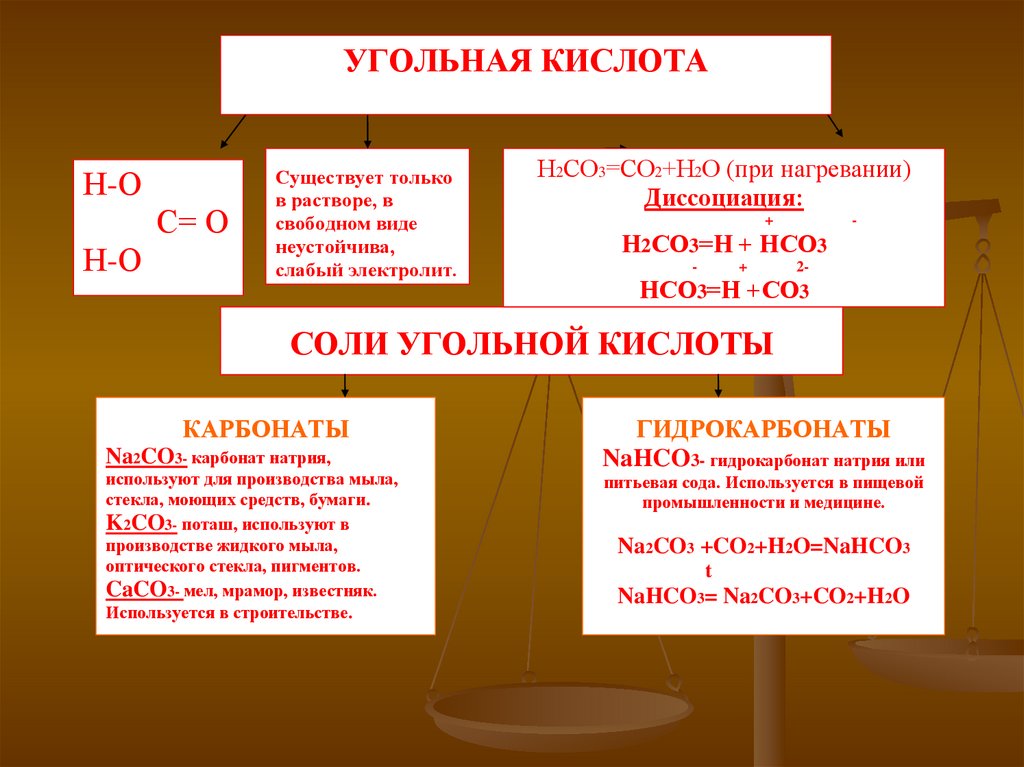
УГОЛЬНАЯ КИСЛОТАН-О
С= О
Н-О
Существует только
в растворе, в
свободном виде
неустойчива,
слабый электролит.
Н2СО3=СО2+Н2О (при нагревании)
Диссоциация:
+
-
Н2СО3=Н + НСО3
-
+
2-
НСО3=Н +СО3
СОЛИ УГОЛЬНОЙ КИСЛОТЫ
КАРБОНАТЫ
Na2CO3- карбонат натрия,
используют для производства мыла,
стекла, моющих средств, бумаги.
K2CO3- поташ, используют в
производстве жидкого мыла,
оптического стекла, пигментов.
CaCO3- мел, мрамор, известняк.
Используется в строительстве.
ГИДРОКАРБОНАТЫ
NaHCO3- гидрокарбонат натрия или
питьевая сода. Используется в пищевой
промышленности и медицине.
Na2CO3 +CO2+H2O=NaHCO3
t
NaHCO3= Na2CO3+CO2+H2O





 Химия
Химия








