Похожие презентации:
Расчеты по химическим уравнениям
1.
РАСЧЕТЫпо химическим
уравнениям
2.
Цель: научиться вестирасчеты по уравнению
химической реакции, зная
количество вещества, массу
или объем одного из исходных
веществ или продуктов
реакции.
3.
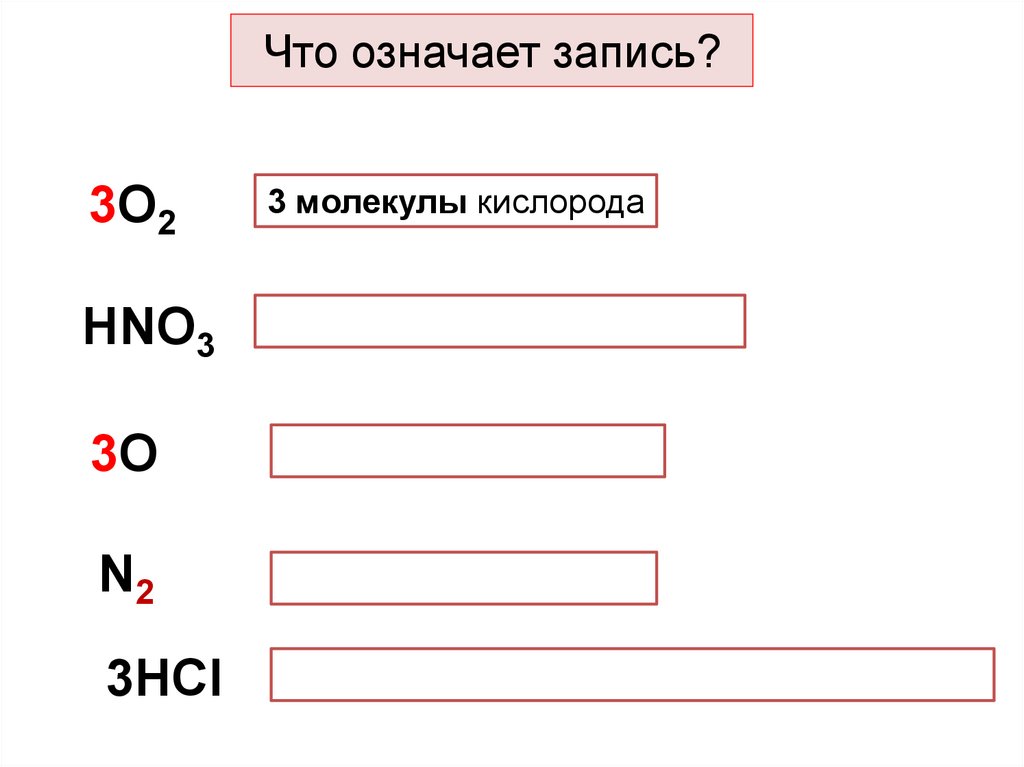
Что означает запись?3О2
НNО3
3О
N2
3НСl
3 молекулы кислорода
4.
Что означает запись?3О2
3 молекулы кислорода
НNО3
1 молекула азотной кислоты
3О
3 атома кислорода
N2
1 молекула азота
3НСl
3 молекулы хлороводородной кислоты
5.
Уравнения химических реакций.Уравнение химической реакции – это условная запись химической
реакции, с помощью химических формул и коэффициентов.
Пример:
N2 + 3H
H22
t0C кат.
2NH
NH3
-реагирующие вещества (исходные, потребовались)
- продукты реакции (образуется, выделяется)
- взаимодействие (вступили в реакцию)
- условие протекания реакции
6.
Составьте схему уравнение1. Углерод реагирует с кислородом с образованием оксида
углерода (IV).
С + О2
СО2
2. При взаимодействии форфора с кислородом образуется
оксид фосфора (V).
4Р
+ О2
10 : 2 = 5
Р2О5
10
10 : 5 = 2
3. При обжиге карбоната кальция образуется оксид кальция и
оксид углерода (IV).
СаСО3
СаО + СО2
7.
Определитекоэффициенты
1) 2 Na + Сl2 → NaСl ;
2:2=1
2:1= 2
2
2) 2 Аl +
S → Аl2S3;
3 : 1 =3
3
3) NН3 → N2 + Н2 ;
6: 3 = 2
6
6 : 2 =3
4) 2 Р +
Сl2 →
РСl3 ;
6 : 2 =3
6
6 : 3 =2
5) Н2О→ 2 Н2 + О2 ;
2
2 : 1 =2
6) ZnО + НСl → ZnСl2 + Н2О;
2 : 1 =2
2
8.
Самостоятельная работаОпределите коэффициенты
Вариант I.
1) СН4 → С + Н2 ;
2) Н2 + О2 → Н2О ;
3) Zn + НСl → ZnСl2 + Н2
4) Са + О2 → СаО
5) Fe + О2 → Fe 3О4
Вариант II.
10
90
8
7
6
5
4
3
2
1
1) Р + Сl2 → РСl3
2) Zn + O2 → ZnO
3) РbО + С → СО2 + Рb
4) Cа + НСl → СаСl2 + Н2
5) НgО → Нg + О2
9.
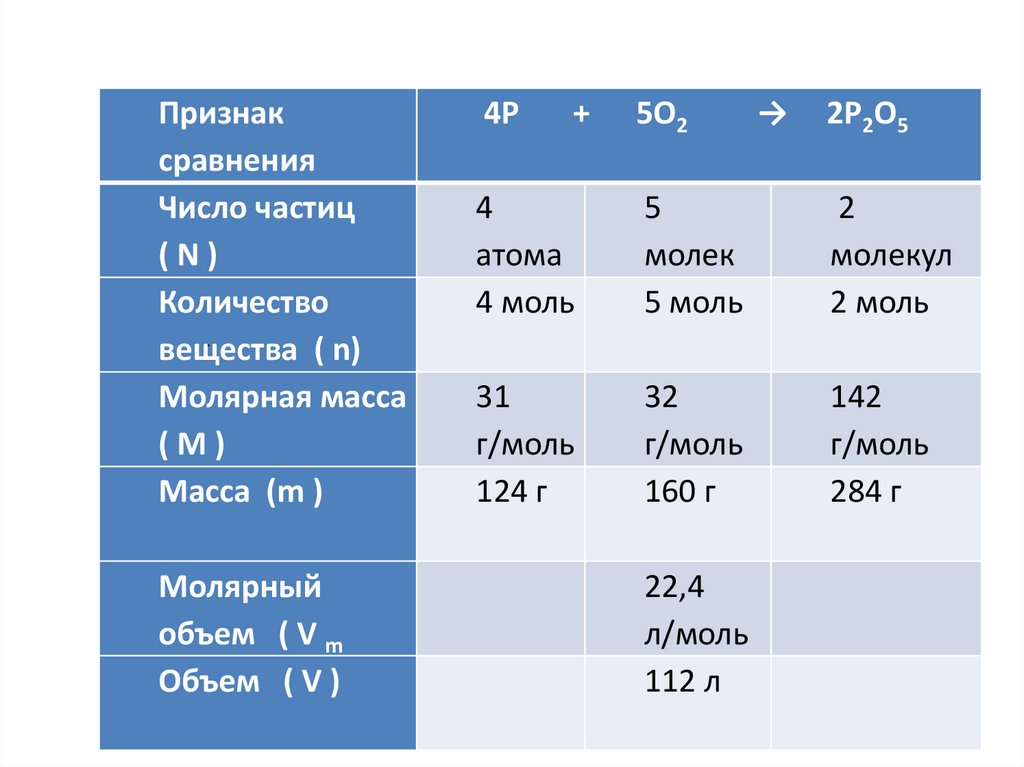
Признаксравнения
Число частиц
(N)
Количество
.
вещества
( n)
Молярная масса
(M)
Масса (m )
Молярный
объем ( V m
Объем ( V )
4Р
+
5О2
→
2Р2О5
4
атома
4 моль
5
молек
5 моль
2
молекул
2 моль
31
г/моль
124 г
32
г/моль
160 г
142
г/моль
284 г
22,4
л/моль
112 л
10.
Условие. Вычислите количество вещества кислорода,необходимое для получения 4 моль оксида фосфора.
Решение:
Дано:
n(P2О5) =4 моль
n (О2) = ?
x моль 4 моль
4P + 5 О2 = 2 P2О5
5 моль 2 моль
Пропорция:
x
4 моль
5 моль
=
2 моль
x·2 = 5·4
x = 10 моль О2
Ответ: n(О2) = 10 моль
11.
Алгоритм решения задач• Написать уравнение реакции
• Найденное количество вещества переводим в
нужную характеристику искомого участника
реакции (массу, объем, или число молекул).
• Если количество вещества неизвестно,
предварительно найти его по известной массе,
или объему, или числу молекул.
• По известному количеству вещества одного
вещества реакции рассчитать количество
другого вещества
12.
АЛГОРИТМ РЕШЕНИЯ ЗАДАЧm
V
x
m
VN
n
?
x
=
nx
Nx
13.
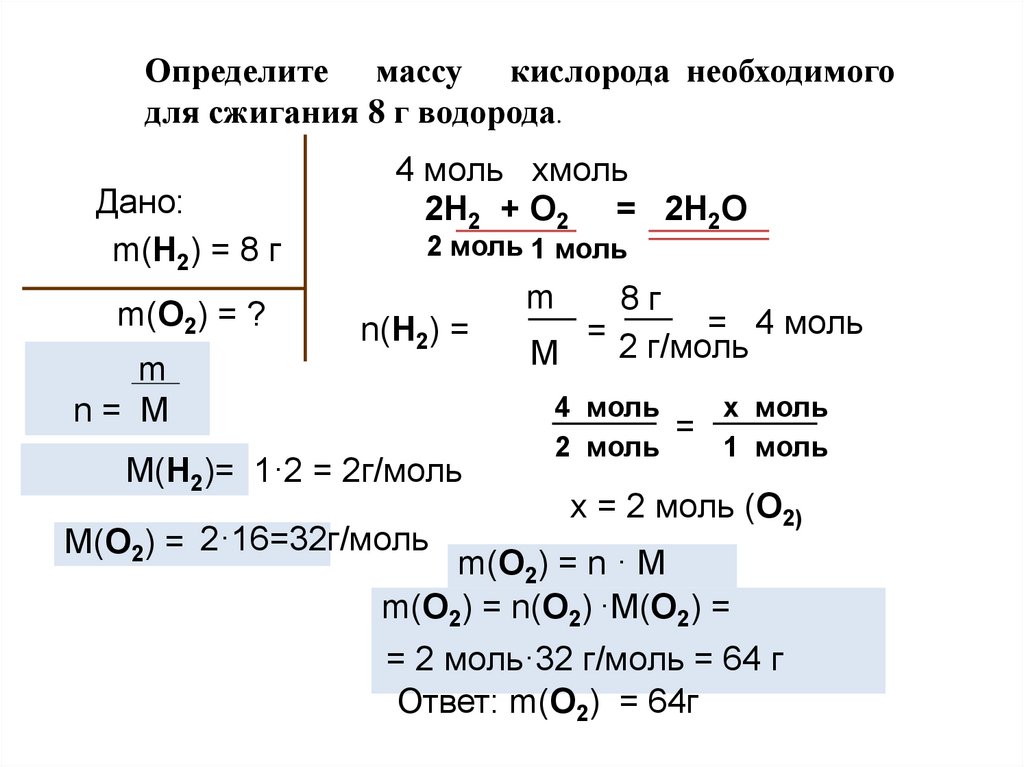
Определите массу кислорода необходимогодля сжигания 8 г водорода.
Дано:
m(H2) = 8 г
m(О2) = ?
4 моль хмоль
2H2 + О2 = 2H2O
2 моль 1 моль
8г
= 4 моль
= 2 г/моль
M
m
n(H2) =
m
n= М
M(Н2)= 1·2 = 2г/моль
M(О2) = 2·16=32г/моль
4 моль
х моль
=
2 моль
1 моль
х = 2 моль (О2)
m(О2) = n · M
m(О2) = n(О2) ·M(О2) =
= 2 моль·32 г/моль = 64 г
Ответ: m(О2) = 64г
14.
Какой объем кислорода (н.у.) образуется при разложении120 г оксида магния.
x моль
Дано:
2 MgO = 2 Mg + O2↑
m(MgO) = 120 г
2 моль
1 моль
V(O2) = ?
m
120 г
n(MgO) =
= 3 моль
=
M(MgO) = 24+16 =
M
40 г/моль
= 40 г/моль
3 моль х моль
=
2 моль 1 моль
Vm = 22,4 л/моль
х = 1,5 моль O2
V(O2) = n · Vm
V(O2) = n(O2)·Vm = 0,15 моль· 22,4 л/моль =3,36 г
Ответ: V(O2) = 3,36 л
15.
САМОСТОЯТЕЛЬНАЯ РАБОТА:ВАРИАНТ 1:
1. Вычислите массу меди, которая образуется при
взаимодействии 4 г водорода с оксида меди (II).
CuO + H2 = Cu + H2O
2 моль
2. Составьте условие и решите:
Са
+
O2
х моль
=
СаО
ВАРИАНТ 2:
1. В реакцию с серной кислотой вступило 20 г гидроксида
натрия. Рассчитайте массу образовавшейся соли сульфата
натрия.
2NaOH + H2SO4 = Na2SO4 + 2H2O
2. Составьте условие и решите: Мg
2 моль
+ O2
х моль
= МgО
16.
§ 28, с.160-166,упр. 2,3.













 Химия
Химия








