Похожие презентации:
Химия. Рабочая программа. Вводный курс (7 класс)
1.
Муниципальное бюджетное общеобразовательноеучреждение города Абакана
"Средняя общеобразовательная школа № 24"
СОГЛАСОВАНО
на заседании МО естественнонаучного цикла
Протокол №1 от 31 августа 2016 года
УТВЕРЖДЕНО
Приказом директора МБОУ «СОШ № 24»
от 31 августа 2016 года №137
РАБОЧАЯ ПРОГРАММА
Предмет: Химия. Вводный курс
Класс: 7
Учитель: Осетрова Светлана Александровна
Ф.И.О.
2016 – 2017 учебный год
2.
Пояснительная запискаРабочая программа пропедевтического курса «Химия. Вводный курс» предназначена для
обучающихся 7 класса.
Рабочая программа рассчитана на 35 учебных часов (1 час в неделю за счет школьного
компонента), в том числе для проведения контрольных работ – 2 часа, практических работ – 6
часов.
В рабочей программе отражены обязательный минимум содержания основных
образовательных программ, требования к уровню подготовки учащихся.
Изучение данного курса предусматривает широкое использование активных форм и
методов обучения: повышение роли самостоятельной работы учащихся в обучении (проведение
домашнего эксперимента лонгетюдного (продолжительного) характера), в том числе
подготовка сообщений для ученических конференций, защита проектов, обсуждение
результатов домашнего эксперимента.
Программа пропедевтического курса химии 7 класса предусматривает широкое развитие
таких логических операций мышления, как анализ и синтез, сравнение и обобщение,
выдвижение и подтверждение или опровержение гипотез.
При составлении рабочей программы в основную программу изменения не вносились,
так как 7-е классы являются общеобразовательными без углубленного изучения отдельных
предметов, уровень обученности детей средний.
Основные цели курса:
подготовить учащихся к изучению нового учебного предмета;
создать познавательную мотивацию к изучению нового предмета;
сформировать предметные знания, умения, навыки (в первую очередь расчетные
и экспериментальные), на которые недостаточно времени при изучении курса
химии основной школы;
показать яркие, занимательные, эмоционально насыщенные эпизоды становления
и развития науки химии;
интегрировать знания по предметам естественного цикла основной школы на
основе учебной дисциплины «Химия».
3.
Содержание тем учебного курса.Глава 1. Химия в центре естествознания (11 часов).
Химия как часть естествознания. Предмет химии
Химия – часть естествознания. Взаимоотношения человека и окружающего мира.
Предмет химии. Физические тела и вещества. Свойства веществ. Применение веществ на
основе их свойств.
Наблюдение и эксперимент как методы изучения естествознания и химии
Наблюдение как основной метод познания окружающего мира. Условия проведения
наблюдения гипотеза. Эксперимент. Вывод. Строение пламени. Лаборатория и оборудование.
Моделирование
Модель, моделирование. Особенности моделирования в географии, физике, биологии.
Модели в биологии. Муляжи. Модели в физике. Электрофорная машина. Географические
модели. Химические модели: предметные (модели атома, химических и промышленных
производств), знаковые, символьные (символы элементов, формулы веществ, уравнения
реакций).
Химические знаки и формулы
Химический элемент. Химические знаки. Их обозначение, произношение. Химические
формулы веществ. Простые и сложные вещества. Индексы и коэффициенты. Качественный и
количественный состав вещества.
Химия и физика
Универсальный характер положений молекулярно – кинетической теории. Понятия
«атом», «молекула», «ион». Строение вещества. Кристаллическое состояние вещества.
Кристаллические решетки твердых веществ. Диффузия. Броуновское движение. Вещества
молекулярного и немолекулярного строения.
Агрегатные состояния вещества
Понятие об агрегатных состояниях вещества. Физические и химические явления.
Газообразные, жидкие и твердые вещества. Аморфные вещества.
Химия и география
Строение Земли: ядро, мантия, кора. Литосфера. Минералы и горные породы.
Магматические и осадочные (неорганические и органические, в том числе и горючие) породы.
Химия и биология
Химический состав живой клетки: неорганические (вода и минеральные соли) и
органические (белки, жиры, углеводы, витамины) вещества. Биологическая роль воды в живой
клетке. Фотосинтез. Хлорофилл. Биологическое значение жиров, белков, эфирных масел,
углеводов и витаминов для жизнедеятельности организмов.
Качественные реакции в химии
Качественные реакции. Распознавание веществ с помощью качественных реакций.
Аналитический сигнал. Определяемое вещество и реактив на него.
ДЕМОНСТРАЦИИ
Коллекции различных предметов или фотографий предметов из алюминия для
иллюстрации идеи «свойства – применение».
Учебное оборудование, используемое на уроках физики, биологии, географии,
химии.
Электрофорная машина в действии. Географические модели (глобус, карта).
Биологические модели (муляжи органов и систем органов растений, животных и
человека). Физические и химические модели атомов, молекул веществ и
кристаллических решеток.
Объѐмные и шаростержневые модели воды, углекислого и сернистого газов,
метана.
Образцы твердых веществ кристаллического строения. Модели кристаллических
решѐток.
4.
Вода в трех агрегатных состояниях. Коллекция кристаллических и аморфныхвеществ и изделий из них. Коллекция минералов (лазурит, корунд, халькопирит,
флюорит, галит).
Коллекция горных пород (гранит, различные формы кальцита – мел, мрамор,
известняк).
Коллекция горючих ископаемых (нефть, каменный уголь, сланцы, торф).
ДЕМОНСТРАЦИОННЫЕ ЭКСПЕРИМЕНТЫ
Научное наблюдение и его описание. Изучение строения пламени.
Спиртовая экстракция хлорофилла из зелѐных листьев растений.
«Переливание» углекислого газа в стакан на уравновешенных весах.
Качественная реакция на кислород. Качественная реакция на углекислый газ.
ЛАБОРАТОРНЫЕ ОПЫТЫ
Распространение запаха одеколона, духов или дезодоранта как процесс диффузии.
Наблюдение броуновского движения частичек черной туши под микроскопом.
Диффузия перманганата калия в желатине.
Обнаружение эфирных масел в апельсиновой кожуре.
Изучение гранита с помощью увеличительного стекла.
Определение содержания воды в растении.
Обнаружение масла в семенах подсолнечника и грецкого ореха.
Обнаружение крахмала в семенах пшеницы.
Взаимодействие аскорбиновой кислоты с йодом (определение витамина С в
различных соках).
Продувание выдыхаемого воздуха через известковую воду.
Обнаружение известковой воды среди различных веществ.
ДОМАШНИЕ ОПЫТЫ
Изготовление моделей молекул химических веществ из пластилина.
Диффузия сахара в воде.
Опыты с пустой пластиковой бутылкой.
Обнаружение крахмала в продуктах питания, яблоках.
ПРАКТИЧЕСКАЯ РАБОТА №1 «Знакомство с лабораторным оборудованием. Правила
техники безопасности».
ПРАКТИЧЕСКАЯ РАБОТА №2. «Наблюдение за горящей свечой. Устройство и работа
спиртовки».
Глава 2. Математика в химии (9 часов)
Относительные атомная и молекулярная массы
Относительная атомная масса элемента. Молекулярная масса. Определение
относительной атомной массы химических элементов по таблице Д.И. Менделеева.
Нахождение
относительной молекулярной массы по формуле вещества как суммы
относительных атомных масс, составляющих вещество химических элементов.
Массовая доля элемента в сложном веществе
Понятие о массовой доле химического элемента (ω) в сложном веществе и еѐ расчѐт по
формуле вещества.
Чистые вещества и смеси
Чистые вещества. Смеси. Гетерогенные и гомогенные смеси. Газообразные (воздух,
природный газ), жидкие (нефть), твердые смеси (горные породы, кулинарные смеси и
синтетические моющие средства).
Объѐмная доля газа в смеси
Определение объѐмной доли газа (φ) в смеси. Состав атмосферного воздуха и
природного газа. Расчѐт объѐма доли газа в смеси по его объѐму, и наоборот.
Массовая доля вещества в растворе
5.
Массовая доля вещества (ω) в растворе. Концентрация. Растворитель и растворѐнноевещество. Расчѐт массы растворѐнного вещества по массе раствора и массовой доле
растворѐнного вещества.
Массовая доля примесей
Понятие о чистом веществе и примеси. Массовая доля примеси (ω) в образце исходного
вещества. Основное вещество. Расчѐт массы основного вещества по массе вещества,
содержащего определѐнную массовую долю примесей.
ДЕМОНСТРАЦИИ
Коллекции различных видов мрамора и изделий (или иллюстраций изделий) из
него.
Смесь речного и сахарного песка и разделение их.
Коллекция нефти и нефтепродуктов.
Коллекция бытовых смесей (кулинарных смесей, СМС, шампуней, напитков и
др.).
Диаграмма состава атмосферного воздуха. Диаграмма состава природного газа.
Коллекция «Минералы и горные породы» (образцы веществ и материалов,
содержащих определѐнную долю примесей).
ДОМАШНИЕ ОПЫТЫ
Изучение состава некоторых бытовых и фармацевтических препаратов,
содержащих определѐнную долю примесей.
ПРАКТИЧЕСКАЯ РАБОТА №3 «Приготовление раствора с заданной массовой
долей растворенного вещества».
Глава 3. Явления, происходящие с веществами (11 часов)
Разделение смесей
Способы разделения смесей и очистка веществ. Некоторые простейшие способы
разделения смесей: просеивание смесей порошков железа и серы, отстаивание, декантация,
центрифугирование, разделение с помощью делительной воронки, фильтрование.
Фильтрование в лаборатории, быту и на производстве. Понятие о фильтрате. Адсорбция.
Понятие об адсорбции и адсорбентах. Активированный уголь как важнейший адсорбент.
Устройство противогаза.
Дистилляция, или перегонка
Дистилляция (перегонка) как процесс выделения веществ из жидкой смеси.
Дистиллированная вода и области еѐ применения.
Кристаллизация или выпаривание. Кристаллизация и выпаривание в лаборатории
(кристаллизаторы и фарфоровые чашки для выпаривания) и в природе.
Перегонка нефти. Нефтепродукты. Фракционная перегонка жидкого воздуха
Химические реакции. Условия протекания и прекращения химических реакций
Химические реакции как процесс превращения одних веществ в другие. Условия
протекания и прекращения химических реакций. Соприкосновение (контакт) веществ,
нагревание. Катализатор. Ингибитор. Управление реакциями горения.
Признаки химических реакций
Признаки химических реакций: изменение цвета, образование осадка, растворение
полученного осадка, выделение газа, появление запаха, выделение или поглощение теплоты.
ДЕМОНСТРАЦИИ
Фильтр Шота. Воронка Бюхнера. Установка для фильтрования под вакуумом.
Респираторные маски и марлевые повязки.
Противогаз и его устройство.
Коллекция «Нефть и нефтепродукты»
ДЕМОНСТРАЦИОННЫЕ ЭКСПЕРИМЕНТЫ
Разделение смеси порошка серы и железных опилок.
Разделение смеси порошка серы и песка.
Разделение смеси воды и растительного масла с помощью делительной воронки.
6.
Получение дистиллированной воды с помощью лабораторной установки дляперегонки жидкостей.
Разделение смеси перманганата и дихромата калия способом кристаллизации.
Взаимодействие порошков железа и серы при нагревании.
Получение углекислого газа взаимодействием мрамора с кислотой и обнаружение
его с помощью известковой воды.
Каталитическое разложение пероксида водорода.
Обнаружение раствора щѐлочи с помощью индикатора.
Взаимодействие раствора перманганата калия и раствора бихромата калия с
раствором сульфита натрия.
Взаимодействие раствора перманганата калия с аскорбиновой кислотой.
Взаимодействие раствора хлорида железа с жѐлтой кровяной солью и гидроксидом
натрия.
Взаимодействие раствора хлорида железа (III) с раствором соляной кислоты.
ЛАБОРАТОРНЫЕ ОПЫТЫ
Адсорбция кукурузными палочками паров пахучих веществ.
Изучение устройства зажигалки и пламени.
ДОМАШНИЕ ОПЫТЫ
Разделение смеси сухого молока и речного песка.
Отстаивание взвеси порошка для чистки посуды в воде и ее декантация.
Адсорбция активированным углем красящих веществ пепси-колы.
Растворение в воде таблетки УПСА.
Приготовление известковой воды и опыты с ней.
Изучение состава и применения синтетических моющих средств, содержащих
энзимы.
ПРАКТИЧЕСКАЯ РАБОТА №4 «Выращивание кристаллов соли (домашний
эксперимент)».
ПРАКТИЧЕСКАЯ РАБОТА №5 «Очистка поваренной соли».
ПРАКТИЧЕСКАЯ РАБОТА №6 «Изучение процесса коррозии железа (домашний
эксперимент)».
Глава 4. Рассказы по химии (3 часа)
Ученическая конференция
«Выдающиеся русские учѐные – химики» «О жизни и деятельности М.В. Ломоносова,
Д.И. Менделеева, А.М. Бутлерова, других отечественных и зарубежных ученых (по выбору
учащихс)».
Конкурс сочинений учащихся
«Моѐ любимое химическое вещество» (об открытии, получении и значении выбранного
химического вещества).
Конкурс ученических проектов
Посвящен изучению химических реакций.
Учебно-методический комплекс
1. О.С. Габриелян, А.К. Ахлебин - «Химия. Вводный курс».
2. О.С. Габриелян, Г.А.Шипарѐва - «Методическое пособие к пропедевтическому курсу
«Химия. Вводный курс. 7 класс».
3. О.С. Габриелян, Г.А. Шипарѐва - «Химия. Рабочая тетрадь. 7 класс».
4. О.С. Габриелян, И.В. Аксенова – Химия. 7 класс. Практикум».
7.
Тематическое планирование пропедевтического курса «Химия. Вводный курс» по УМК О.С. Габриеляна7 класс (1 час в неделю)
№
Тема урока
1
Химия
как
естествознания.
химии.
2
Методы
естествознания
3
4.
5
6
7
8
Изучаемые вопросы
Экспер
имент
Тема 1. Химия в центре естествознания (11 часов)
часть Естествознание – комплекс наук о природе. Науки о
Предмет природе: физика, химия, биология, география. + и –
воздействие человека на природу. Предмет химии.
Вещества и тела. Свойства веществ.
изучения Наблюдение. Эксперимент. Способы фиксирования
результатов. Строение пламени свечи
Д.1,2 .
Л.о.1
П.1
с.10,в.6(п)
Д.3
Л.О.2.
П.2
Отчет
опыту
Практическая
работа
№1 ТБ!
«знакомство с лабораторным
оборудованием»
Практическая
работа
№2 ТБ!
«Наблюдение
за
горящей
свечой».
Моделирование.
Модели как абстрактные копии изучаемых объектов. Д.4-7
Модели химии: материальные (модель атома, крист.
решетки, аппаратов, установок) и знаковые (символы,
формулы, уравнения).
Химическая символика
Химические
знаки
и
формулы:
написание, Д.8.
произношение, информация, в них заключенная.
.
Химия
и
физика.
Универсальный
характер
положений о МКТ.
Химия и физика. Агрегатное
состояние вещества.
9
Химия и география.
10
Химия и биология.
Атом, молекула, ион. Кристаллическое состояние Д.9-11.
вещества. Диффузия. Броуновское движение.
Л.О.3.
Агрегатное состояние вещества. Кристаллические и
аморфные вещества. Физические и химические
явления.
Геологическое
строение
планеты
Земля.
Элементарный состав геологических составных частей
планеты. Минералы и горные породы. Магматические
и осадочные (органические и неорганические, в том
числе и горючие) породы.
Химический состав живой клетки. Фотосинтез.
Биологическое значение белков, жиров, углеводов,
Д/з
Д.12-14.
Контроль
Примечание
ИКТ
по
Отчет по п.р.
Отчет по п.р.
П.3
с/р по
С.28, в.5,6(п) понятиям
П.4
Табл.2
Дом.Э.1.
П.5
Дом.Э.2-4.
Д.15-17.
Л.О.4.
П.6
С.37, в.6(п)
Дом.Э.5.
П.7
С.45, в.1-7
Д.18,19.
Л.О.5-7.
П.8
С.51, в.1-9
Диктант
символам
по ИКТ
8.
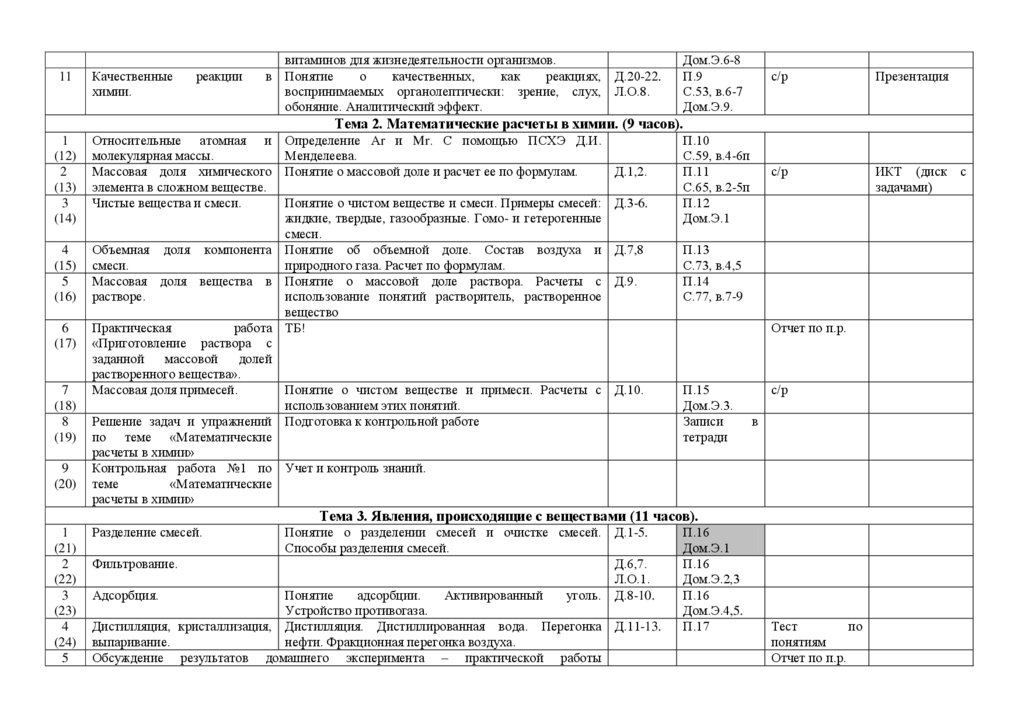
11Качественные
химии.
реакции
витаминов для жизнедеятельности организмов.
в Понятие
о
качественных,
как
реакциях, Д.20-22.
воспринимаемых органолептически: зрение, слух, Л.О.8.
обоняние. Аналитический эффект.
Дом.Э.6-8
П.9
С.53, в.6-7
Дом.Э.9.
с/р
Презентация
с/р
ИКТ (диск
задачами)
Тема 2. Математические расчеты в химии. (9 часов).
1
(12)
2
(13)
3
(14)
4
(15)
5
(16)
6
(17)
7
(18)
8
(19)
9
(20)
Относительные атомная и
молекулярная массы.
Массовая доля химического
элемента в сложном веществе.
Чистые вещества и смеси.
Определение Аr и Mr. С помощью ПСХЭ Д.И.
Менделеева.
Понятие о массовой доле и расчет ее по формулам.
Д.1,2.
Понятие о чистом веществе и смеси. Примеры смесей: Д.3-6.
жидкие, твердые, газообразные. Гомо- и гетерогенные
смеси.
Объемная доля компонента Понятие об объемной доле. Состав воздуха и Д.7,8
смеси.
природного газа. Расчет по формулам.
Массовая доля вещества в Понятие о массовой доле раствора. Расчеты с Д.9.
растворе.
использование понятий растворитель, растворенное
вещество
Практическая
работа ТБ!
«Приготовление раствора с
заданной
массовой
долей
растворенного вещества».
Массовая доля примесей.
Понятие о чистом веществе и примеси. Расчеты с Д.10.
использованием этих понятий.
Решение задач и упражнений Подготовка к контрольной работе
по теме «Математические
расчеты в химии»
Контрольная работа №1 по Учет и контроль знаний.
теме
«Математические
расчеты в химии»
П.10
С.59, в.4-6п
П.11
С.65, в.2-5п
П.12
Дом.Э.1
П.13
С.73, в.4,5
П.14
С.77, в.7-9
Отчет по п.р.
П.15
Дом.Э.3.
Записи
тетради
с/р
в
Тема 3. Явления, происходящие с веществами (11 часов).
1
(21)
2
(22)
3
(23)
4
(24)
5
Разделение смесей.
Понятие о разделении смесей и очистке смесей. Д.1-5.
Способы разделения смесей.
Фильтрование.
Д.6,7.
Л.О.1.
Адсорбция.
Понятие
адсорбции.
Активированный
уголь. Д.8-10.
Устройство противогаза.
Дистилляция, кристаллизация, Дистилляция. Дистиллированная вода. Перегонка Д.11-13.
выпаривание.
нефти. Фракционная перегонка воздуха.
Обсуждение результатов домашнего эксперимента – практической работы
П.16
Дом.Э.1
П.16
Дом.Э.2,3
П.16
Дом.Э.4,5.
П.17
Тест
по
понятиям
Отчет по п.р.
с
9.
(25)6
(26)
7
(27)
8
(28)
9
(29)
10
(30)
11
(31)
«Выращивание кристаллов соли». Подведение итогов конкурса на самый лучший
кристалл.
Практическая
работа
№5 ТБ!
«Очистка поваренной соли».
Химические реакции.
Понятие о химической реакции как о процессе Д.14-18.
превращения одних веществ в другие. Условия
течения и прекращения реакций.
Признаки
химических
Д.19-23.
реакций.
Л.О.2.
Обсуждение результатов домашнего эксперимента – практической работы №6
«Коррозия металлов».подведение итогов конкурса на лучшее проведение домашнего
эксперимента по теме исследования.
Обобщение и актуализация Подготовка к контрольной работе.
знаний по теме
Контрольная работа №1 по Учет и контроль знаний.
теме «Явления, происходящие
с веществами»
Отчет по п.р.
П.18
Дом.Э.6
П.19
Дом.7-10.
Отчет по п.р.
к/р
Тема 4. Рассказы по химии (3 часа).
1-2
(3233)
3
(34)
4
(35)
Ученическая конференция «Выдающиеся русские ученые-химики»
Презентация
Конкурс сообщений «Мое любимое вещество»
Реферат
Конкурс ученических проектов
Защита
проектов
10.
Приложение.Перечень демонстрационных, лабораторных опытов, домашних экспериментов.
Тема 1.
Демонстрации.
1. Коллекции разных тел из одного материала (например,
лабораторная посуда из стекла).
2. Коллекция разных тел или фотографий тел из алюминия для
иллюстрации идей «свойство – применение».
3. Учебное оборудование, используемое при изучении физики,
биологии, географии, химии.
4. Электрофорная машина в действии.
5. Географические модели (глобус, карта).
6. Биологические модели (муляжи органов и систем органов
растение, животных, человека).
7. Физические и химические модели атомов, молекул веществ и их
кристаллических решеток.
8. Объемные и шаростержневые модели молекул воды,
углекислого и сернистого газов, метана.
9. Распространение запаха одеколона, духов или дезодоранта как
процесс диффузии.
10. Образцы твердых веществ кристаллического строения.
11. Модели кристаллических решеток.
Лабораторные опыты.
1. Описание свойств кислорода, уксусной кислоты, алюминия.
2. Строение пламени свечи (спиртовки, сухого горючего).
3. Наблюдение броуновского движения частичек черной туши
под микроскопом.
4. Изучение гранита с помощью увеличительного стекла.
5. Обнаружение жира в семенах подсолнечника и грецкого
ореха.
Домашний эксперимент.
1. Изготовление моделей молекул из пластилина.
12. Три агрегатных состояния воды.
13. Переливание углекислого газа в стакан, уравновешенный на
весах.
14. Коллекция кристаллических и аморфных веществ и изделий из
них.
15. Коллекция минералов (лазурит, корунд, халькопирит,
флюорит, галит).
16. Коллекция горных пород (гранит, разные формы кальцита –
мел, мрамор, известняк).
17. Коллекция горучих ископаемых (нефть, каменный уголь,
горючие сланцы, торф).
18. Спиртовая экстракция хлорофилла из зеленых листьев.
19. Прокаливание сухой зелени в муфельной печи для
количественного определения минеральных веществ в них.
20. Качественная реакция на кислород.
21. Качественная реакция на углекислый газ.
22 Качественная реакция на известковую воду.
6. Обнаружение эфирных масел в апельсиновой кожуре.
7. Обнаружение крахмала и белка (клейковины) в пшеничной
муке.
8. Обнаружение углекислого газа в выдыхаемом воздухе с
помощью известковой воды.
2. Диффузия ионов перманганата калия в воде.
11.
Изучение скорости диффузии аэрозолей.7. Взаимодействие аскорбиновой кислоты с йодом.
Диффузия сахара в воде.
8. Изучение состава поливитаминов из домашней аптечки.
Опыты с пустой пластиковой бутылкой.
9. Обнаружение крахмала в продуктах питания.
Количественное определение содержание воды в свежей
зелени.
Практическая работа №1. Знакомство с лабораторным оборудованием. Правила безопасности при работе в химическом кабинете
(лаборатории).
Практическая работа №2. Наблюдение за горящей свечой. Устройство спиртовки. Правила работы с нагревательными приборами.
3.
4.
5.
6.
Тема 2.
Демонстрации.
1. Минералы куприт и тенорит.
7. Диаграмма объемного состава природного газа.
2. Оксид ртути (II).
8. Диаграмма объемного состава природного газа.
3. Коллекции различных видов мрамора и изделий (или
9. Приготовление раствора с заданной массой и массовой
иллюстраций изделий) из него.
долей растворенного вещества.
4. Смесь речного и сахарного песка и их разделение.
10. Образцы веществ и материалов, содержащих определенную
5. Коллекция «Нефть и нефтепродукты».
долю примесей.
6. Коллекция
бытовых
смесей
(кулинарные
смеси,
синтетические моющие средства, шампуни, напитки и др.).
Домашний эксперимент.
1. Изучение состава бытовых кулинарных и хозяйственных
3. Изучение состава некоторых бытовых и фармацевтических
смесей по этикеткам.
препаратов, содержащих определенную долю примесей, по
2. приготовление раствора соли, расчет массовой доли
их этикеткам.
растворенного вещества и опыты с полученным раствором.
Практическая работа №3. Приготовление раствора с заданной массовой долей растворенного вещества.
Тема 3.
Демонстрации.
1. Просеивание смеси муки и сахарного песка.
2. Разделение смеси порошков серы и железа.
3. Разделение смеси порошков серы и песка.
4. Разделение смеси воды и растительного масла с помощью
делительной воронки.
5. Центрифугирование.
Фильтрование.
Респираторные маски и марлевые повязки.
Адсорбционные свойства активированного угля.
Силикагель и его применение в быту и
промышленности.
10. Противогаз и его устройство.
6.
7.
8.
9.
легкой
12.
11. Получениедистиллированной
воды
с
помощью
18. Кислотный огнетушитель, его устройство и принцип
лабораторной установки для перегонки жидкостей.
действия.
12. Коллекция «Нефть и продукты ее перегонки».
19. Реакция окрашенного фенолфталеином раствора щелочи
13. Разделение смеси перманганата и дихромата калия
кислотой.
способом кристаллизации.
20. Взаимодействие растворов перманганата и дихромата калия
14. Взаимодействие порошков железа и серы при нагревании.
с раствором сульфита натрия.
15. Получение углекислого газа взаимодействием мрамора с
21. Получение осадка гидроксида меди (II) или железа (III)
кислотой и обнаружение его с помощью известковой воды.
реакцией обмена.
16. Каталитическое разложение пероксида водорода.
22. Растворение полученных осадков в кислоте.
17. Ферментативное разложение пероксида водорода с
23. Получение углекислого газа взаимодействием раствора
помощью каталазы.
карбоната натрия с кислотой.
Лабораторные опыты.
1. Изготовление фильтра из бумажной салфетки или фильтровальной бумаги.
2. Изучение устройства зажигалки и ее пламени.
Домашний эксперимент.
1. Разделение смеси сухого молока и речного песка.
6. Изучение состава и применения синтетических моющих
2. Изготовление
марлевой
повязки
как
средства
средств, содержащих энзимы.
индивидуальной защиты в период эпидемии гриппа.
7. Разложение смеси питьевой соды и сахарной пудры при
3. Отстаивание взвеси порошка для чистки посуды в воде и ее
нагреванию
декантация.
8. Растворение в воде таблетки УПСА.
4. Адсорбция активированным углем красящих веществ
9. Приготовление известковой воды и опыты с ней.
пепси-колы.
10. Взаимодействие
раствора
перманганата
калия
с
5. Адсорбция кукурузными палочками паров пахучих
аскорбиновой кислотой.
веществ.
Практическая работа №4 (домашний эксперимент). Выращивание кристаллов.
Практическая работа №5. Очистка поваренной соли.
Практическая работа №6 (домашний эксперимент). Коррозия металлов.











 Химия
Химия Образование
Образование





