Похожие презентации:
Группы и подгруппы
1.
ГРУППЫ ИПОДГРУППЫ
Учитель: Макаркина М.А.
2.
ВОПРОСЫ:1.
2.
3.
4.
5.
Периодический закон.
Период.
Как и почему изменяются свойства в периоде?
Физический смысл номера периода.
Группа.
ГРУППА - вертикальный ряд элементов
- номер группы показывает высшую валентность
элемента
3.
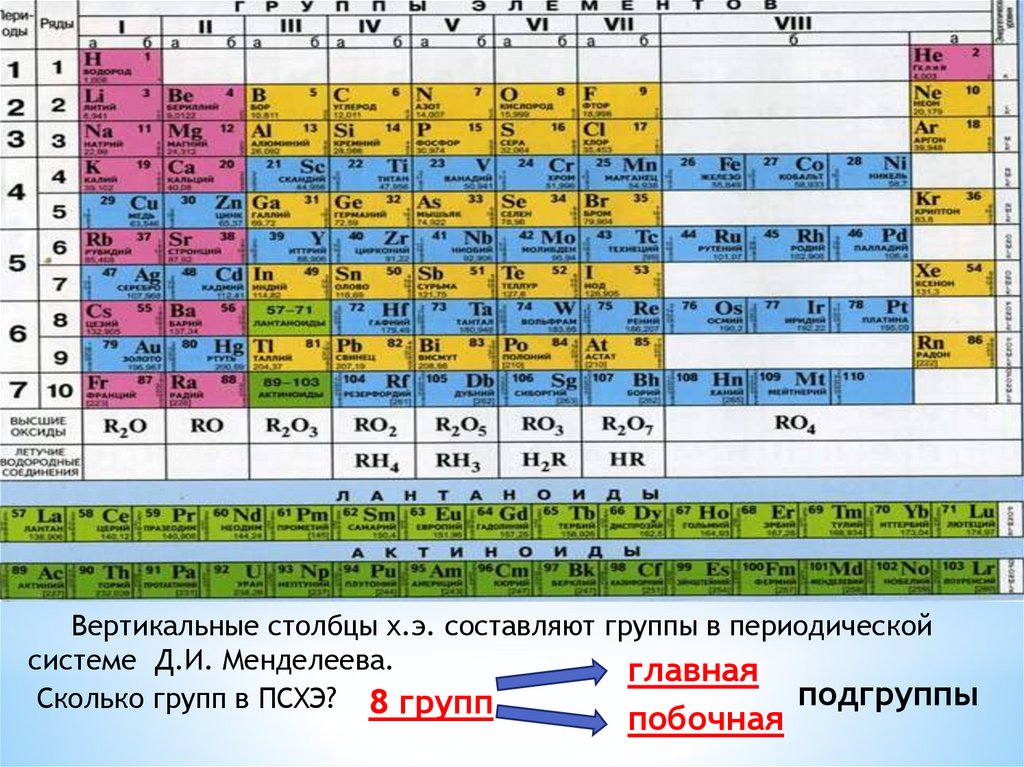
Вертикальные столбцы х.э. составляют группы в периодическойсистеме Д.И. Менделеева.
главная
подгруппы
Сколько групп в ПСХЭ? 8 групп
побочная
4.
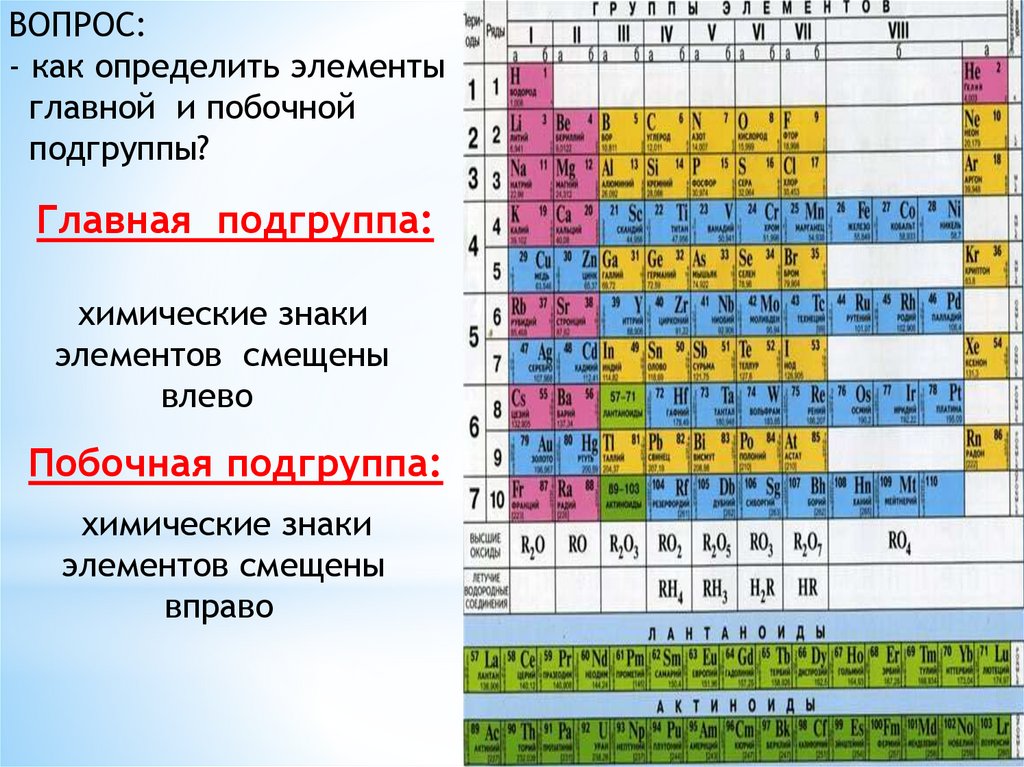
ВОПРОС:- как определить элементы
главной и побочной
подгруппы?
Главная подгруппа:
химические знаки
элементов смещены
влево
Побочная подгруппа:
химические знаки
элементов смещены
вправо
5.
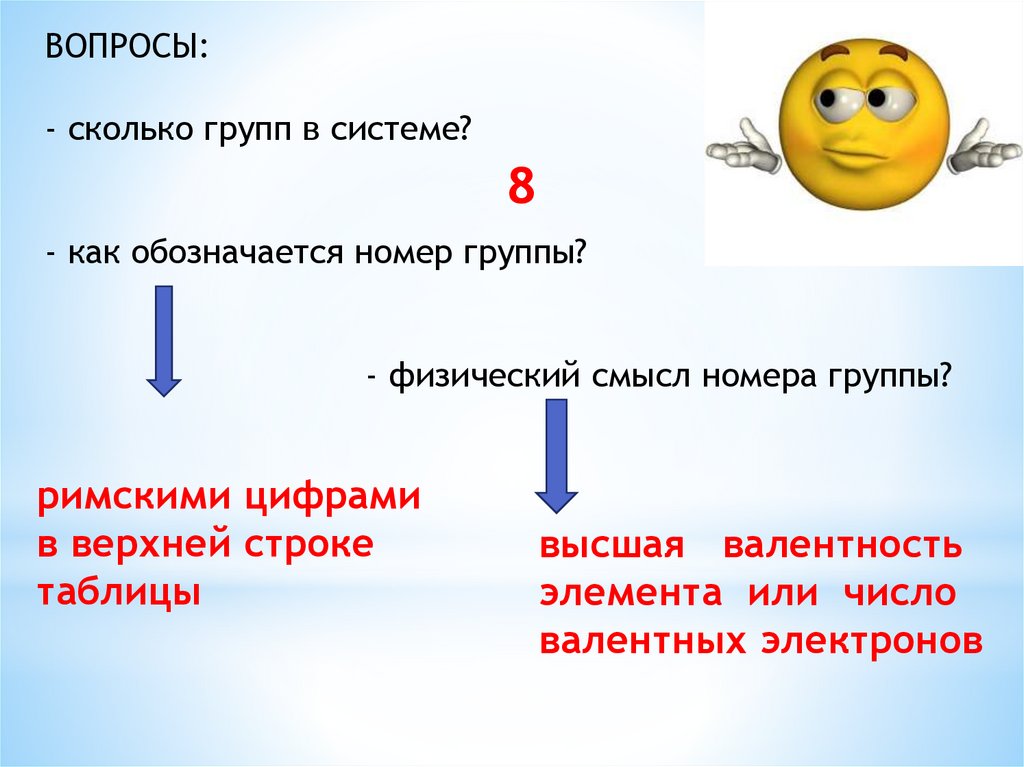
ВОПРОСЫ:- сколько групп в системе?
8
- как обозначается номер группы?
- физический смысл номера группы?
римскими цифрами
в верхней строке
таблицы
высшая валентность
элемента или число
валентных электронов
6.
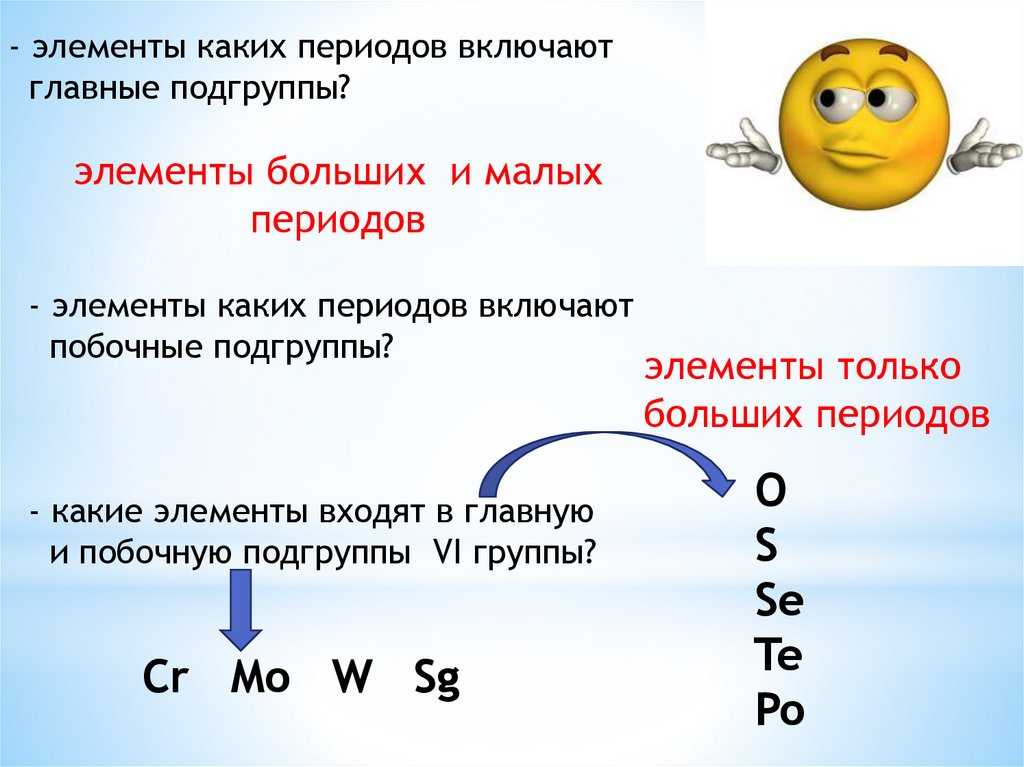
- элементы каких периодов включаютглавные подгруппы?
элементы больших и малых
периодов
- элементы каких периодов включают
побочные подгруппы?
- какие элементы входят в главную
и побочную подгруппы VI группы?
Cr Mo W Sg
элементы только
больших периодов
O
S
Se
Te
Po
7.
- --------------------------------------------------------------------------------------------------------------------------------------------------
8.
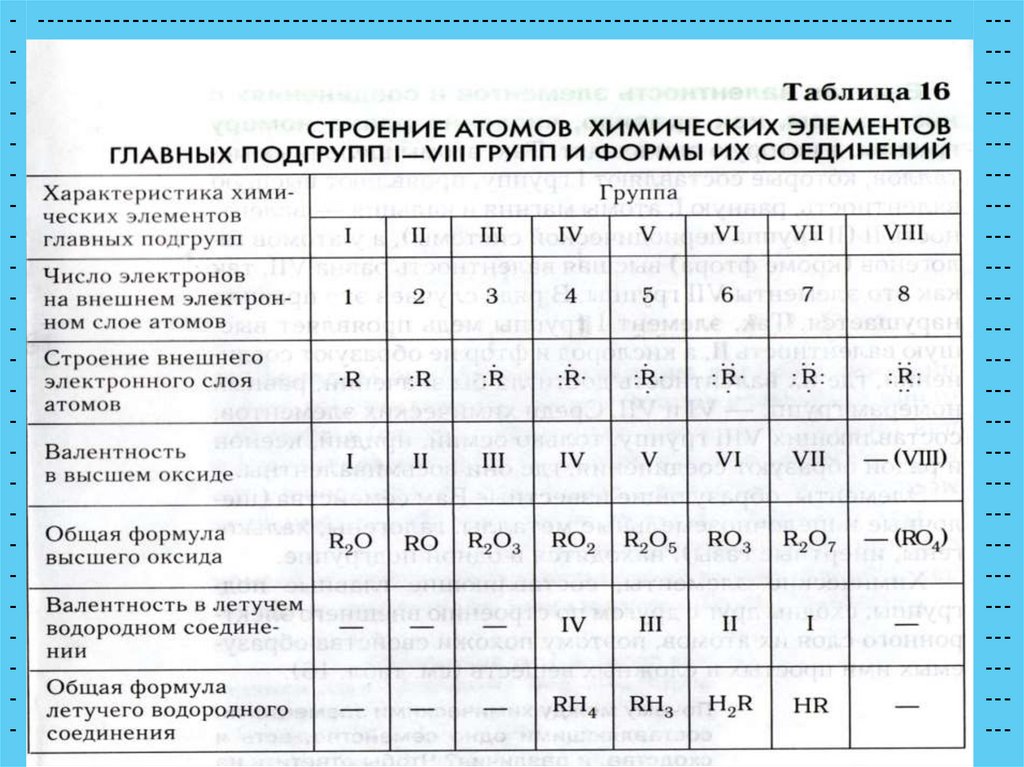
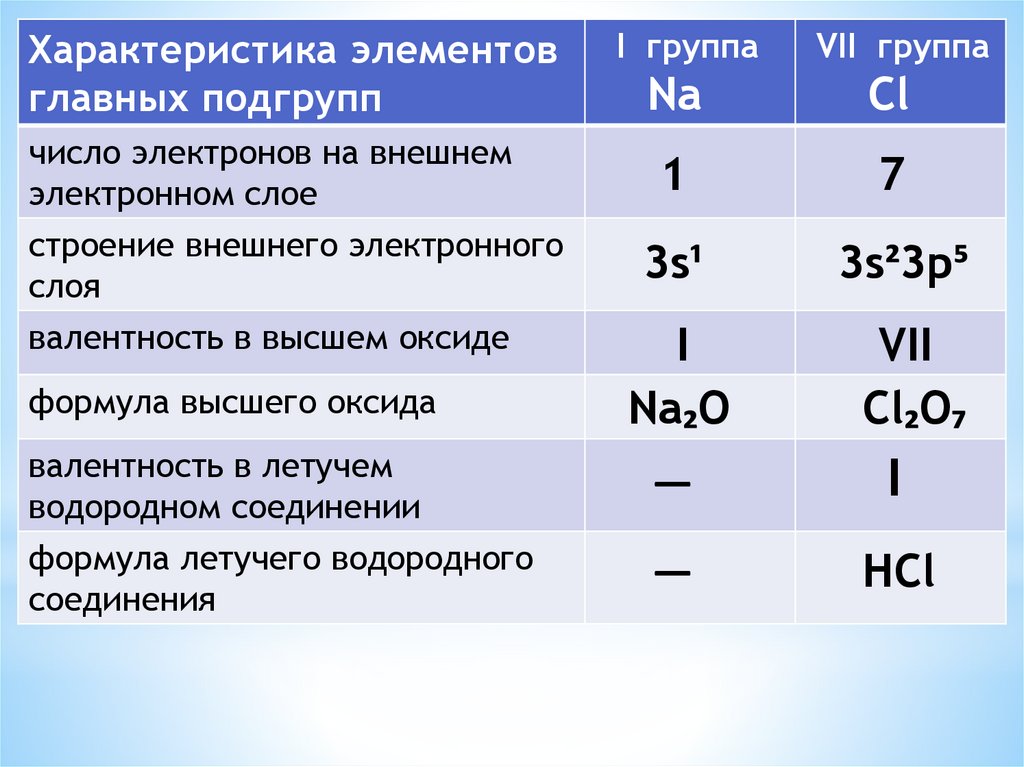
Характеристика элементовглавных подгрупп
число электронов на внешнем
электронном слое
строение внешнего электронного
слоя
валентность в высшем оксиде
формула высшего оксида
I группа
VII группа
Na
Cl
1
7
3s¹
3s²3p⁵
I
Na₂O
VII
Cl₂O₇
валентность в летучем
водородном соединении
—
I
формула летучего водородного
соединения
—
HCl
9.
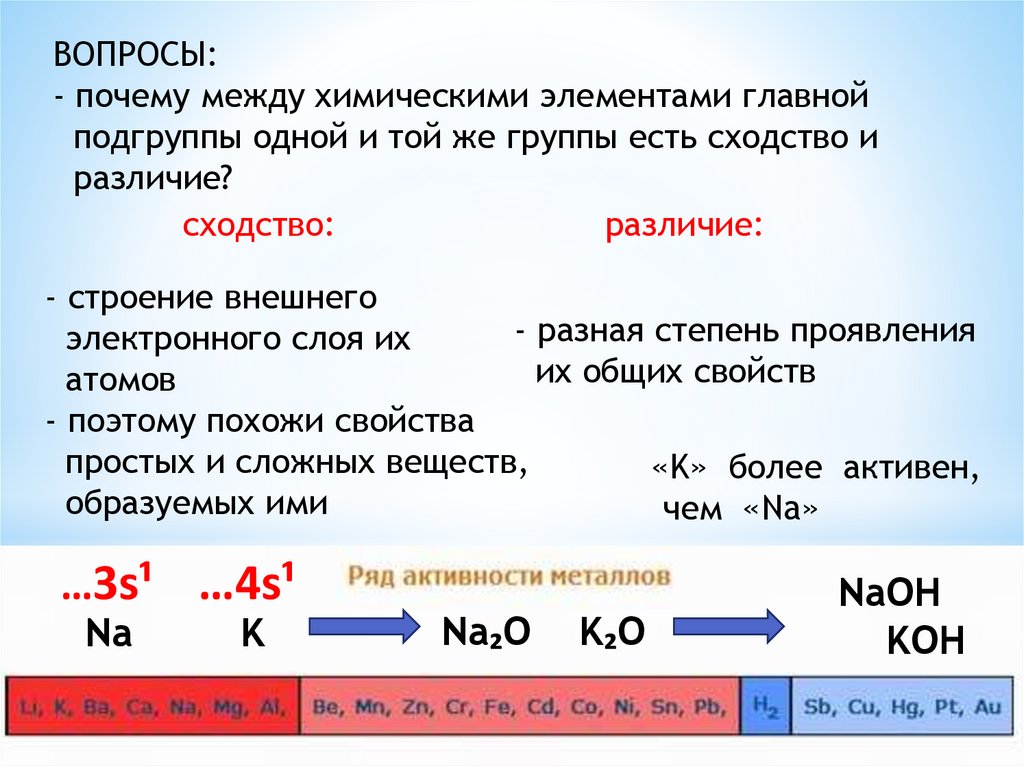
ВОПРОСЫ:- почему между химическими элементами главной
подгруппы одной и той же группы есть сходство и
различие?
сходство:
различие:
- строение внешнего
- разная степень проявления
электронного слоя их
их общих свойств
атомов
- поэтому похожи свойства
простых и сложных веществ,
«K» более активен,
образуемых ими
чем «Na»
…3s¹
Na
…4s¹
K
Na₂O
K₂O
NaOH
KOH
10.
Как изменяется радиус атомов в группах(главных подгруппах)?
радиусы атомов увеличиваются сверху вниз, так как
растет число электронных слоев вокруг ядра атома
11.
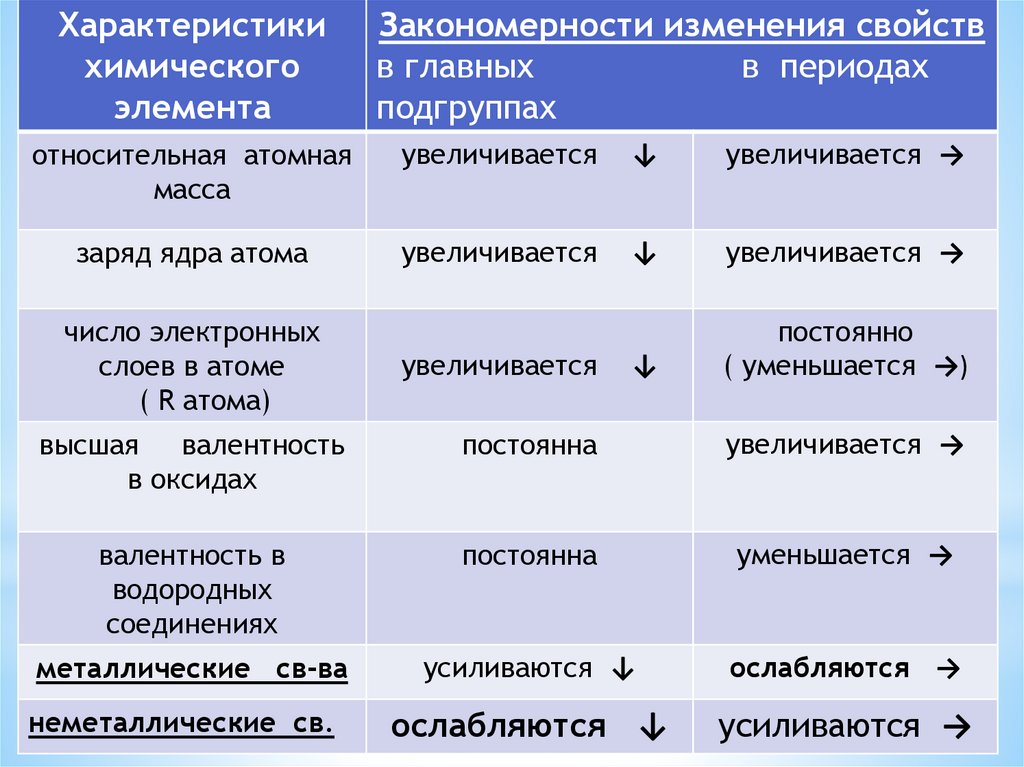
ЗАКОНОМЕРНОСТИ ИЗМЕНЕНИЯ ХАРАКТЕРИСТИКЭЛЕМЕНТОВ В ГРУППАХ (главные подгруппы)
сверху вниз:
-
относительная атомная масса ….. увеличивается
увеличивается
заряд ядра атома …..
не изменяется
число валентных электронов …..
увеличивается
радиус атома …..
притяжение валентных электронов к ядру …..уменьшается
увеличиваются металлические
…..
свойства (способность
отдавать валентные электроны в реакциях)
ГРУППА
- вертикальный ряд элементов, в котором
сверху вниз увеличивается порядковый
номер элемента и заряд ядра атома;
номер группы показывает высшую валентность
элемента.
12.
Характеристикихимического
элемента
Закономерности изменения свойств
в главных
в периодах
подгруппах
относительная атомная
масса
увеличивается
↓
увеличивается →
заряд ядра атома
увеличивается
↓
увеличивается →
↓
постоянно
( уменьшается →)
число электронных
слоев в атоме
( R атома)
увеличивается
высшая валентность
в оксидах
постоянна
увеличивается →
валентность в
водородных
соединениях
постоянна
уменьшается →
металлические св-ва
усиливаются ↓
ослабляются →
ослабляются ↓
усиливаются →
неметаллические св.




 Химия
Химия








