Похожие презентации:
Щелочные металлы. Положение в ПСХЭ
1. ЩЕЛОЧНЫЕ МЕТАЛЛЫ
2.
План1. Щелочные металлы – элементы
1.Положение в ПСХЭ;
2.Строение атомов.
2. Щелочные металлы – простые вещества
1.Химическая связь;
2.Распространение элементов в природе;
3.Физические свойства;
4.Химические свойства;
5.Практическое значение.
3.
Электронное строениеатомов
Название
элемента
Литий
Натрий
Калий
Рубидий
Цезий
Франций
Число
электронов
на внешнем
уровне
Число
электронных
слоев
Радиус
атома
Степень
окисления
Восстановительные
свойства
Активность
металла
4. Периодическая система химических элементов Д.И.Менделеева
II
1
H
II
2
Li
III
3
Na
4
K
IV
5
6
V
7
8
VI
9
VII
10
II
Группы элементов
IV
V
VI
III
VII
VIII
Щелочные металлы
1
1.00797
He
Водород
6,939
3
Литий
19 Ca
39.102
Cu
63.546
37
85.47
Ag
107.868
Серебро
Cs
Цезий
79
Au
196.966
Золото
Fr
Франций
65.37
Цинк
38
87.62
Стронций
Sс
44.956
Скандий
Иттрий
112.41
Кадмий
Индий
56 57
137.34
Барий
Ртуть
200.59
Радий
Ac
227.028
Актиний
Ti
47.90
Zr
91.224
Цирконий
Hf
178.49
Гафний
Свинец
Rf
[261]
Резерфордий
O
8
15.996
Кислород
15 S
Фосфор
V
23
50.942
Ванадий
33
74.9216
Мышьяк
41
Nb
92.906
Ниобий
73
Ta
180.9479
Тантал
83
208.98
Висмут
105
Db
[262]
Дубний
F
фтор
16 Cl
32,064
Сера
Cr
24
51.996
Хром
Se
34
78.96
Селен
42
Mo
95.94
Молибден
51 Te
121.75
Сурьма
82 Bi
207.2
7
14.0067
30,9738
50 Sb
118.71
Олово
104
Азот
32 As
72.59
Германий
72
N
14 P
28,086
Титан
81 Pb
204.383
Таллий
88 89
[226]
La
138.81
Лантан
Hg Tl
80
22
49 Sn
114.82
12,011
Кремний
39 40
88.9059
6
Углерод
31 Ge
69.72
Галлий
Y
C
13 Si
26,9815
Алюминий
Cd In
48
87 Ra
[223]
5
10 .811
Zn Ga
30
55 Ba
132.905
Бор
20 21
40,08
Кальций
Sr
В
12 Al
24,312
Магний
Рубидий
47
4
9,012
11 Mg
Медь
Rb
Be
22,988
Калий
29
Гелий
Вериллий
Натрий
2
Теллур
74
52
127.60
W
183.85
Вольфрам
Po
25
Br
Бром
43
Sg
[263]
Сиборгий
10
20,18
Неон
18
Аргон
54.938
Железо
35 Kr
79.904
75
107
Co 28 Ni
58.933
Кобальт
99
126.904
Re
186.2
36
Криптон
101.07
Родий
[262]
Pd
106.4
Палладий
Ксенон
131,3
Os 77 Ir 78 Pt
190.2
192.2
Осмий
Иридий
86
Радон
[222]
Bh 108 Hs 109 Mt
Борий
46
54
85 Rn
210
102.905
Рутений
76
58.71
Никель
83,8
Tс 44 Ru 45 Rh
Рений
Астат
27
55.847
53 Xe
Иод
39,948
Mn 26 Fe
Технеций
I
Ne
17 Ar
35,453
Марганец
84 At
208.982
Полоний
106
Хлор
9
18.9984
4,003
[265 ]
Хассий
[266 ]
Мейтнерий
195.09
Платина
5. Строение атомов
• LiСтепень окисления
+1
+3
2 1
• Na
+11
2 8 1
• K
+19
2 8 8 1
Восстановительные
свойства
возрастают
6. Щелочные металлы
LiNa
K
Rb
Cs
Fr
Увеличивается химическая активность, так
как увеличивается радиус
атомов(количество электронных уровней)
Щелочные металлы – восстановители
( отдают внешний электрон)
Ме – 1е = Ме +1
7.
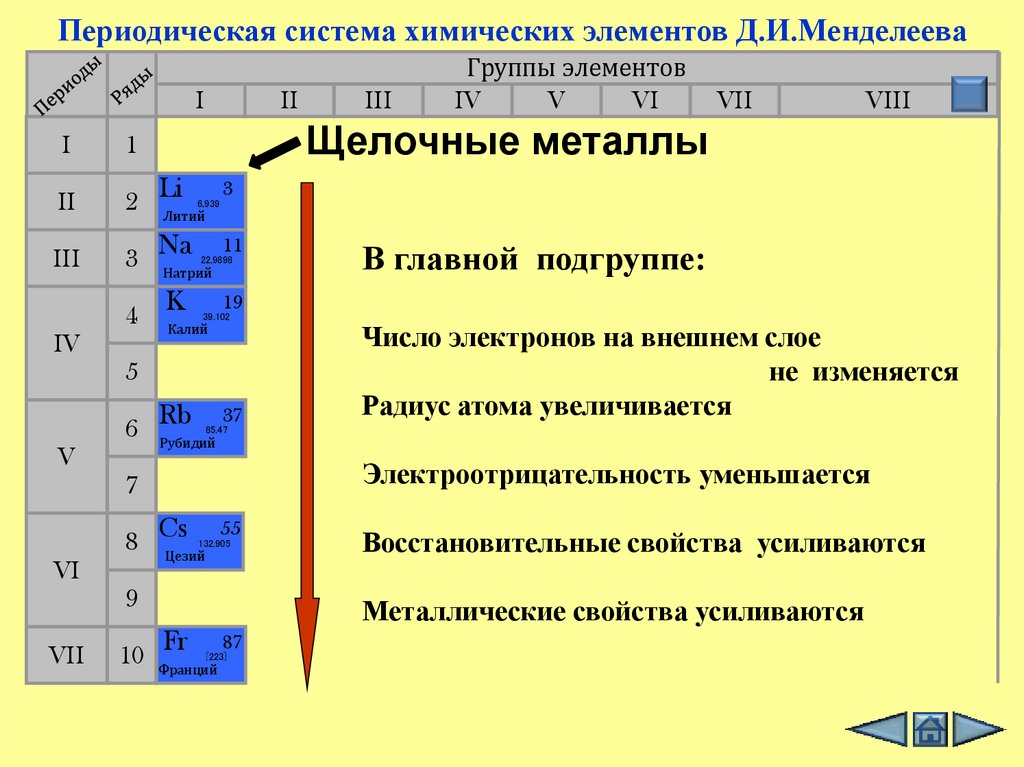
Периодическая система химических элементов Д.И.МенделееваI
1
II
2
Li
III
3
Na
4
K
6,939
V
VI
11
22,9898
Натрий
10
В главной подгруппе:
19
39.102
Калий
Rb
37
Число электронов на внешнем слое
не изменяется
Радиус атома увеличивается
85.47
Рубидий
Электроотрицательность уменьшается
Cs
55
132.905
Цезий
9
VII
VIII
Литий
7
8
VII
3
5
6
III
Щелочные металлы
I
IV
II
Группы элементов
IV
V
VI
Восстановительные свойства усиливаются
Металлические свойства усиливаются
Fr
87
[223]
Франций
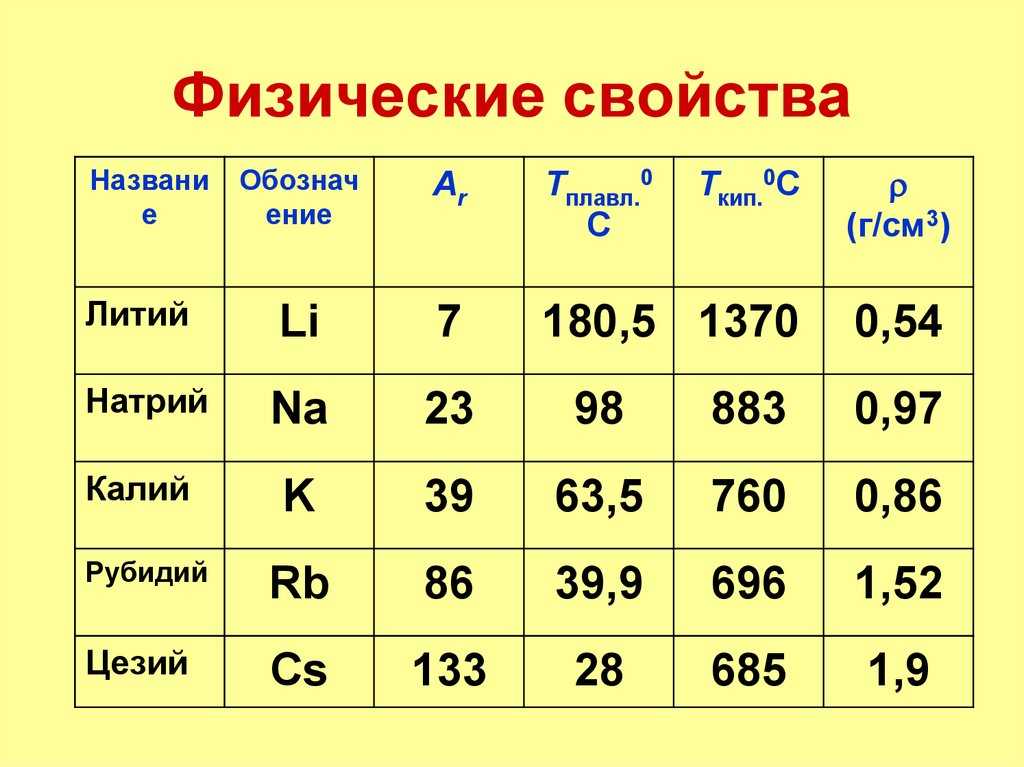
8. Физические свойства
Обозначение
Ar
Tплавл.0
C
Tкип.0C
(г/см3)
Литий
Li
7
180,5 1370
0,54
Натрий
Na
23
98
883
0,97
Калий
K
39
63,5
760
0,86
Рубидий
Rb
86
39,9
696
1,52
Цезий
Cs
133
28
685
1,9
Названи
е
9. Химические свойства щелочных металлов
Взаимодействие с простыми веществамиС кислородом Li + O2 =
Na + O2 =
С галогенами M + Cl2 =
С азотом
С водородом
М + N2 =
M + H2 =
10. Химические свойства щелочных металлов
Химические свойстваВзаимодействие
с простымищелочных
веществами
металлов
С кислородом 4Li + O2 = 2Li 2
оксид
2Na + O2 = Na2O2
пероксид
С галогенами 2M + Cl2 = 2MCl
хлорид
С азотом
нитрид
С водородом
6М + N2 = 2Na3N
2M + H2 = 2MH
11. Химические свойства щелочных металлов
С водой2Na + 2H2O = 2NaOH + H2↑
щелочь
12.
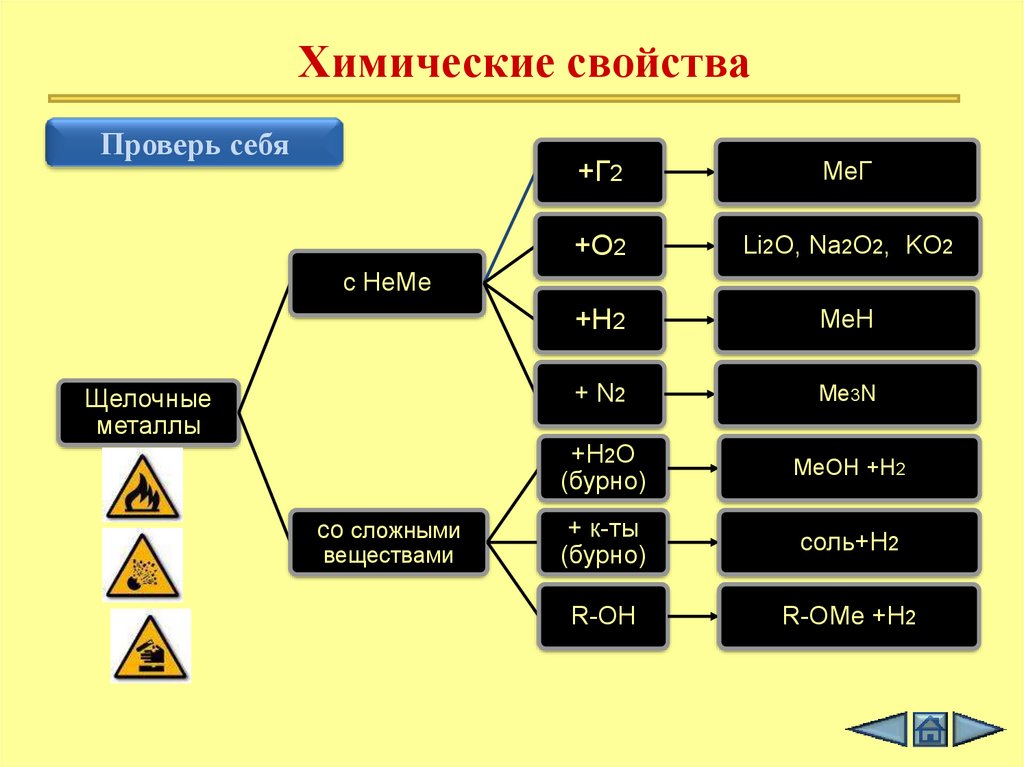
Химические свойстваПроверь себя
+Г2
MeГ
+O2
Li2O, Na2O2, KO2
+H2
МеH
+ N2
Me3N
+H2O
(бурно)
МеOH +H2
+ к-ты
(бурно)
соль+H2
R-OH
R-OMe +H2
с НеМе
Щелочные
металлы
со сложными
веществами
13.
Качественное определение щелочных металловДля распознавания соединений щелочных металлов по окраске
пламени исследуемое вещество вносится в пламя горелки на кончике
железной проволоки.
Li+ - карминово-красный
Na+ - желтый
Li+
K+ - фиолетовый
Rb + - красный
Na+
Cs+ - фиолетово-синий
K+
14.
1.Щелочные металлыхимически активные,поэтому их нельзя хранить
на воздухе.
2.Эти металлы называют
щёлочные, так как при их
реакции с водой
образуются щёлочи.
3.При взаимодействии с
атомами других веществ
они –восстановители.











 Химия
Химия








