Похожие презентации:
Изменения происходящие с веществами. Урок химии. 8 класс
1.
Урок химии8 класс
Разработала
учитель химии, биологии IКК
Субботина О. Н.
2. Тема урока: «Обобщение по теме «Изменения происходящие с веществами»
Цель урока:обобщить и систематизировать знания
по данной теме.
3.
Мы с химией пока едва знакомы,Её мы учим только первый год
Но знаем главные ее законы,
А иногда, увы, наоборот!
Учитель нам в любой беде поможет,
Он может всё понятно объяснить,
И с первых дней, хоть вы не верите, быть может
Мы научились химию любить.
И уравнять мы сможем уравненья,
И постараемся загадки разгадать
К задачам мы найдем решенья
И на вопрос ответим все на «5»
4. Укажите о каких явлениях, физических или химических, идет речь в следующих высказываниях поэтов. Ответ обоснуйте
Блиц - опросУкажите о каких явлениях, физических или
химических, идет речь в следующих
высказываниях поэтов. Ответ обоснуйте
5. И трещат сухие сучья, Разгораясь жарко, Освещая тьму ночную Далеко и ярко. И.Суриков
6.
В декабре, в декабреВсе деревья в серебре,
Нашу речку, словно в сказке,
За ночь вымостил мороз…
С.Я.Маршак
7.
На рукомойнике моемПозеленела медь.
Но так играет луч на нем,
Что весело глядеть.
А.Ахматова
8.
Когда металл в крутые формы льем,Мне верится, что оживут в металле
Горячие полдневные поля.
Кипит металл, и ждут его поля.
А.Кравцов
9.
Каковы признаки химических реакций?Какие условия необходимы для проведения
химических реакций?
10.
Какие металлы вытесняют водородиз кислот?
Какие металлы вытесняют из солей
другие металлы ?
Какие типы реакций по
числу и составу веществ вы знаете?
Дать определения всем типам реакций.
11. Определите тип реакций:
Al + C = Al3C4Mg + TiO5 = MgO + Ti
CaCO3 = CaO + CO2
2 + N
=2NaCl
NH2 3+ H
Ni++H
HCl
=22=NiCl
2Na
MgCl
+2Mg
12. «Кто быстрее»
Карбонат калияАзотная кислота
Сульфат железа (II)
Высшая степень окисления азота
Низшая степень окисления углерода
Гидроксид алюминия
13. Найдите соответствие:
1. Мg(OH)2 = MgO + H2OA) Реакция
2. CuO + H2 = Cu + H2O
Б) Реакция обмена
3. 3CaO + P2O5 = Ca3(PO4)2
В) Реакция замещения
4. Cа(OН)2 + 2HСl = CaСl2 + 2H2O
соединения
Г) Реакция
разложения
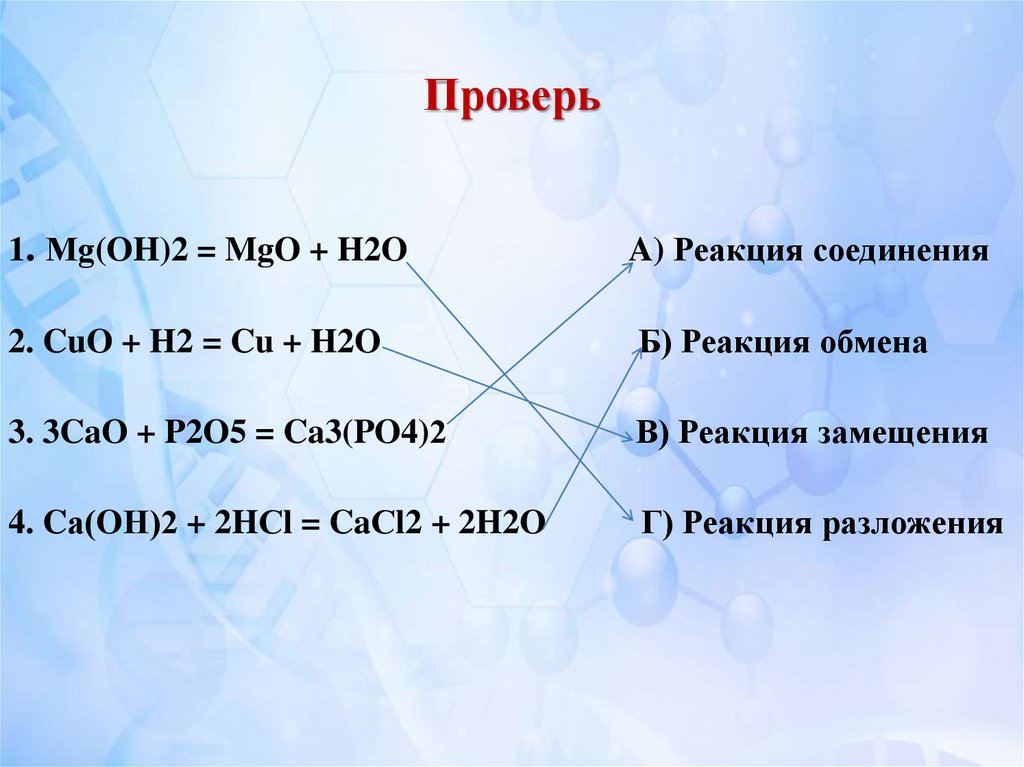
14. Проверь
1. Мg(OH)2 = MgO + H2OA) Реакция соединения
2. CuO + H2 = Cu + H2O
Б) Реакция обмена
3. 3CaO + P2O5 = Ca3(PO4)2
В) Реакция замещения
4. Cа(OН)2 + 2HСl = CaСl2 + 2H2O
Г) Реакция разложения
15.
Когда и кем был открыт закон сохранениямассы веществ?
Приведите формулировку этого закона?
16. М. В. Ломоносов
Закон сохранения массы веществ (1748 г.)М. В. Ломоносов
17. Расставьте коэффициенты в следующих уравнениях реакций. Определите типы реакций:
1.2.
3.
4.
5.
6.
7.
CuCl2+Al → AlCl3+Cu
СаСО3 → СаО + CO2
Na2SO4 + ВаСl2 → NaСl + ВаSO4
H3PO4+ NaOH → Na3PO4+H2O
Cu +HNO3(конц) → Cu(NO3)2 + NO2↑+ H2O
Fe(OH)3 → Fe2O3 + H2O
Аl2(SO4)3 + NaOH → Na2SO4 + Аl(OH)3
18.
1.2.
3.
4.
3CuCl2+2Al = 2AlCl3+3Cu
СаСО3 = СаО + CO2
Na2SO4 + ВаСl2 = 2NaСl + ВаSO4
H3PO4+ 3NaOH = Na3PO4+3H2O
5. Cu +4HNO3(конц) =Cu(NO3)2 + 2NO2↑+ 2H2O
6. 2Fe(OH)3 = Fe2O3 + 3H2O
7. Аl2(SO4)3 + 6NaOH = 3Na2SO4 + 2Аl(OH)3
19. Напишите уравнения реакций по названиям исходных веществ и продуктов реакций. Определите типы реакций.
• Сульфат магния + гидроксид натрия →гидроксид магния + сульфат натрия.
• Хлорид калия + нитрат серебра →
нитрат калия + хлорид серебра.
• Железо + соляная кислота → хлорид железа (II) + водород.
• Оксид меди + оксид азота (V) → нитрат меди.
• Железо + сера → сульфид железа (II).
20. Задача
Какая масса щелочи и какой объем водорода(н.у) образуется при взаимодействии 4,6 г
металлического натрия с водой?
21. Задача
Рассчитайте объём водорода(н.у.),полученного при взаимодействии 14,4 г.
цинка, содержащего 10% примесей с
избытком соляной кислоты.
22. Cамостоятельная работа
I вариантМагний + кислород = оксид магния
Цинк + соляная кислота = хлорид цинка + водород
Оксид кальция + серная кислота = сульфат кальция + вода
Вода = водород + кислород
II вариант
Алюминий + сера = сульфид алюминия
Железо + сульфат меди(II) = сульфат железа (II) + медь
Оксид ртути (II) = ртуть + кислород
Соляная кислота + гидроксид кальция = хлорид кальция +
вода
23. Проверка
ПроверкаI вариант
2Mg + O2 = 2MgO соединения
Zn + 2HCl = ZnCl2 + H2 замещения
CaO + H2SO4 = CaSO4 +H2O обмена
2H2O = 2H2 + O2 разложения
II вариант
2Al + 3S = Al2S3
соединения
Fe + CuSO4 = FeSO4+Cu замещения
2HgO = 2Hg + O2 разложения
2HCl + Ca(OH)2 = CaCl2 + 2H2O обмена
24. Домашнее задание:
1. Повторить формулы нахождения количества вещества,объёма, массовой и объёмной компонентов смеси ,
массовой доли элемента в веществе.
2. Определите тип реакции и расставьте коэффициенты
а) N2 + H2 → NH3
б) Al(OH)3 → Al2O3 + H2O
в) Mg +HCl → MgCl2 + H2
г) СaO + HNO3→ Ca(NO3)2 + H2O
25.
1.Теперь я знаю, что …2.Теперь я знаю как…
3.Теперь я умею …
26.
Без химии ты глух и нем.И шагу не шагнешь порою,
Не вырастишь хороший хлеб
И дом хороший не построишь.
Химию любить и не лениться –
Значит, понятно будет всё:
Почему коптит порою примус,
На морозе сушится белье.
Жизнь вокруг себя узнаешь,
Разрешишь любой серьезный спор,
Без огня в дороге яйца сваришь
И без спичек разведешь костер.
















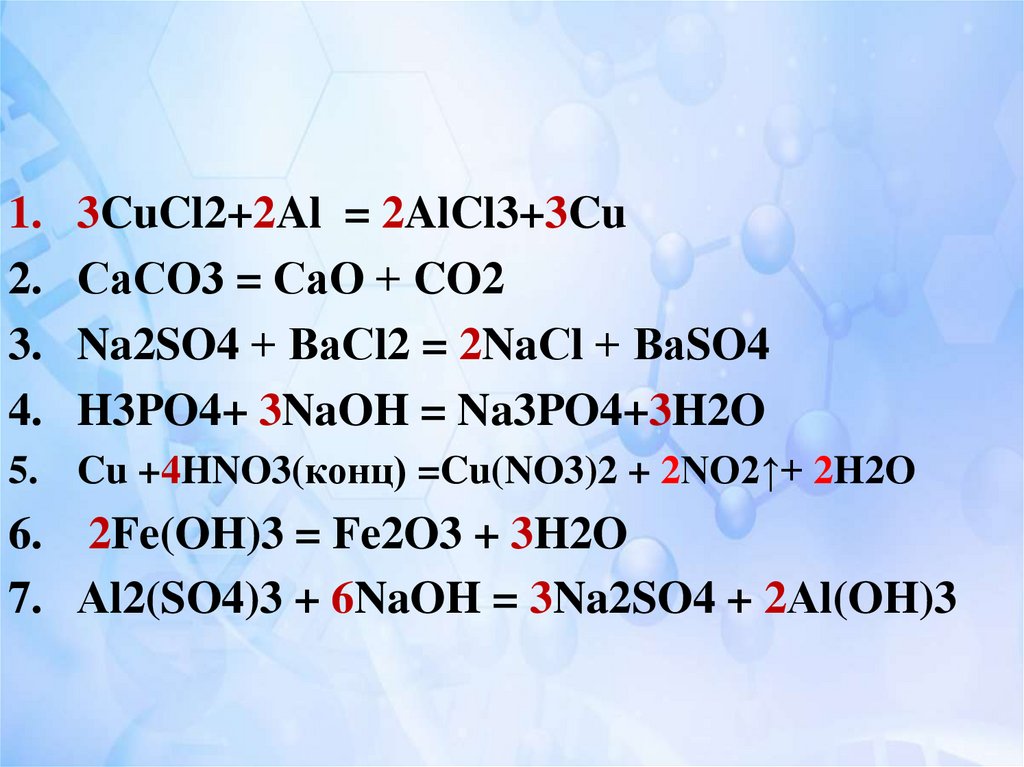








 Химия
Химия








