Похожие презентации:
Азотистая кислота
1.
Если сразу с водородаВдруг та формула начнется
То таких десяток формул,
Выучить тебе придется
Вот подружка с кислородом - H2SO4
Бескислородная, вон та- HCl
Но у них одна природа
Всё с названьем -
КИСЛОТА
2.
H2SO4Таблица 10 стр.210
3.
4.
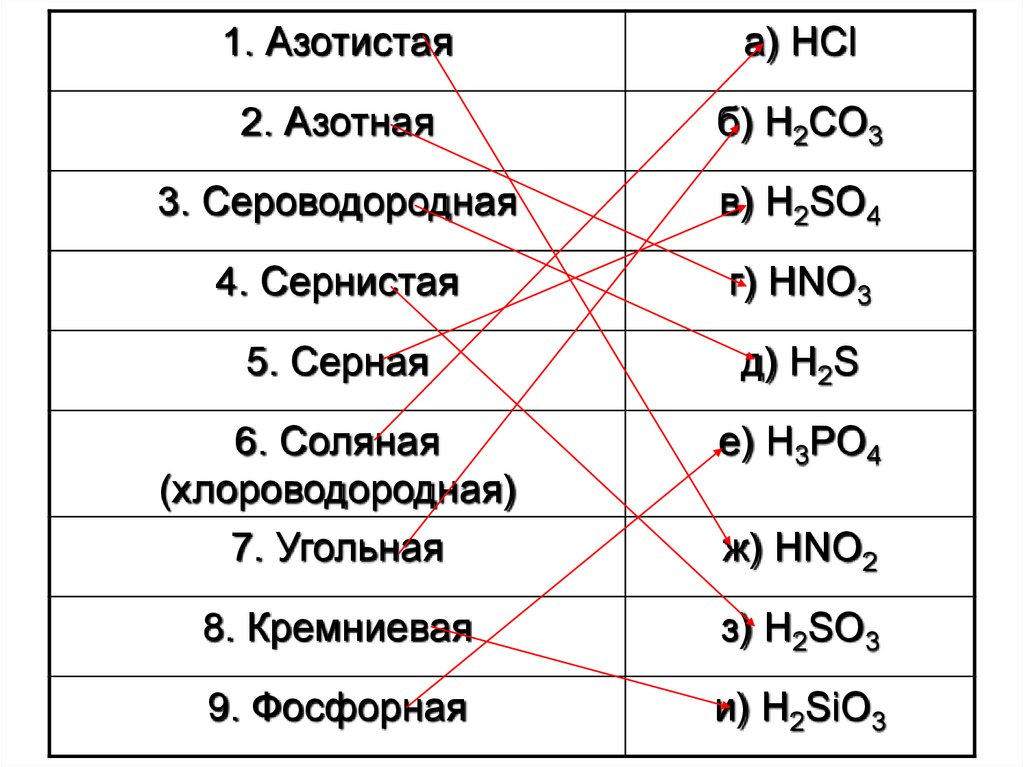
1. Азотистаяа) HCl
2. Азотная
б) H2CO3
3. Сероводородная
в) H2SO4
4. Сернистая
г) HNO3
5. Серная
д) H2S
6. Соляная
(хлороводородная)
7. Угольная
е) H3PO4
8. Кремниевая
з) H2SO3
9. Фосфорная
и) H2SiO3
ж) HNO2
5.
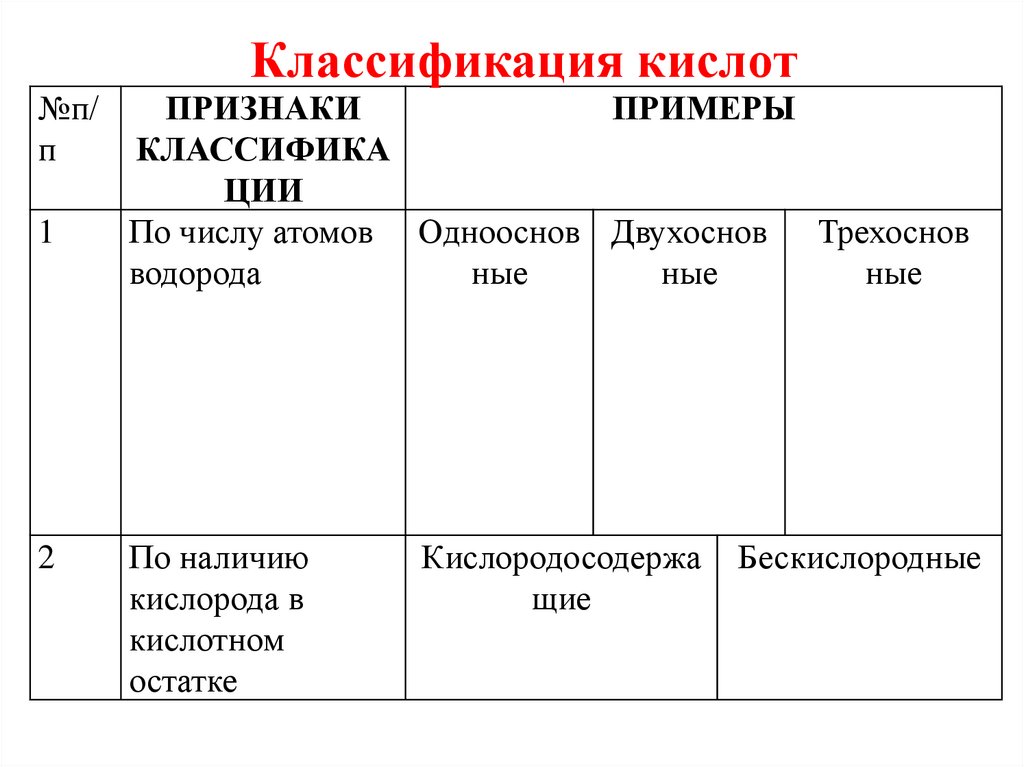
Классификация кислот№п/
п
1
2
ПРИЗНАКИ
ПРИМЕРЫ
КЛАССИФИКА
ЦИИ
По числу атомов Однооснов Двухоснов Трехоснов
водорода
ные
ные
ные
По наличию
кислорода в
кислотном
остатке
Кислородосодержа
щие
Бескислородные
6. Кислоты, их классификация и свойства
8 класс7.
Кислоты – этоэлектролиты, при
диссоциации которых
в водных растворах в
качестве катионов
образуются ионы
водорода, а …
8. Классификация кислот по признаку растворимости
• Угольная и сернистая кислоты всвободном виде не существуют, так
как они легко распадаются на воду и
соответственно углекислый и
сернистый газы:
• H2CO3= CO2↑+ H2O
• H2SO3= SO2↑+ H2O
9.
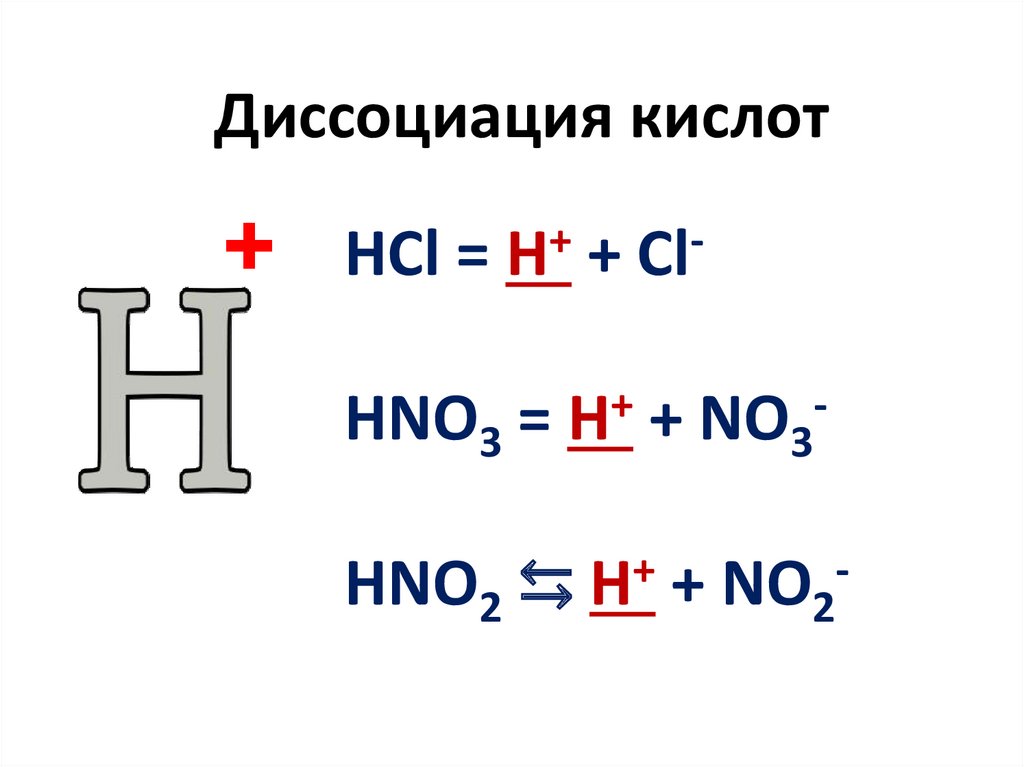
Диссоциация кислот+
HCl =
+
H
HNO3 =
+
+
H
HNO2 ⇆
Cl
+
+
H
NO3
+
NO2
10.
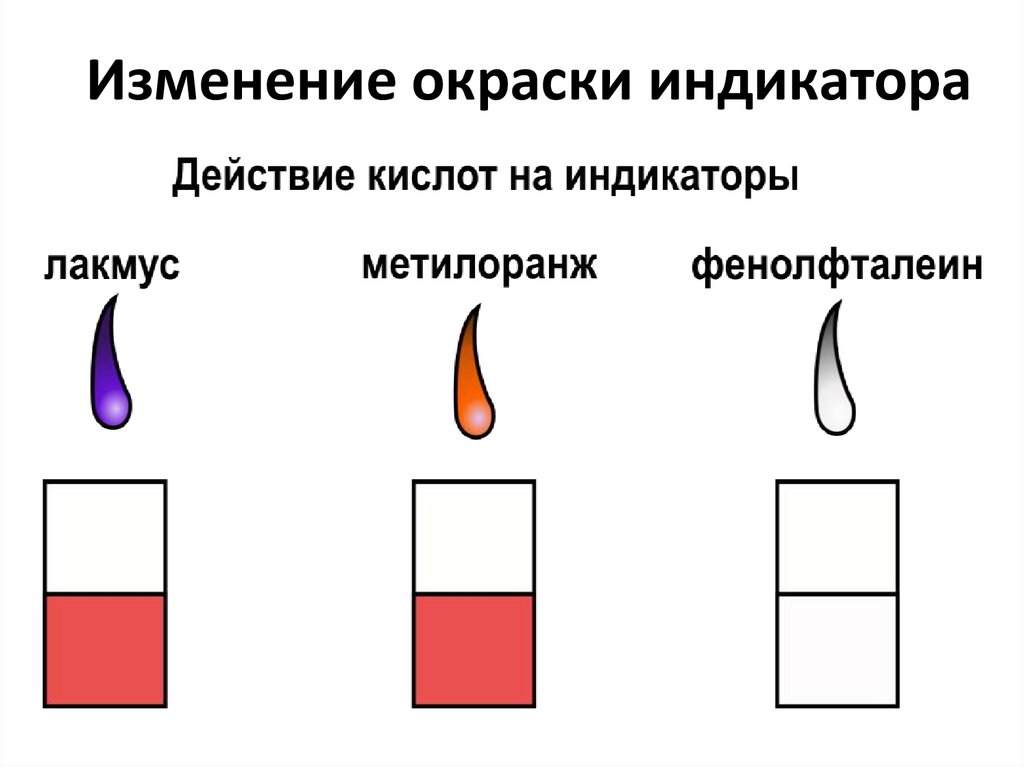
Изменение окраски индикатора11. Типичные реакции кислот
1.2.
3.
4.
Кислота + Основание = Соль +Вода
Кислота + Оксид металла = Соль + Вода
Кислота + Металл = Соль + Водород
Кислота + Соль = Новая кислота + Новая
соль
12. Типичные реакции кислот
1. Кислота + Основание = Соль +ВодаHCl + КOH = КCl + H2O
+
ОН + Н = Н2О
HNO3 + KOH = KNO3 + H2O
H2SO4 + 2 KOH = K2SO4 + 2 H2O
H3PO4 + 3 KOH = K3PO4 + 3 H2O
Реакция нейтрализации
13. Типичные реакции кислот
2. Кислота + Оксид металла = Соль +Вода
H2SO4 + CuO = CuSO4 + H2O
2H+ + CuO = Cu 2+ + H2O
14. Типичные реакции кислот
3. Кислота + Металл = Соль + Водород2HCl + Zn = ZnCl2 + H2↑
2 HCl + Fe = FeCl2 + H2 ↑
H2SO4 + Mg = MgSO4 + H2 ↑
H2SO4 + Fe = FeSO4 + H2 ↑
15.
Вытеснительный ряд металловРусский химик Н. Н. Бекетов
исследовал металлы и
расположил их в вытеснительный
ряд (ряд активности) в порядке
уменьшения реакционной
активности.
Металлы, стоящие слева от
водорода, способны вытеснять
его из кислот. А металлы, стоящие
справа от водорода, не могут
вытеснять его из кислот.
16.
Для этих реакций необходимы условия:Металл должен находиться в ряду напряжений до
водорода;
Должна получиться растворимая соль;
Нерастворимые кислоты не вступают в реакцию с
металлами;
Концентрированный раствор серной и растворы азотной
кислоты иначе реагируют с металлами.
17. Типичные реакции кислот
4.Кислота + Соль = Новая кислота +Новая соль
HCl + AgNO3 = AgCl↓ + HNO3
Ag+ + Cl- = AgCl↓
2 HNO3 + CaCO3 = Ca(NO3)2 + CO2↑ + H2O
2H+ + CaCO3 = Ca2+ + CO2↑ + H2O
H2SO4 + BaCl2 = BaSO4↓ + 2 HCl
Ba2+ + SO42- = BaSO4 ↓
2 H3PO4 + 3 BaCl2 = Ba3(PO4)2↓ + 6 HCl
3 Ba2+ + 2PO4 3- = Ba3(PO4)2 ↓
18.
Запомните:Кислоты изменяют окраску индикаторов;
Кислоты реагируют с основаниями;
Кислоты реагируют с оксидами металлов;
Кислоты при определённых условиях реагируют с металлами
и солями.
19. Задание №1
1. Закончите схемы возможных реакций.Укажите их тип.
а) H2SO4 + NaOH → …
б) NaCl + H2SO4 → …
в) CuO + HCl → …
г) Cu + HCl → …
д) Fe(OH)3 + HNO3→ …
е)Ca + HCl→ …
ж) SO3 + H2SO4→ …
з) CaCO3 + HCl→ …
и) Na2SO4 + H2CO3→ …
20. Ответ
а) H2SO4 + 2NaOH = Na2SO4 +2H2O(реакция обмена)
б) 2NaCl + H2SO4= Na2SO4 + 2HCl↑
(реакция обмена)
в) CuO + 2HCl= CuCl2 + H2O (реакция
обмена)
г) Cu + HCl≠
21. Ответ
д) Fe(OH)3 + 3HNO3= Fe(NO3)3 + 3H2O(реакцияобмена)
е) Ca + 2HCl= CaCl2 + H2↑ (реакция
замещения)
ж) SO3 + H2S ≠
з) CaCO3 + 2HCl= CaCl2 + CO2↑ + H2O
(реакцияобмена)
и) Na2SO4 + H2CO3≠
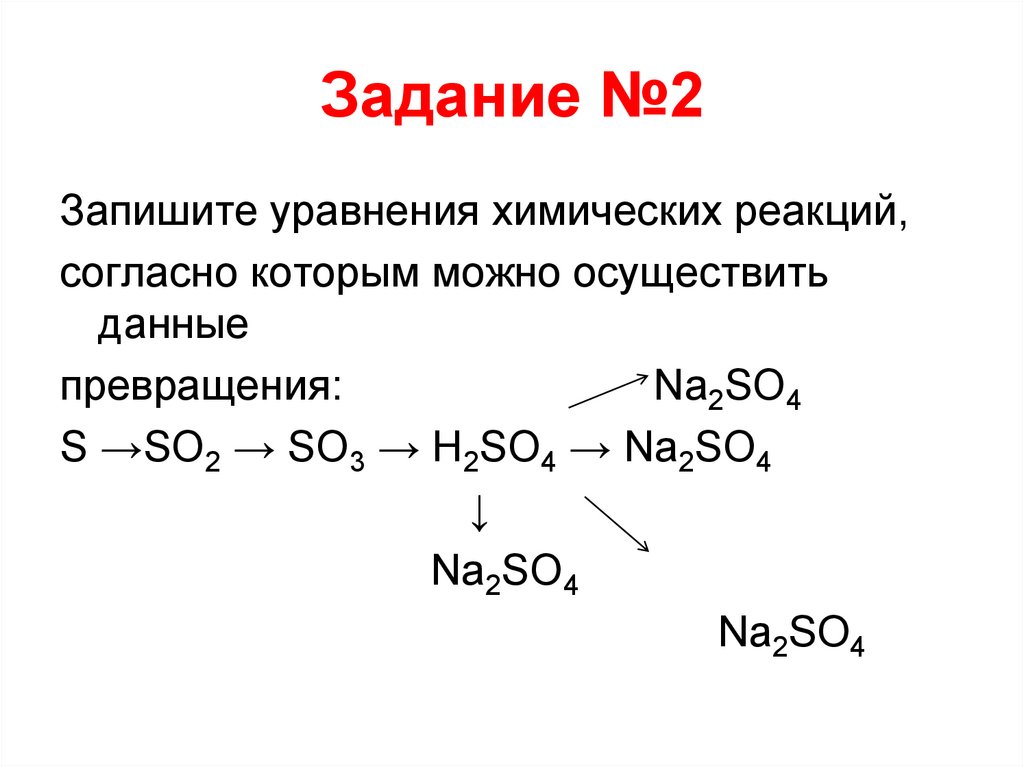
22. Задание №2
Запишите уравнения химических реакций,согласно которым можно осуществить
данные
превращения:
Na2SO4
S →SO2 → SO3 → H2SO4 → Na2SO4
↓
Na2SO4
Na2SO4
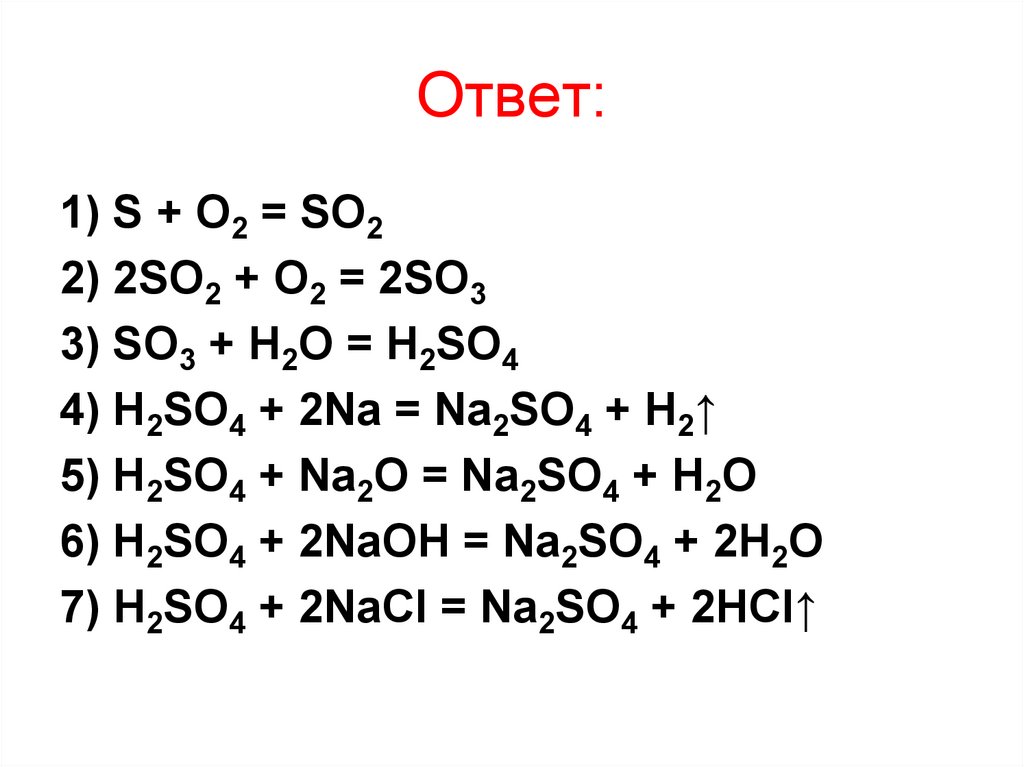
23. Ответ:
1) S + O2 = SO22) 2SO2 + O2 = 2SO3
3) SO3 + H2O = H2SO4
4) H2SO4 + 2Na = Na2SO4 + H2↑
5) H2SO4 + Na2O = Na2SO4 + H2O
6) H2SO4 + 2NaOH = Na2SO4 + 2H2O
7) H2SO4 + 2NaCl = Na2SO4 + 2HCl↑
24. Продолжите фразу
Я научился…
Я узнал…
Мне было интересно…
Мне было трудно…
25.
26. Самооценка и оценка группы
Ф.И. ученика1.
2.
3.
4.
5.
Самооценка
Оценка группы
27. Домашнее задание
П.39
Таблица 10 стр.235 выучить!!!
Упр.4 с.с.242
Задача* - 5 с.242
28.
• Автор: Калитина Тамара Михайловна• Место работы: МБОУ СОШ №2
с.Александров-Гай Саратовской области
• Должность: учитель химии
• Дополнительные сведения: сайт
http://kalitina.okis.ru/
• Мини-сайт http://www.nsportal.ru/kalitinatamara-mikhailovna






















 Химия
Химия








