Похожие презентации:
Алюминий и его соединения (урок изучения нового материала)
1. МОУ«Средняя общеобразовательная школа № 36»
Тема: Алюминий и его соединения(урок изучения нового материала)
9,11 кл.
.
«Этому металлу – принадлежит великое будущее»
(Н.Г.Чернышевский)
2.
Цель урока• Повторить и систематизировать знания учащихся о металлах III
группы главной подгруппы.
• Уметь давать характеристику металлам III группы главной
подгруппы исходя из положения в периодической системе и
строение атома.
• Уметь доказывать химические свойства алюминия и его
соединениям. Записывать уравнения реакций в молекулярном,
ионном, окислительно-восстановительном виде.
• Уметь пользоваться приемами сравнения, обобщения, делать
выводы.
3. Оборудование к уроку
Образцы металла алюминия, природных соединений исплавов, стеклянная посуда (чашка Петри, колба), вода,
соли алюминия, коллекция веществ из алюминия,
мультимедийный проектор, экран, компьютер,
учебник.
4.
План урока• Положение металла в периодической системе
Д.И.Менделеева.
• Строение атома металла.
• Физические свойства металла.
• Химические свойства металла.
• Получение металла.
• Применение металла и его соединений.
5. Ход урока
1.Организационный момент (психологический настрой) - 2мин.
2. Проверка домашнего задания - 5 мин.
3. Вступительное слово учителя - 1 мин.
4. Повторение и обобщение темы - 32 мин.
6. Подведение итогов урока - 2 мин.
7. Задание на дом (дифференцированное ) - 3 мин.
6.
Бор первый в группе третьей,Но алюминию букеты все несут.
Он плод труда эпохи многолетней
Его теперь и режут и куют.
7. Из истории открытия Al
Открыт в 1825 г. Хансом Кристаном Эрстедом(Копенгаген, Дания).От лат.alumen – квасцы.
В период открытия алюминия - металл был дороже золота.
Англичане хотели почтить богатым подарком великого
русского химика Д.И Менделеева, подарили ему
химические весы, в которых одна чашка была изготовлена
из золота, другая - из алюминия. Чашка из алюминия стала
дороже золотой. Полученное «серебро из глины»
заинтересовало не только учёных, но и промышленников и
даже императора Франции.
8. Строение атомов Ме III группы главной подгруппы
+5 B ))…2s2 2p12 3
+13 Al
)))…3s2 3
p1
283
+31 Ga ))))…4s2 4 p1
2 8 8 3
+49 In )))))…5s2 5 p1
2 8 18 8 3
+81 Tl ))))))… 6s2 6 p1
2 8 18 18 8 3
… ns2np1
Al - амфотерный элемент
Изменение свойств металлов.
Учитель: Как и почему изменяется
химическая активность металлов
с возрастанием порядкового номера?
Примерные ответы учащихся:
•Радиус атома увеличивается.
•Увеличиваются восстановительные
свойства (способность отдавать
электроны).
9. Нахождение в природе Al
Al занимает 3-е место по распространению в земной коре послекислорода и кремния. Al самый распространенный Ме в природе.
Соединения Al были известны очень рано: история глин начинается
с доисторических времен. Al входит в состав силикатов(шпаты,
слюда), а также глин. Из соединений Al наибольшее значение имеет
минерал Al2O3-(глинозем) корунд, синий - сапфир, фиолетовый аметист, красный - рубин, непрозрачный- наждак. Ортоклаз, нефелин
боксит, криолит.
10. Нахождение в природе Al
11.
Нахождение в природе Al2O3Сапфир
(с прим.Ti и Fe)
Бирюза
Аметист
Корунд
Рубины (c прим.Cr)
Топаз
12. Физические свойства Al
Al серебристо – белый легкий металл. Высокие качества Al: электропроводностьи теплопроводность, пластичность, легкость, стойкость по отношению к
химическим веществам – одни эти качества обеспечивали бы Al широкую
будущность, но «Металлом будущего » он становится главным образом
благодаря способности давать сплавы. Al - как проводник электрического тока и
тепла занимает 4 - е место после Cu, Ag и Au. С этим связано его применение
для изготовления электрических проводов. Особо чистый Al хорошо отражает
световые лучи. Им покрыто основное зеркало самого большого в мире советского
Фильм № 1
6 -ти метрового оптического телескопа.
Д/задание 1) исследуйте, горит ли Al на воздухе и как
легко плавится. Для этого отрежьте полоску фольги,
закрепите пинцетом один конец, а к другому поднесите
зажженную спичку. Опишите, что произойдет?
(вопрос: что мешает Al, после того как он расплавится,
стечь с нагретой полоски в виде капель?)
2) поместите по кусочку фольги в воду, в нашатырный спирт, в столовый уксус.
Опишите, что произойдет через несколько суток. Опыт закончите, когда в одном
из растворов кусочек фольги превратится в тончайшее «кружево».Сохраните его.
13. Химические свойства Al
Фильм № 21. Металл взаимодействуют с простыми веществами: ( при t)
+ Г2 = МеГ3 (галогениды) - 7 группа , но 2Al
+ 3I2 = 2AlI3
( кат. H2O)
Al
+ O2 = Ме2О3 (оксид)
- 6 группа
+ S = Ме2S3 (сульфид)
- 6 группа
+ N2 = МеN (нитрид)
- 5 группа
+ P = МеР (фосфид)
- 5 группа
+ С = Ме4С3 (карбид)
Фильм № 3
- 4 группа
+ Si = Me4Si3 (силицид) - 4 группа
+ H2 = не реагирует
Самостоятельная робота по рядам
Задание: Составьте уравнения химических реакций и
расставьте коэффициенты с помощью электронного
баланса
1-й ряд
2-й ряд
3-й ряд
Al + Cl2 =?
Al + O2 =?
Al + C =?
14. Проверка самостоятельной работы
Задание: Составьте уравнения химических реакций ирасставьте коэффициенты с помощью электронного баланса
( одного на выбор).
1-й ряд
2-й ряд
3-й ряд
Al + Cl2 = ?
2Al0 + 3Cl20 = 2Al+3Cl3 -1
Al + O2 =?
4Al0 + 3O20 = 2Al2+3O3-2
2 Al0 - 3е=Al+3 (восс.)
4 Al0- 3е=Al+3 (восс.)
3 Cl20 + 2е=2Cl -1(окисл.) 3 O20 + 4е=2O-2 (окисл.)
Al + C = ?
4Al0 +3C0 = Al4+3C3-4
4 Al0- 3е =Al+3 (восс.)
3 C0+ 4е =C-4 (окисл.)
15. Химические свойства Al
Опыт 1.Алюминий взаимодействует с бромом
Фильм № 4
16. Опыт 2. « Зажигание водой » Ложечку порошка I2 смешали с порошком Al. Смесь пересыпали на асбестовою сетку. Собрали кучкой и
прибавили несколько капельH2O. В присутствии H2O Al энергично соединяется с I2. Реакция
сопровождается выделением большого количества теплоты, смесь
воспламеняется. Выделяются пары I2, не успевшего вступить в
реакцию.
Al + I2 = ? (Какую роль здесь выполняет H2O )
17. Химические свойства Al
2. Металл взаимодействует со сложными веществами:а) с Н2О:
у Al необходимо снять оксидную пленку, чтобы произошла
реакция с водой 2Ме + 6H2O = 2Me(OH)3 + 3H2 (гидроксид)
б) с кислотами: 2Ме + 6HCl = 2МеCl3 + 3H2
При определенных условиях химические реакции с кислотами
окислителями протекают следующим образом:
Ме + HNO3(разб.) = соль + NO + H2O
(или NH4NO3)
Ме + HNO3(конц.) = соль + N2O + H2O (при t)
Ме + H2SO4(конц.) = соль + SO2 + H2O (при t)
( или S, H2S)
Запомним!
Что Al пассивирует при обычных условиях в конц. HNO3 и
H2SO4.
18. Задание «Соколиный глаз »
Данное задание позволит определить у кого острый глази пытливый ум. Из уравнений химических реакций вам
следует выбрать практически осуществимые и
прокомментировать их.
1) 2Na + 2HCl = 2NaCl + H2
2) 2Al + 6HCl = 2AlCl3 + 3H2
3) Mg + 2HNO3 = Mg(NO3)2 + H2
4) 4Mg + 10HNO3 (конц.) = 4Mg(NO3)2 + N2O + 5H2O
5) 2Al + 6H2SO4 = Al2(SO4)3 + 3SO2 + 6H2O
6) Ca + 2CH3COOH = (CH3COO)2Ca + H2
19. Химические свойства Al
в) амфотерный металл Al взаимодействует со щелочами:2Al + 2NaOH+ 6H2O = 2Na[Al(OH)4] + 3H2
( NaOH в недостатке)
(тетрагидроксоалюминат натрия)
2Al + 6NaOH + 6H2O = 2Na3[Al(OH)6] + 3H2 (NaOH в избытке )
(гексагидроксоалюминат натрия )
г) взаимодействие Al с солями:
Более активный металл вытесняет менее активный, например:
Al + СuCl2 = AlCl3 + Cu
Расставьте коэффициенты и напишите полные и
сокращенные ионные уравнения
20. Проверка самостоятельной работы
Расставьте коэффициенты и напишите полные исокращенные ионные уравнения:
2Al + 3СuCl2 = 2AlCl3 + 3Cu
2Al0 + 3Сu2++ 6Cl- = 2Al3+ + 6Cl- + 3Cu0
2Al0 + 3Сu2+ = 2Al3+ + 3Cu0
21. Химические свойства Al
д) Взаимодействие Al с оксидами : (алюминотермия)Вследствие высокой химической активности Al используют в
качестве восстановителя в металлургии.
Расставьте коэффициенты с помощью электронного баланса для
данного уравнения.
Al + Fe2O3 = Al2O3 + Fe + Q
Фильм № 6
22. Проверка самостоятельной работы
Cоставьте электронный баланс для данного уравнения.2Al0 + Fe2+3O3-2 = Al2+3O3-2 + 2Fe0
Al0 - 3е = Al+3 1 ( Восстановитель, пр. окисления )
Fe +3+ 3е =Fe 0 1 ( Окислитель, пр. восстановления )
23. Качественная реакция на ион Al 3+
Задание 1. Самостоятельно допишите и составьте для данныхуравнений реакций полные и сокращенные ионные уравнения.
1. AlCl3 + ? = Al(OH)3 + ?
Al(OH)3 - Белый студенистый осадок, который в
кислотах растворяется.
Al(OH)3 + HCl= ?+?
Al(OH)3 + KOH= ?+?
Фильм № 7
Al(OH)3 входит в состав адсорбирующего и обволакивающего
средства, применяется при язве желудка, гастритах. Некоторые
соли Al 3+ применяются при кожных заболеваниях.
24. Проверка самостоятельной работы
1. AlCl3 + 3NaOH = Al(OH)3 + 3NaClAl3+ + 3Cl- + 3Na++ 3OH- = Al(OH)3 + 3Na++ 3ClAl3+ + 3OH- = Al(OH)3 Белый студенистый осадок
2. Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + 3H+ + 3Cl- = Al3+ + 3Cl- + 3H2O
Al(OH)3 + 3H+ = Al3+ + 3H2O Белый студенистый осадок в
кислотах растворяется.
3. Al(OH)3 + 3KOH = K3[Al(OH)6]
Al(OH)3 + 3K++ 3OH- = 3K+ + [Al(OH)6]Al(OH)3+ 3OH- = [Al(OH)6]- Белый студенистый осадок в
щелочах растворяется.
25. Получение алюминия
Немецкий учёный Ф. Велер (1827 г.)получил алюминий при нагревании
хлорида алюминия со щелочными
металлами калий и натрий.
А.Сент-Клер Девиль. Впервые
получил алюминий промышленным
способом (1855г.).
Al получают электролизом его оксида в расплаве криолита.
Задание.Cоставьте электронный баланс для данного уравнения.
Электролиз расплава «глинозема - Al2O3 »:
2Al2O3 = 4Al+3O2
26. Проверка самостоятельной работы
Задание. Cоставьте электронный баланс для данногоуравнения.
А) Электролиз расплава «глинозема - Al2O3 »: 2Al2O3 = 4Al + 3O2
2Al2+3O3-2 = 4Al0+3O20
( -К:) Al+3+3е = Al0 4 ( пр. восстановления)
( +A:) 2O-2- 4е = O20 3 ( пр.окисления)
27.
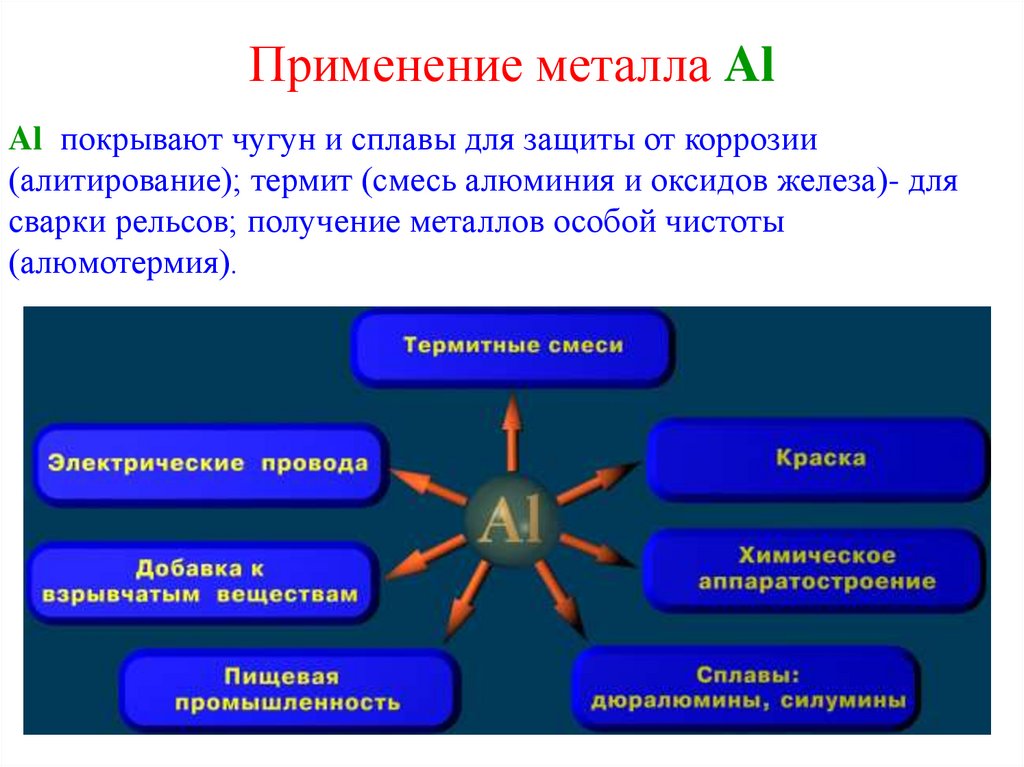
28. Применение металла Al
Al покрывают чугун и сплавы для защиты от коррозии(алитирование); термит (смесь алюминия и оксидов железа)- для
сварки рельсов; получение металлов особой чистоты
(алюмотермия).
29. Применение металла Al и его соединений
Сплавы но основе Al применяются в ракетной технике, в авиа-,авто-, судо- и вагоностроении. В строительстве (алюминиевые
кровли, оконные переплеты.)В электротехнике для изготовления
кабелей и проводов. В пищевой промышленности и в быту: фольга,
посуда. Al «серебряная» краска. В производстве различных
предметов воинского снаряжения (котелки, фляги). Al2O3 - в часовых
механизмов, ювелирные изделия. KAl(SO4)2 - в медицине как
кровоостанавливающее средство, при дубление кожи. Al2(SO4)3 очистка водопроводной воды.
30. Применение алюминия и его соединений
31. Биологическая роль Al
Несмотря на наличие громадных количеств Al в почвах, растениякак правило, содержит мало этого элемента. Еще значительно
меньше его содержится в животных организмах. У человека оно
составляет лишь десятичные доли процента по массе.
Накапливается в организме с ежедневным приемом пищи. Играет
роль в развитии болезни Альц – Мейера. Токсическая доза 5 г. Не
безобиден Al - он обладает нейротоксическим действием:
нарушает двигательную активность, вызывает судороги, снижение
памяти, некоторые психические реакции подобие слабоумия.
Имеются данные о его мутагенной активности.
32. Закрепление темы
1. Почему Al посуда не разрушается кипяченой водой?1-й ряд.
2. Целесообразно ли хранить раствор стиральной соды Na2CO3,а
также продукты молочнокислого брожения в Al посуде? Ответ
подтвердите уравнениями реакций.
2-й ряд.
3. При хранении в алюминиевой посуде кислые щи
приобретают неприятный «металлический» привкус. С каким
химическим процессом это связано? 3-й ряд.
Д/задание. Составьте уравнения реакций следующих превращений:
Al2O3 AlCl3 Al(OH)3 К[Al(OH)4]
Al(OH)3
Al2O3
NaAlO2.
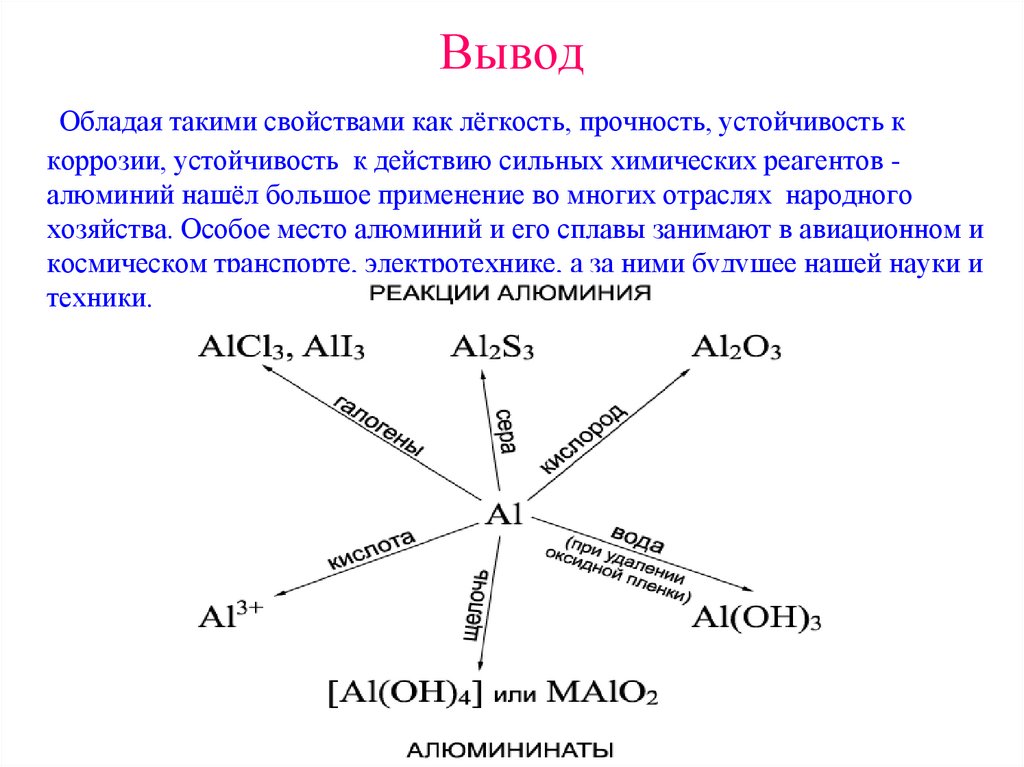
33. Вывод
Обладая такими свойствами как лёгкость, прочность, устойчивость ккоррозии, устойчивость к действию сильных химических реагентов алюминий нашёл большое применение во многих отраслях народного
хозяйства. Особое место алюминий и его сплавы занимают в авиационном и
космическом транспорте, электротехнике, а за ними будущее нашей науки и
техники.































 Химия
Химия








