Похожие презентации:
Карбоновые кислоты
1.
Карбоновые кислоты2.
Карбоновые кислоты – это органическиевещества, в молекулах которых имеется
одна или несколько карбоксильных групп –
СООН, связанная с радикалом предельного
углеводорода.
3.
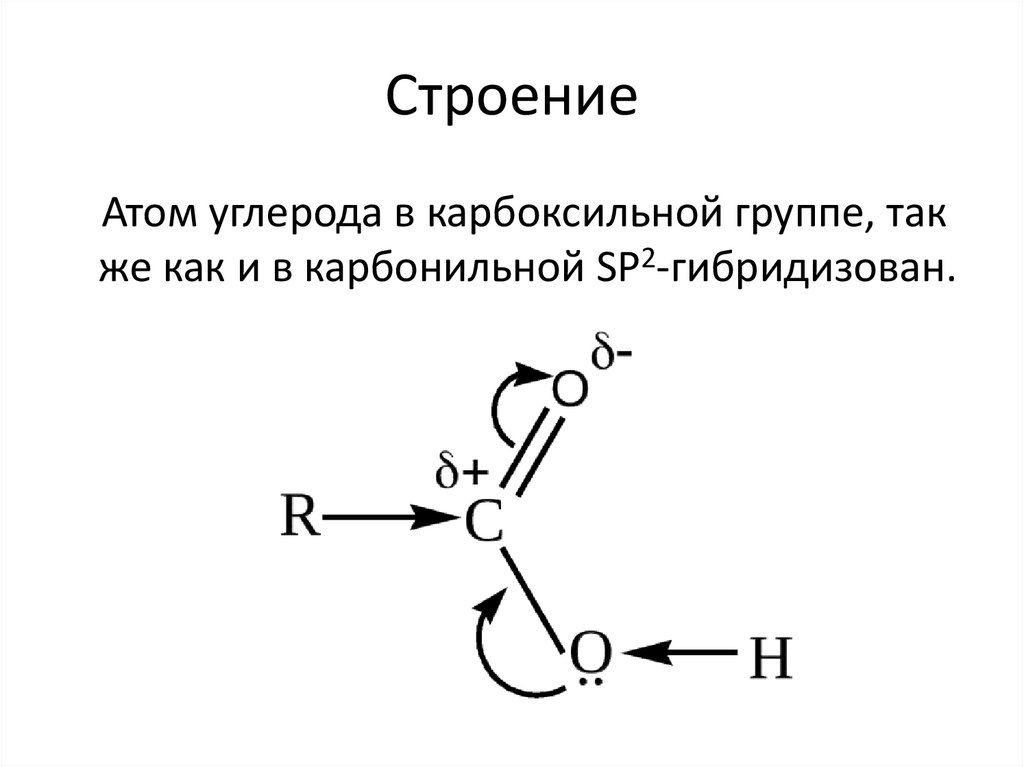
СтроениеАтом углерода в карбоксильной группе, так
же как и в карбонильной SP2-гибридизован.
4.
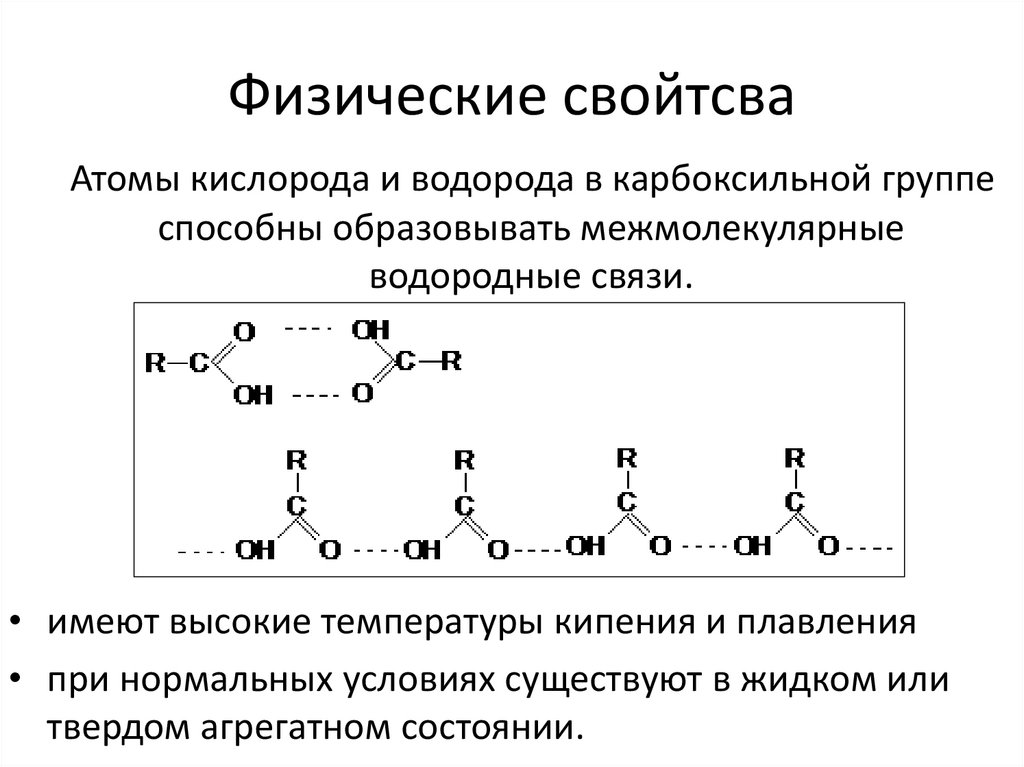
Физические свойтсваАтомы кислорода и водорода в карбоксильной группе
способны образовывать межмолекулярные
водородные связи.
• имеют высокие температуры кипения и плавления
• при нормальных условиях существуют в жидком или
твердом агрегатном состоянии.
5.
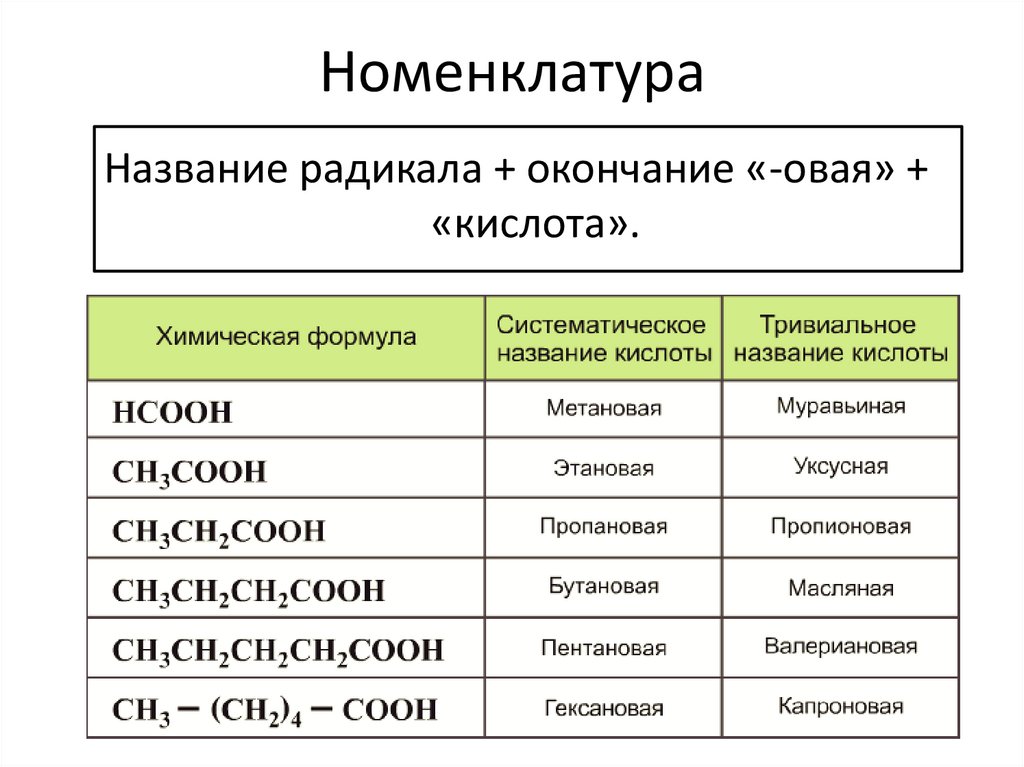
НоменклатураНазвание радикала + окончание «-овая» +
«кислота».
6.
Изомерия• Изомерия углеродного скелета.
Бутановая (масляная) кислота
2-метилпропановая (изомасляная)
кислота
• Межклассовая изомерия со сложными
эфирами.
7.
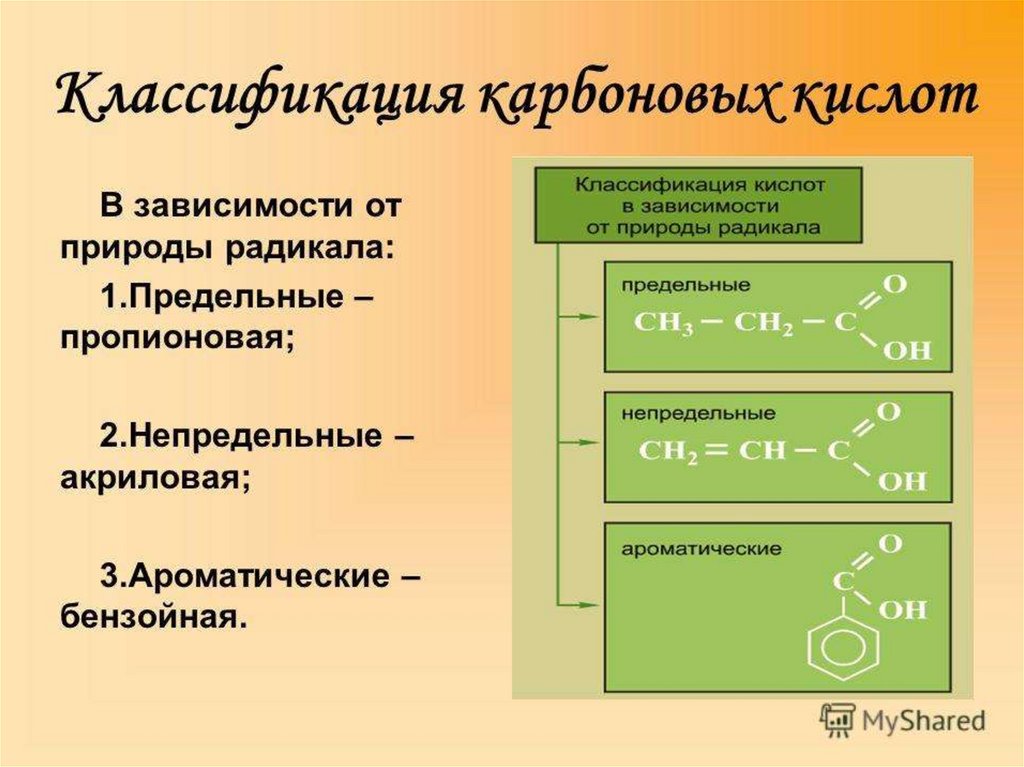
КлассификацияВ зависимости от строения углеводородного
радикала (R):
• предельные (насыщенные): пентановая,
пальмитиновая, стеариновая.
• непредельные (ненасыщенные): линолевая,
линоленовая, олеиновая.
• Ароматические: бензойная
8.
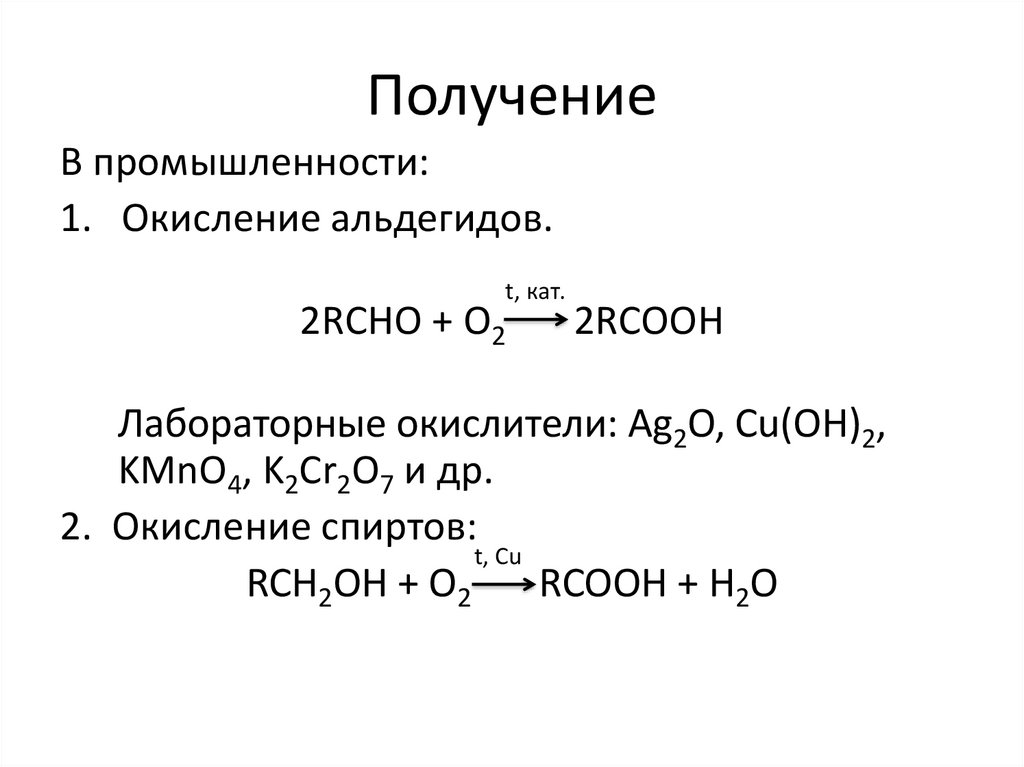
ПолучениеВ промышленности:
1. Окисление альдегидов.
t, кат.
2RCHO + O2
2RCOOH
Лабораторные окислители: Ag2O, Cu(OH)2,
KMnO4, K2Cr2O7 и др.
2. Окисление спиртов:
t, Cu
RCH2OH + O2
RCOOH + H2O
9.
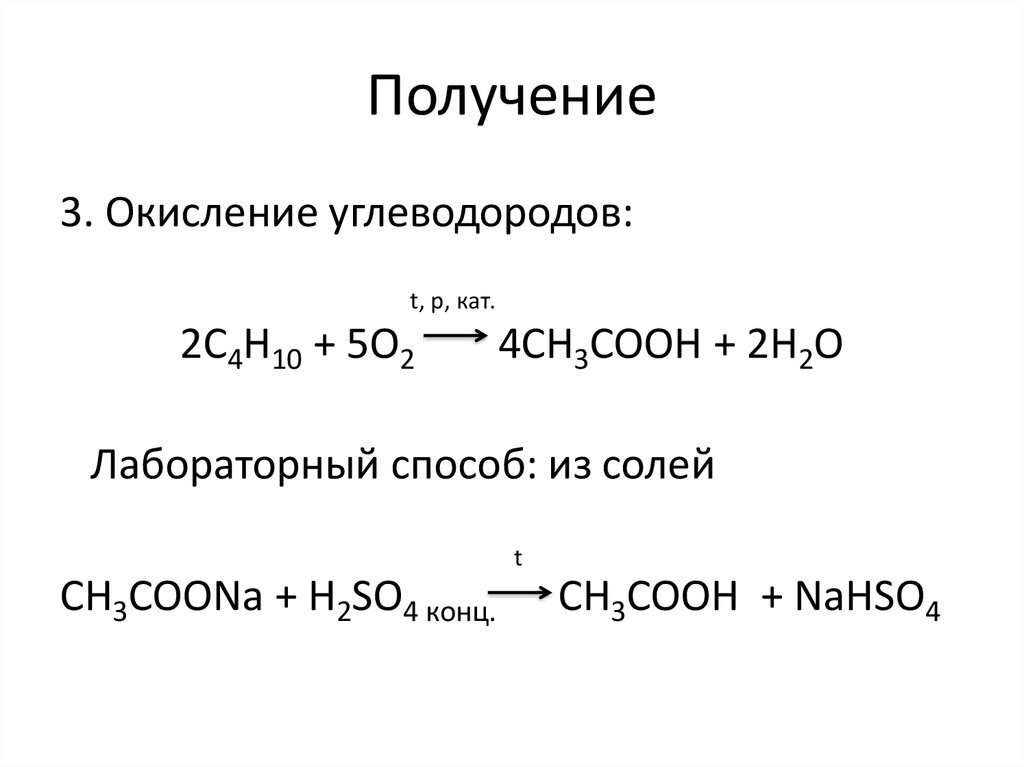
Получение3. Окисление углеводородов:
t, p, кат.
2C4H10 + 5O2
4CH3COOH + 2H2O
Лабораторный способ: из солей
t
CH3COONa + H2SO4 конц.
CH3COOH + NaHSO4
10.
Химические свойствакарбоновых кислот
11.
Сила кислот• С увеличением числа атомов углерода сила
кислот убывает:
HCOOH
CH3COOH
C2H5COOH
• Введение атомов галогена в углеводородный
радикал приводит к возрастанию силы
кислоты:
CH3COOH
уксусная
кислота
CH2ClCOOH
CHCl2COOH
CCl3COOH
монохлоруксусная
кислота
дихлоруксусная
кислота
трихлоруксусная
кислота
12.
Химические свойства1. Горение
CH3COOH + 2O2
2CO2 + 2H2O
13.
2. Кислотные свойства.Карбоновые кислоты проявляют все свойства,
присущие слабым неорганическим
кислотам:
А. диссоциируют в воде:
HCOOH
HCOO- + H+
*Все карбоновые кислоты - слабые
электролиты.
14.
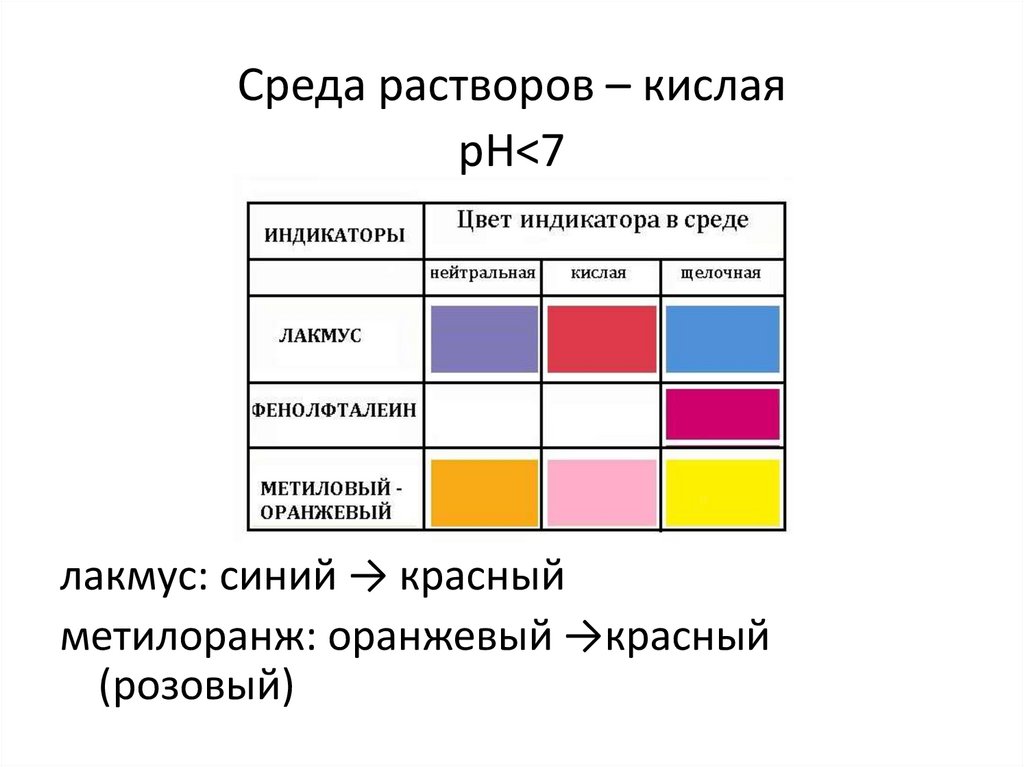
Среда растворов – кислаярН<7
лакмус: синий → красный
метилоранж: оранжевый →красный
(розовый)
15.
Б. С металлами до водорода:Mg + 2CH3COOH
(CH3COO)2Mg + H2
В. С основными оксидами:
CaO + 2CH3COOH
(CH3COO)2Ca + H2O
Г. С основаниями:
NaOH + CH3COOH
CH3COONa + H2O
Д. С солями более слабых кислот:
K2CO3 + 2CH3COOH
2CH3COOK + H2O + CO2
(качественная реакция!)
16.
3. Этерификация (образование сложногоэфира):
17.
Химические свойстваВ реакцию этерификации могут вступать и
многоатомные спирты, например,
глицерин.
18.
4. Замещение в углеводородном радикале:5. С аммиачным раствором оксида серебра
(только муравьиная кислота!)
t
HCOOH + Ag2O(аммиачный раствор)
CO2 + H2O + 2Ag
19.
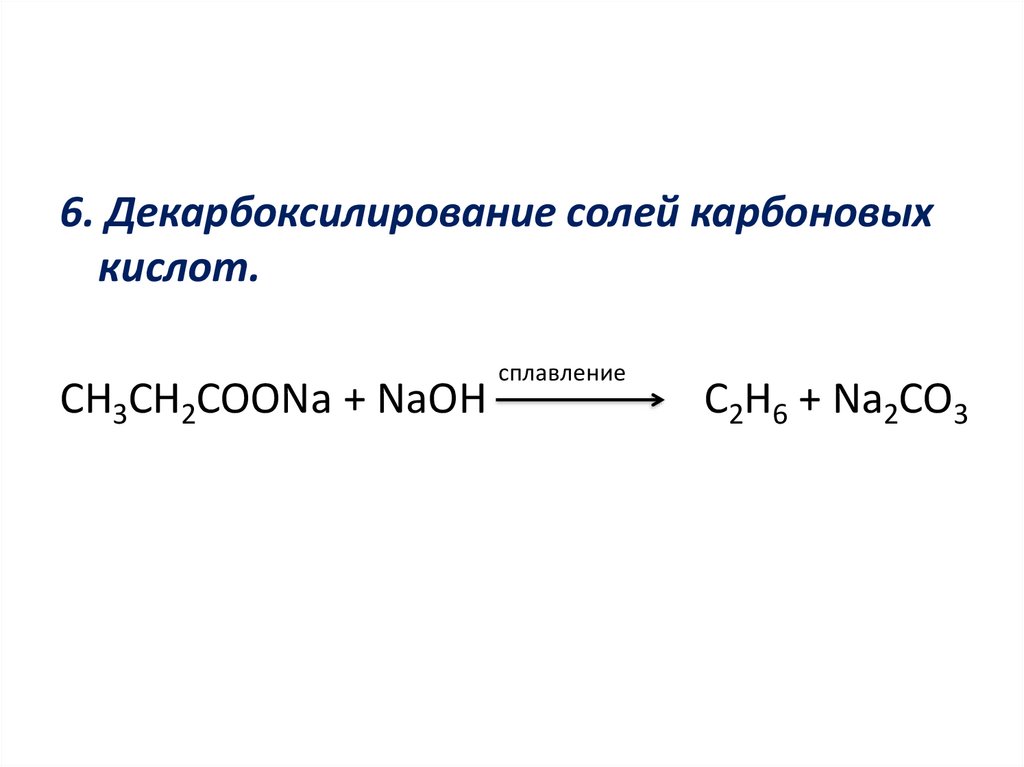
6. Декарбоксилирование солей карбоновыхкислот.
CH3CH2COONa + NaOH
сплавление
C2H6 + Na2CO3
20.
Закрепление материала1)Олеиновая кислота:
а. предельная одноосновная
б. предельная двухосновная
в. предельная одноосновная
г. непредельная двухосновная
21.
Закрепление материала2) Изомером пентановой кислоты является:
а. диэтиловый эфир
б. пропилацетат
в. пентаналь
г. этилацетат
22.
Закрепление материала3) В отличии от уксусной муравьиная кислота
а. вступает в реакцию со щелочью
б. образует сложные эфиры со спиртами
в. вступает в реакцию с аммиачным
раствором оксида серебра
г. реагирует с кальцием
23.
Домашнее задание• Параграф 26
• Задача: Определите молекулярную формулу
карбоновой кислоты, если известно, что в ее
состав входит 4,35 % водорода, 26,09% углерода и
69,56% кислорода.
• Презентация о лимонной, молочной, бензойной
или ацетилсалициловой кислоте.
- Формула
- Получение
- Нахождение в природе
- Применение в медицине и промышленности















 Химия
Химия