Похожие презентации:
Константа равновесия гомогенной системы
1.
Домашнее заданиеЗадача1: Константа равновесия гомогенной
системы: СО(г) + Н2О(г) = СО2(г) + Н2(г)
при 850оС равна 1. Вычислите концентрации всех
веществ при равновесии, если исходные
концентрации: [СО]исх =3 моль/л, [Н2О]исх = 2
моль/л. (Обратите внимание: даны исходные
концентрации, а не равновесные).
Задача2: Эндотермическая реакция разложения
пентахлорида фосфора протекает по уравнению:
PCl5(г) = РСl3(г) + Сl(г) + Q
Как надо изменить: а) температуру; б) давление; в)
концентрацию, чтобы сместить равновесие в
сторону прямой реакции – разложения PCl5?
2.
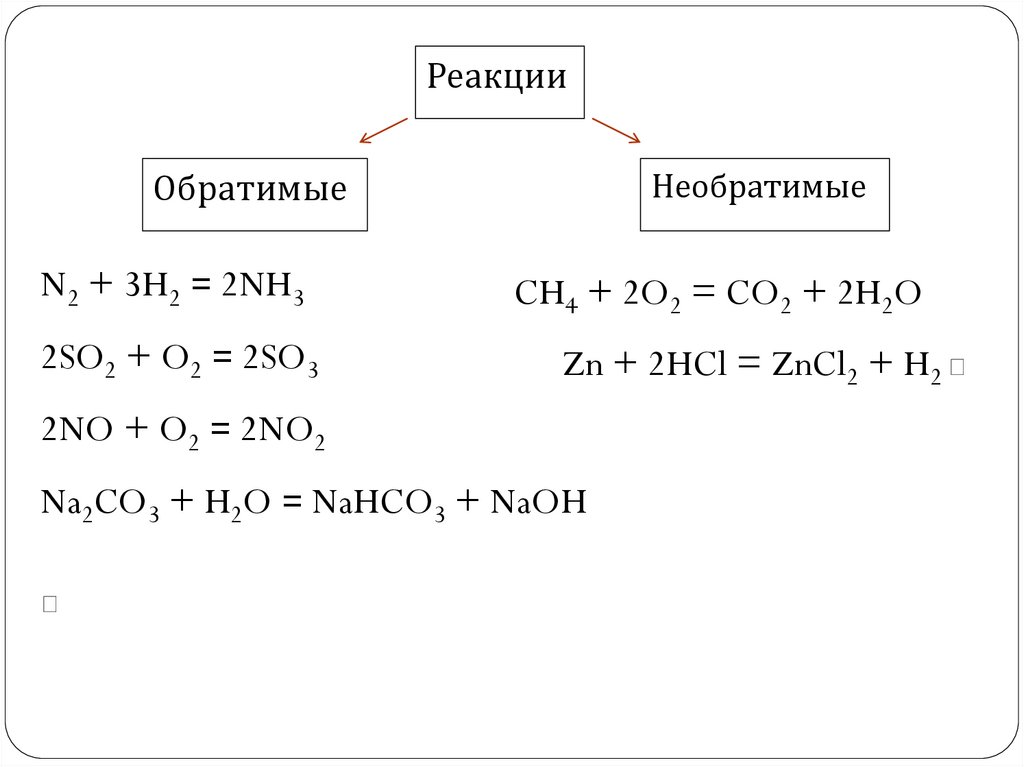
РеакцииОбратимые
N2 + 3H2 = 2NH3
2SO2 + O2 = 2SO3
Необратимые
CH4 + 2O2 = CO2 + 2H2O
Zn + 2HCl = ZnCl2 + H2
2NO + O2 = 2NO2
Na2CO3 + H2O = NaHCO3 + NaOH
3.
Какие реакции называютобратимыми?
Каковы признаки
необратимых реакций?
4.
Какие из предложенных реакций являютсяобратимыми?
а) КОН + CuSO4 = K2SO4 + Cu(OH)2
б) CO2 + H2O = H2CO3
в) КСIO3 = KCI + O2
г) CH4 + O2 = CO2 + H2O
д) HCOOH + CH3OH = HCOOCH3 + H2O
5.
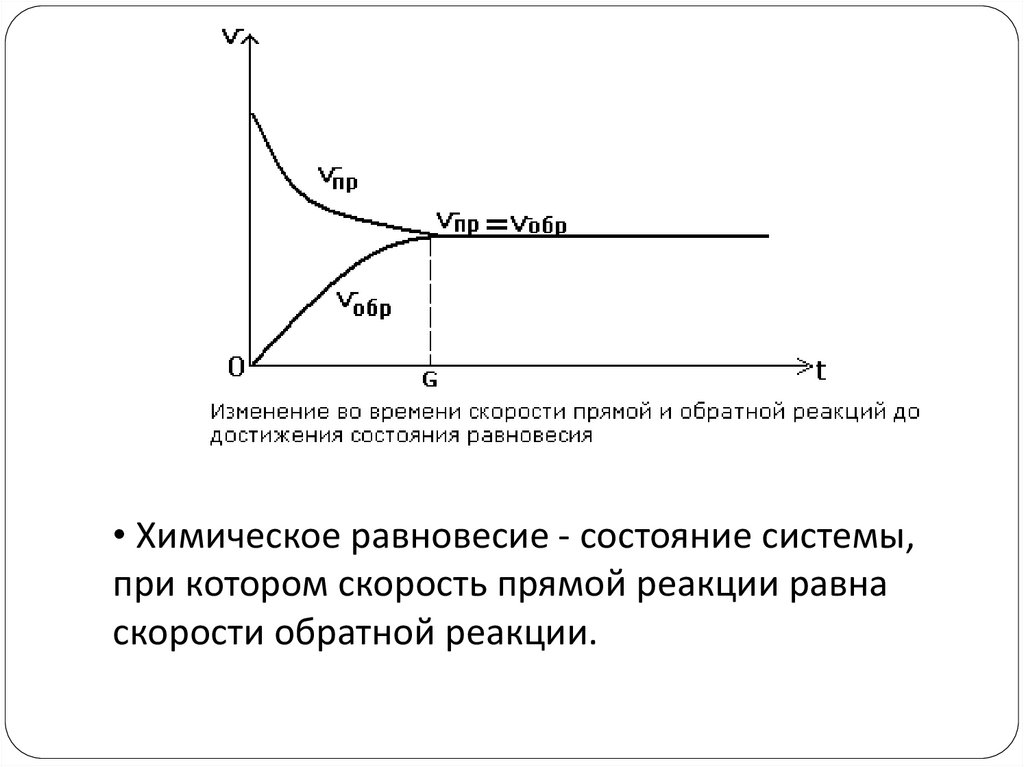
Химическое равновесие.6.
Получение оксида серы (VI) – используется впроизводстве серной кислоты (в обработке руд,
особенно при добыче редких элементов, в том числе
урана, иридия, циркония, осмия и т. п.; как
электролит в свинцовых аккумуляторах; в
производстве химических волокон и красителей; в
пищевой промышленности — зарегистрирована в
качестве пищевой добавки E513 (эмульгатор))
2SO2 + O2 ↔ 2SO3 + Q
7.
• Химическое равновесие - состояние системы,при котором скорость прямой реакции равна
скорости обратной реакции.
8.
Закон действующих масс:При равновесии отношение произведения
концентраций продуктов реакции (в степенях
их коэффициентов) к произведению
концентраций реагентов (тоже в степенях их
коэффициентов) есть величина постоянная, не
зависящая от исходных концентраций веществ
в реакционной смеси.
N2 (Г) + 3H2 (Г) ↔ 2NH3 (Г) + 92,4 кДж
9.
Константа равновесияДля выражения
N2 (Г) + 3H2 (Г) ↔ 2NH3 (Г) + 92,4 кДж
константа равновесия выражается так:
υ1 = υ2
υ1 (прямой реакции) = k1[N2][H2]3 ,
где [ ] – равновесные молярные концентрации (моль/л)
υ2 (обратной реакции) = k2 [NH3]2
k1[N2][H2]3 = k2 [NH3]2
Тогда: Kp = k1/k2 = [NH3]2/ [N2][H2]3 – константа
равновесия.
10.
Принцип Ле-ШательеЕсли на систему, находящуюся
в равновесии оказали внешнее
воздействие, то равновесие в
системе сместится в сторону
обратную этому воздействию.
11.
Влияние концентрацииA+B=C+D
[A], [B] - вправо
[A], [B] - влево
[C], [D] - влево
[C], [D] - вправо
12.
Влияние температурыN2 + 3H2 = 2NH3 +Q
t° равновесие смещается влево
t° равновесие смещается вправо
13.
Влияние давленияпри увеличении давления, равновесие
смещается в сторону образования веществ,
занимающих меньший объём, т.е. в сторону с
меньшим количеством моль газообразных
веществ.
N2 (Г) + 3H2 (Г) ↔ 2NH3 (Г)
1V
3V
2V
14.
Влияние катализатораПри использовании катализатора понижается
энергия активации как прямой, так и обратной
реакции на одну и ту же величину и поэтому
равновесие не смещается.
15.
Задача 12SO2 (г) + O2 (г) = 2SO3 (г) + Q
Куда сместится равновесие, если
а) увеличить давление
б) повысить температуру
в) увеличить концентрацию кислорода













 Химия
Химия








