Похожие презентации:
Молекулярно-кинетическая теория
1. Молекулярно -кинетическая теория
Молекулярно кинетическая теорияОсновные положения
10 класс
2. Основные положения М К Т
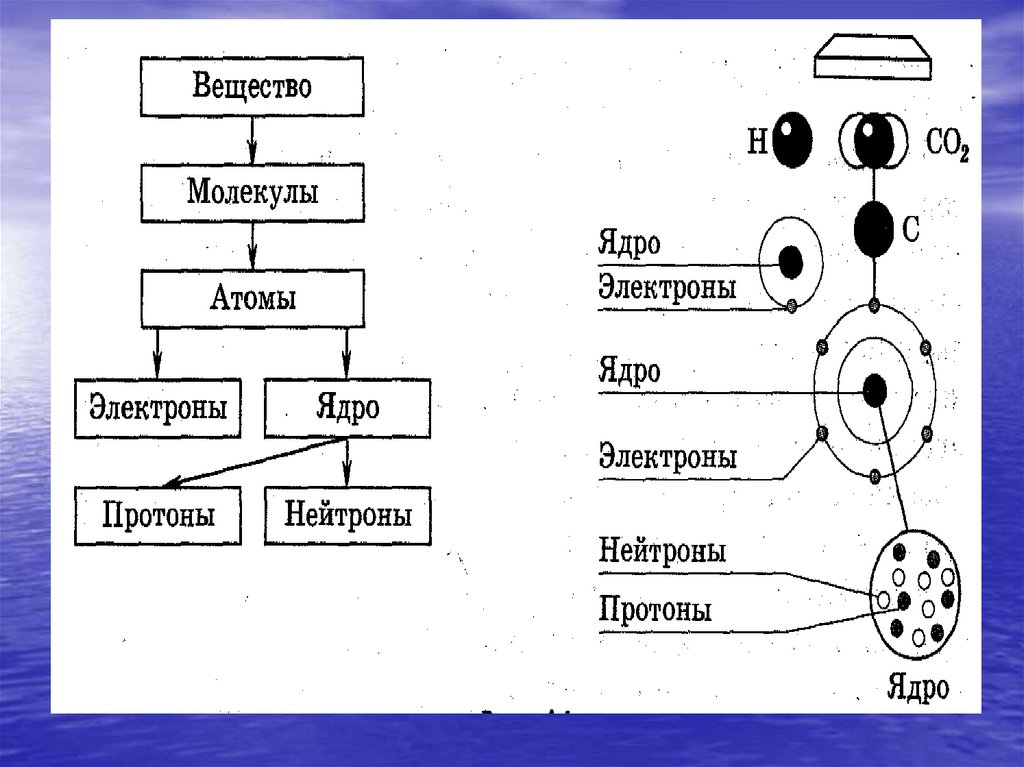
• Все тела состоят из частиц-молекул,атомов, ионов, в состав которых входят
более мелкие элементарные частицы;
• Атомы, молекулы и ионы находятся в
непрерывном хаотическом движении;
• Между частицами существуют силы
взаимодействия-притяжения и
отталкивания.
3.
4. Демокрит считал :
• Ничего не существует кроме атомов ипустого пространства; всё прочее –
мнение.
• Атомы бесконечны в числе и
бесконечно различны по форме…
5. Галилей, Декарт, Ньютон, Ломоносов считали, что материя состоит из мельчайших неделимых частиц и назвали их корпускулами или
атомами.Количественное обоснование
атомистической теории было дано
Джоном Дальтоном (англ.), Жозефом
Луи Гей-Люссаком (фран.) и Амедео
Авогадро (итал.)
6.
• 1803г. Дальтон –закон кратных отношений: еслипростое вещество А соединяется с простым
веществом В, образуя новые вещества С, Д, …, то при
постоянной массе вещества А отношение масс
вещества В в различных продуктах реакции
составляет малые целые числа.
• 1808г. Гей-Люссак экспериментально установил
закон кратных отношений для химически
взаимодействующих газов. Объёмы газов,
вступающих в химические соединения, при
одинаковых значениях давления и температуры,
относятся как целые числа. Например: 1:2, 1:3 или
2:3. В равных объёмах любых газов при одинаковых
условиях находится одинаковое число частиц.
7.
• 1811г. Авогадро:формулирует 2 принципа
1. Все вещества, простые и сложные,
образованы из молекул, которые сами
состоят из атомов.
2. В равных объёмах любых газов при
одинаковых условиях содержится одно и
тоже число молекул. (Закон Авогадро.)
8. Измерение масс атомов и молекул
Единица массы атомов и молекул – 1/12 массыатома изотопа углерода 12С (с массовым числом 12).
1 а.е.м. = 1,66 * 10-27 кг
Относительная масса атомов и молекул
показывает, во сколько раз масса атомов и
молекул данного вещества больше 1/12
массы атома углерода 12С.
9. Количество вещества
• Вещество имеет дискретную структуру: оносостоит из мельчайших частиц, называемых
структурными элементами.
Единица количества вещества называется
моль.
1 моль = количеству вещества системы,
содержащей столько же структурных
элементов (частиц), сколько атомов
содержится в 0,012кг углерода 12С.
10.
• Диффузия – это физическое явлениевзаимного проникновения молекул одного
вещества между молекулами другого
вещества.
• Броуновское движение – это движение
мельчайших частиц вещества, взвешенных в
жидкости или газе. (1827г, англ. ботаник
Р.Броун)
• Факт существования броуновского движения
свидетельствует о дискретном строении
вещества и беспорядочном движении
молекул.
11.
• Пример решения задачи:• За 20 суток из стакана полностью
испарилось 0,2кг воды. Сколько в
среднем молекул вылетало с
поверхности воды?
12. ЗАДАНИЯ
1. Какое количество веществасодержится в 200г воды?
2. Найдите число молекул в 2кг
углекислого газа.












 Химия
Химия








