Похожие презентации:
Молекулярно-кінетична теорія ідеального газу
1. Молекулярно-кінетична теорія ідеального газу
2.
Основне рівняння молекулярно-кінетичної теоріїідеального газу для тиску.
Середня кінетична енергія молекул.
Молекулярно-кінетичне тлумачення абсолютної
температури.
Середнє число зіткнень і середня довжина
вільного пробігу молекул.
Закон рівномірного розподілу енергії за
ступенями вільності молекул.
Внутрішня енергія ідеального газу.
3.
Молекулярна фізика і термодинаміка – розділи фізики, в яких вивчаютьсямакроскопічні процеси в тілах, що зв’язані з великою кількістю атомів і
молекул, з яких складаються тіла.
Для дослідження цих процесів використовують два методи: статистичний
(молекулярно-кінетичний) і термодинамічний.
Молекулярна фізика вивчає будову і властивості речовини, виходячи з
молекулярно-кінетичних уявлень про те, що всі тіла складаються з
атомів і молекул, які перебувають у неперервному тепловому русі.
Термодинаміка – розділ фізики, що вивчає загальні властивості
макроскопічних систем, що знаходяться в стані термодинамічної
рівноваги, і процеси переходу між цими станами.
Термодинамічна система – сукупність макроскопічних тіл, які
взаємодіють і обмінюються енергією як між собою, так і з іншими
тілами.
4.
У молекулярно-кінетичній теорії користуються моделлю ідеального газу,що задовольняє такі умови:
1) власний об’єм молекул газу нехтовно малий порівняно з об’ємом
посудини;
2) між молекулами газу відсутні сили взаємодії;
3) зіткнення молекул газу між собою і з стінками посудини абсолютно
пружні.
Основне рівняння молекулярно-кінетичної теорії ідеального газу для
тиску:
1
2
p mo n ср
.кв
3
Величина vср.кв. називається середньою квадратичною швидкістю.
ср.кв
2
n
i i
i
n
3kT
ср.кв .
mo
5. Середня кінетична енергія молекул
2 mo cр.кв 2p n
n к
3
2
3
2
RT kN AT
p
knT
Vm
Vm
mo 3kT 3
к
kT
2 mo
2
Отже, середня кінетична енергія поступального руху
молекул ідеального газу залежить тільки від його
абсолютної температури, <εк> прямо пропорційна до Т.
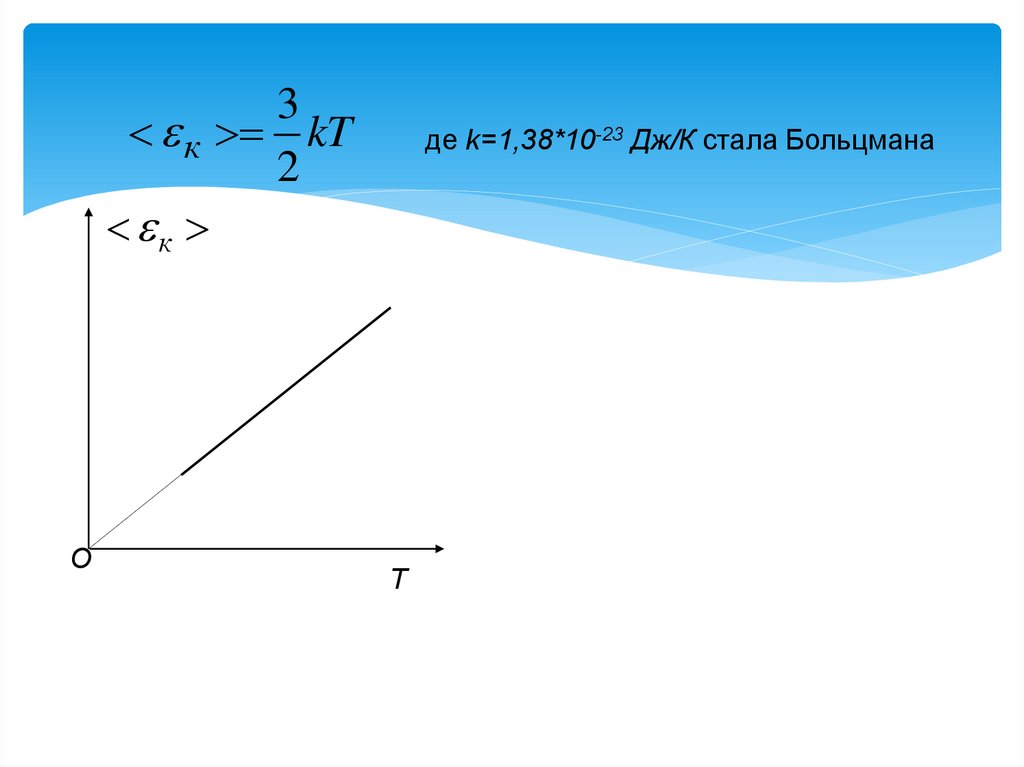
6. Абсолютна температура є міра середньої кінетичної енергії поступального руху молекул.
3к kT
2
к
де k=1,38*10-23 Дж/К стала Больцмана
Абсолютна температура є
міра середньої кінетичної
енергії поступального руху
молекул.
О
Т
7. Середнє число зіткнень і середня довжина вільного пробігу молекул.
Мінімальна відстань, на яку зближуютьсяпри зіткненні центри двох молекул,
називається ефективним діаметром
молекули.
Середнє число зіткнень молекули за
одиницю часу дорівнюватиме:
де n - концентрація молекул.
Середня відстань між послідовними
зіткненнями молекули називається
середня довжина вільного пpoбiгу
d
d
z d n
2
kT
2 d p
2
8. Закон рівномірного розподілу енергії за ступенями вільності молекул.
Числом ступенів вільності називають найменше число координат, якінеобхідно задати для того, щоб повністю визначити положення тіла у
просторі, або кількість незалежних рухів, які може виконувати тіло.
Молекула одноатомного газу, що довільно рухається у просторі, має
три ступені вільності (x,y,z).
Молекула двоатомного газу має п'ять ступенів вільності (три ступені
вільності будуть поступальними, а дві – обертальними навколо осей )
Триатомна і багатоатомні нелінійні молекули мають 6 ступенів
вільності – 3 поступальних і 3 обертальних
9.
kT2
Закон Больцмана про рівномірний розподіл енергій за ступенями
вільності молекул:
Для статичної системи, що перебуває у стані термодинамічної
рівноваги, на кожний поступальний і обертальний ступінь вільності
припадає в середньому кінетична енергія, що дорівнює kT/2, а на
кожний коливний ступінь вільності – в середньому енергія kT.
i
kT
2
i iпост. iоб 2iкол
10. Внутрішня енергія ідеального газу.
Внутрішня енергія – це енергія хаотичного (теплового) рухумікрочастинок системи (молекул, атомів, електронів, ядер і тощо) і
енергія взаємодії цих частинок.
До внутрішньої енергії не належать кінетична енергія системи як
цілого і потенціальна енергія системи у зовнішніх полях.
Для моля ідеального газу внутрішня енергія дорівнює сумі кінетичних
енергій молекул:
i
i
U m kTN A RT
2
2
i
i m
U v RT
RT
2
2
11. Перший закон термодинаміки
Теплота, надана системі, витрача¬єть¬ся на збільшення її внутрішньоїенергії і на виконання системою роботи проти зов¬ніш¬ніх сил.
dQ dU dA
Другий закон термодинаміки
1.
2.
Теплота ніколи не може переходити сама собою від тіл з нижчою
температурою до тіл з вищою температурою.
Неможливо побудувати та¬ку періодично діючу теплову машину,
яка, отримавши ззовні деяку кількість теп¬ло¬ти при довільній
температурі, цілком пе¬ре¬творювала би її в механічну роботу і
при цьо¬му поверталась би точно у вихідний стан.
12.
Теплоємністю тіла називається фізич¬а величина, яка числовоQ
дорівнює кількості теплоти, яку потрібно надати тілу, щоб
CT
dT
підвищити його температуру на один кельвін:
Питомою теплоємністю називається фізична величина, що
числово дорівнює кількості теплоти, яку слід надати одиниці
Q
маси цієї речовини для підвищення її температури на 1 К:
c
m dT
Молярною теплоємністю називається фізична величина, яка
числово дорівнює кількості теплоти, яку треба надати одному
Q
молю речовини для підвищення його температури на 1К:
C
dT
Рівняння Маєра
C p CV R
i
CV R
2
Cp
i
i 2
R R
R
2
2











 Физика
Физика








