Похожие презентации:
Электротехнические и конструкционные материалы
1.
ЭЛЕКТРОТЕХНИЧЕСКИЕИ КОНСТРУКЦИОННЫЕ
МАТЕРИАЛЫ
Раздел 6. Конструкционные
материалы
2. Рекомендуемая литература
1. Материаловедение: Учебник для вузов / Б.Н. Арзамасов, В.И.Макарова, Г.Г. Мухин и др. Под общей редакцией Б.Н. Арзамасова, Г.Г.
Мухина – 3-е изд., перераб. и доп. – М: Изд-во МГТУ им. Н.Э. Баумана,
2001. – 648 с., ил.
2. Третьяков А.Ф., Тарасенко Л.В. Материаловедение и технология
обработки материалов - М.: Изд-во МГТУ им. Н.Э. Баумана, 2014.–541 с.
3. Колесов, С.Н. Материаловедение и технология конструкционных
материалов: Учебник для вузов/ С.Н. Колесов, И.С. Колесов. - М.: Высшая
школа, 2010. - 519 с.: ил.
4. Пейсахов, А.М. Материаловедение и технология конструкционных
материалов: Учебник/ А.М. Пейсахов, А.М. Кучер. - 3-е изд. - СПб.:
Михайлов, 2005. - 416 с.: ил. – (Высшее профессиональное образование).
5. Технология конструкционных материалов: методическое
руководство к лабораторным работам/ С.П. Шатило, М.С. Бахарев, Г.Ф.
Бабюк; Под общей ред. С.П. Шатило. - Нижневартовск: Нижневартовский
гос. Гуманитарный университет, 2006. - 157 с.: ил. и др.
6. Материаловедение и технология конструкционных материалов.
Учебник. 2-е издание. – СПб.: Изд-во Михайлова В.А., 2004 г. – 407 с.
1
3.
ВведениеВВЕДЕНИЕ
Разнообразие свойств конструкционных
материалов (КМ) является главным фактором,
их широкое применение в технике.
Свойства КМ зависит от особенностей
внутреннего строения материала. В связи с этим
в этом разделе занимаемся изучением строения
материала в тесной связи с их свойствами.
Основные свойства материалов можно
подразделить на:
физические,
механические,
технологические,
эксплуатационные.
2
4.
ВведениеОт физических и механических свойств зависят
технологические и эксплуатационные свойства
материалов.
Среди механических свойств прочность занимает
особое место, так как прежде всего от нее зависит
не разрушаемость изделий под воздействием
эксплуатационных нагрузок.
Учение о прочности и разрушении является одной из
важнейших составных частей материаловедения.
Оно является теоретической основой для выбора
подходящих КМ для деталей различного целевого
назначения и поиска рациональных способов
формирования в них требуемых прочностных свойств
для обеспечения надежности и долговечности изделий.
3
5.
ВведениеОсновными материалами, используемыми в
машиностроении, являются металлы и их сплавы.
Главное в ТКМ – это учение о связи между
строением и свойствами металлов и сплавов.
В развитии ТКМ, ведущую роль сыграли российские
ученые: Аносов П.П., Чернов Д.К., Курнаков Н.С.,
Гуляев А.П. и другие.
В группу КМ входить не только металлы и сплавы, но и
неметаллические материалы, включая полимерные.
Они имеют самое широкое применение в науке и
технике, промышленности, строительстве и обладают
еще электрических, магнитных и ряд других физикохимических свойств, которые широко используют и в
электротехнике и радиотехнике.
4
6. Введение
В лекциях КМ более подробноостановимся на таких широко
используемых КМ, как
углеродистые и легированные
стали.
5
7.
Введение 1Целью преподавания КМ является
научить инженеров применять основные
методы управления конструкционной
прочностью материалов и проводить
обоснованный выбор материала для
изделий с учетом условий их
эксплуатации.
6
8. Введение
При изучении КМ студентам необходимознание следующих понятий:
Нагрузка;
Напряжение;
Деформация упругая и пластическая;
Работа и энергия;
Агрегатное состояние вещества;
Термодинамическая система и их параметры;
Внутренняя энергия;
Атомно-кристаллическое строение металлов;
Типы связей частиц в твердом теле;
Основные физические свойства металлов.
7
9. Введение 2
2. Краткие исторические сведения о развитии КМКак наука материаловедение КМ насчитывает
около 200 лет, несмотря на то, что человек
начал использовать металлы и сплавы ещё за
несколько тысячелетий до нашей эры.
Только в XVIII веке появились отдельные научные
результаты, позволяющие говорить о начале
осмысленного изучения всего того, что накопило
человечество за всё время использования металлов.
Французский учений Реомюр (1683-1757) в 1722 году
провёл исследование строения зёрен в металлах.
Англичанин Григнон в 1775 году обнаружил
образование столбчатую структуру (дендрита) при
медленном затвердевании железа.
8
10. Введение
В России первым, кто начал научно осмысливатьпроблемы металлургии и литейного дела, был М.В.
Ломоносов. Им написано учебное руководство
«Первые основания металлургии рудных дел».
Заметных успехов металловедение достигло лишь в XIX
веке, что связано в первую очередь с использованием
новых методов исследования структуры металла.
В 1831 году П.П. Аносов (1799-1851) провёл исследование
металла на полированных и протравленных шлифах,
впервые применив микроскоп для исследования стали.
Значительный вклад в развитие металловедения внесли
работы русского учёного-металлурга П.П. Аносова (17991851), английских ученых Сорби и Роберта Аустена (18431902), немца А. Мартенса (1850-1914), Трооста и
американца Э. Бейна (1891-1974).
9
11. Введение
Каждый из них в своё время, рассматривая подмикроскопом и фотографируя структуры, установили
существование структурных превращений в сталях
при их непрерывном охлаждении.
В 1873-1876 г.г Гиббс изложил основные законы фазового
равновесия и, в частности, правило фаз, основываясь на
законах термодинамики.
Создание научных основ металловедения по праву
принадлежит Чернову Д.К. (1839 – 1903), который установил
критические температуры фазовых превращений в сталях
и их связь с количеством углерода в сталях.
Этим были заложены основы для важнейшей в
металловедении диаграммы состояния железоуглеродистых сплавов. Критические точки в стали, позволили
выбирать температуру ее закалки, отпуска.
10
12. Введение
Разработка в 1902 году американскими учёными Ф.Тейлором и М. Уайтом быстрорежущей стали произвела
переворот в машиностроении. Резко возросла
производительность механической обработки,
появились новые быстроходные станки и автоматы.
В 1906 году немецкий исследователь А. Вильм создал
высокопрочный сплав алюминия с медью–дуралюмин,
прочность которого в несколько раз превышала
прочность технического алюминия. Использовали
дуралюмина в самолётостроении и в др. областях техники.
Немецким инженером заводов Круппа Мауэром и
профессором Штраусом в 1912 году была получена
хромоникелевая аустенитная нержавеющая сталь, а
в 1912 году Бренли – ферритная нержавеющая сталь.
11
13. Введение
ХХ век ознаменовался крупными достижениями втеории и практике материаловедения: были созданы
высокопрочные материалы для деталей и инструментов,
разработаны композиционные материалы, открыты
сверхпроводники, применяющиеся в энергетике и других
отраслях техники, открыты и использованы свойства
полупроводников. Совершенствовались способы
упрочнения деталей термической и химикотермической
обработкой.
Огромное значение для развития отечественного
материаловедения в наше время имели работы
А.А. Бочарова, Г.В. Курдюмова, В.Д. Садовского
и В.А. Каргина.
12
14. Введение
Определение атомного строения фаз стало возможнымпосле открытия Лауэ (1912 г), показавшего, что атомы в
кристалле регулярно заполняют пространство, образуя
пространственную дифракционную решетку, и что
рентгеновские лучи имеют волновую природу.
В последнее время для структурного анализа, кроме
рентгеновских лучей, используют электроны и нейтроны.
Соответствующие методы исследования называются
электронографией и нейтронографией. Электронная
оптика позволила усовершенствовать микроскопию.
В настоящее время на электронных микроскопах
полезное максимальное увеличение доведено до
100 000 раз.
13
15. Введение 3
3. Современное развитие КМ как наукиОсобенно интенсивно развивается металловедение в
последние десятилетия. Это объясняется потребностью
в новых материалах для исследования космоса,
развития электроники, атомной энергетики.
Основными направлениями в развитии металловедения
является разработка способов производства чистых и
сверхчистых металлов, свойства которых сильно
отличаются от свойств металлов технической чистоты,
с которыми преимущественно работают.
До настоящего времени основной материальной базой
машиностроения служит черная металлургия,
производящая стали и чугуны. Эти материалы имеют
много положительных качеств и в первую очередь
обеспечивают высокую конструкционную прочность
деталей машин.
14
16. Введение
Однако эти классические материалы имеют такие недостаткикак большая плотность, низкая коррозионная стойкость.
Потери от коррозии составляют 20% годового производства
стали и чугуна.
Поэтому, по данным научных исследований, через
20…40 лет все развитые страны перестроятся на
массовое использование металлических сплавов на
базе титана, магния, алюминия. Эти легкие и прочные
сплавы позволяют в 2-3 раза облегчить станки и
машины, в 10 раз уменьшить расходы на ремонт.
По данным института им. Байкова А.Н. в нашей стране есть
все условия чтобы в течении 10…15 лет машиностроение
могло перейти на выпуск алюминиево-титановой подвижной
техники, которая отличается легкостью, коррозионной
стойкостью и большим безремонтным ресурсом.
15
17. Введение
Использование новых материалов взамен традиционных(металлических) – пластмасс, керамики, материалов
порошковой металлургии, особенно композиционных
материалов, что экономит дефицитные металлы, снижает
затраты энергии на производство материалов, уменьшает
массу изделий.
Расчетами установлено, что замена ряда металлических
деталей легкового автомобиля на углепластики из
эпоксидной смолы, армированной углеродными
волокнами, позволит уменьшить массу машины на 40%;
она станет более прочной; уменьшится расход топлива,
резко возрастет стойкость против коррозии.
16
18.
ВведениеПри выборе материала большое значение имеет и
экономическая сторона.
Недостаточно выбрать высококачественный материал,
свойства которого удовлетворяют всем эксплуатационнотехническим требованиям.
Важно, чтобы это был материал отечественного
производства, недорогой, недефицитный и чтобы из него
можно было изготавливать детали и узлы с помощью
недорогих и несложных технологических процессов.
17
19.
Лекция 9Строение и свойства материалов.
1. Металлы и неметаллы. Особенности атомнокристаллического строения металлов.
2. Понятие об изотропии и анизотропии.
3. Дефекты кристаллического строения:
4. Строение материалов.
5. Типы связей.
6. Методы исследования структуры металлов и
сплавов:
18
20. Лекция 9 (продолжение – 9.2)
1. Металлы и неметаллы. Особенности атомнокристаллического строенияВсе твёрдые тела делятся на:
1. Аморфные;
2. Кристаллические.
В аморфных телах атомы расположены хаотично, т.е. в
.
беспорядке
(напр.: стекло, клей, воск, канифоль и др.
В кристаллических телах атомы расположены в строго
определённой последовательности (напр.: металлы и
сплавы, поваренную соль, кварц, сахарный песок и др.
В огромном ряду материалов, металлы всегда занимали
особое место. Металлы – один из основных классов
конструкционных материалов
19
21. Лекция 9 (продолжение – 9.3)
Из 112 химических элементов таблицы Д.И.Менделеева 83 являются металлами.
Они обладают следующих характерных свойств:
«металлический блеск» (хорошая
отражательная способность);
пластичность;
высокая теплопроводность;
высокая электропроводность.
20
22. Лекция 9 (продолжение – 9.4)
Согласно теории металлического состояния, металлпредставляет собой вещество, состоящее из
положительных ядер, вокруг которых по орбиталям
вращаются электроны.
На последнем уровне число электронов невелико и они
слабо связаны с ядром.
Эти электроны имеют возможность перемещаться по
всему объёму металла, т.е. принадлежать целой
совокупности атомов.
Т.о., пластичность, теплопроводность и
электропроводность обеспечиваются наличием
«электронного газа».
21
23. Лекция 9 (продолжение – 9.5)
Все твердые металлы представляют собойкристаллические вещества, т.е. укладка атомов в них
характеризуется определённым порядком –
периодичностью, как по различным направлениям,
так и по различным плоскостям. Этот порядок
определяется понятием кристаллическая решётка.
Кристаллическая решетка это воображаемая
пространственная решетка, в узлах которой
располагаются частицы, образующие твердое тело.
Элементарная ячейка – элемент объёма из
минимального числа атомов (многократным переносом
которого в пространстве можно построить кристалл).
Она характеризует особенности строения кристалла.
22
24. Лекция 9 (продолжение – 9.6)
· углы между осями ().
Лекция 9 (продолжение – 9.6)
Основными параметрами кристалла являются:
размеры рёбер элементарной ячейки. a, b, c – периоды
решётки – расстояния между центрами ближайших
атомов. В одном направлении выдерживаются строго
определёнными;
углы между осями α, β, γ;
координационное число Z
(число атомов, расположенных
на ближайшем одинаковом
расстоянии от любого атома в
решетке;
базис решетки (количество атомов, приходящихся на
одну элементарную ячейку решетки);
компактность структуры К (отношение объема,
занимаемого атомами, к объёму ячейки).
23
25. Лекция 9 (продолжение – 9.7)
· углы между осями ().
Лекция 9 (продолжение – 9.7)
24
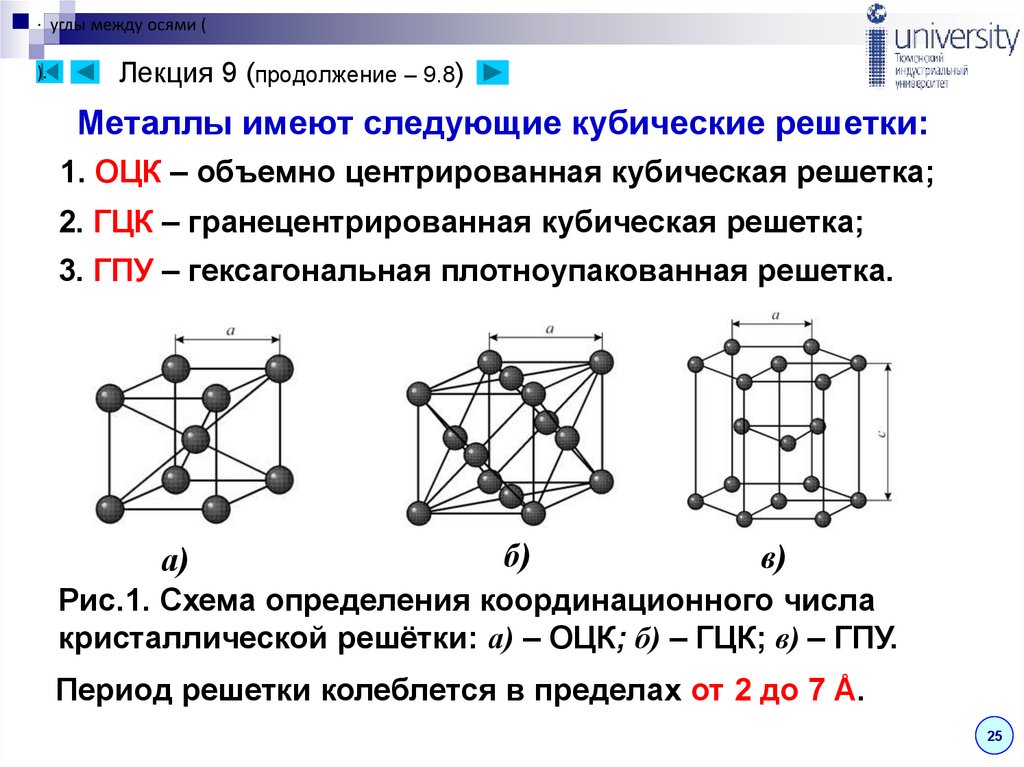
26. Лекция 9 (продолжение – 9.8)
· углы между осями ().
Лекция 9 (продолжение – 9.8)
Металлы имеют следующие кубические решетки:
1. ОЦК – объемно центрированная кубическая решетка;
2. ГЦК – гранецентрированная кубическая решетка;
3. ГПУ – гексагональная плотноупакованная решетка.
а)
б)
в)
Рис.1. Схема определения координационного числа
кристаллической решётки: а) – ОЦК; б) – ГЦК; в) – ГПУ.
Период решетки колеблется в пределах от 2 до 7 Å.
25
27. Лекция 9 (продолжение – 9.9)
1. ОЦК решетка имеет следующую кристаллическуюструктуру.
Это куб, в узлах которого находится 8 атомов.
Еще один располагается в центре ячейки.
Поэтому и называется «объемно-центрированная».
Такие решетки имеют Fe, α-Fe, Сг, W, Mo, P-Ti, Nb, Та, Li и др.
Основные свойства - высокая степень ковкости и
пластичности, твердость и прочность...
26
28. Лекция 9 (продолжение – 9.10)
2729. Лекция 9 (продолжение – 9.11)
2. ГЦК решетка имеет следующую кристаллическуюструктуру.
Это куб, состоит из 14 атомов. Восемь из них
формируют узлы решетки, а еще 6 атомов
расположены по одному на каждой грани.
Этот тип решетки имеют металлы: γ-Fe, Ni, Ag, Au, Pb, Си,
β-Co и др.
Основные свойства - блеск разного цвета, легкость,
прочность, ковкость, повышенная устойчивость к
коррозии.
28
30. Лекция 9 (продолжение – 9.12)
2931. Лекция 9 (продолжение – 9.13)
3. ГПУ решетка имеет следующую кристаллическуюструктуру.
Основа элементарной ячейки - шестигранная призма.
Это решетка, состоит из 17 атомов.
В узлах призмы располагается 12 атомов, еще два по
основаниям и три атома свободно лежат внутри
пространства в центре структуры.
Такую решетку имеют: Zn, Cd, Be, Re, α-Co, α-Ti и др.
У гексагональных решеток отношение параметра с/а всегда
большее диницы.
Основные свойства - высокая степень
прочности, сильный серебристый блеск.
30
32. Лекция 9 (продолжение – 9.14)
3133. Лекция 9 (продолжение – 9.15)
Из приведенных примеров видно, чтонекоторые металлы могут иметь
различные типы решетки, например,
Fe(α -Fe и γ-Fe), Со (α-Со и β-Со) и т. д.
Способность металла изменять
тип решетки называют
аллотропией (полиморфизмом).
32
34. Лекция 9 (продолжение – 9.16)
Компактность кристаллической решетки (или степеньзаполненности ее объема атомами) является важной
характеристикой.
Она определяется такими показателями:
1.
2.
3.
4.
параметр решетки,
число атомов в каждой элементарной ячейке,
координационное число,
плотность упаковки.
33
35. Лекция 9 (продолжение – 9.17)
Параметр решетки - это расстояние между атомамипо ребру элементарной ячейки. Параметры решетки
измеряется в нанометрах (1 нм =10-9 м = 10 Å).
Параметры кубических решеток характеризуются
длиной ребра куба и обозначаются буквой а.
Для характеристики гексагональной решетки
принимают два параметра – сторону шестигранника
а и высоту призмы с. Когда отношение с/а = 1,633, то
атомы упакованы наиболее плотно. (рис. 1.в).
Некоторые металлы имеют гексагональную решетку с
менее
плотной
упаковкой атомов
(с/а > металлов
1,633). Например,
Параметры
кристаллических
решеток
могут
для
цинка
с/а = 1,86,
для кадмия
с/а = 1,88.
быть
измерены
с помощью
рентгеноструктурного
анализа.металлов находятся в
Параметры кубических решеток
пределах а = 0,286 – 0,607 нм.
Для металлов с гексагональной решеткой а лежит в
34
пределах а = 0,228 – 0,398 нм, а с = 0,357– 0,652 нм.
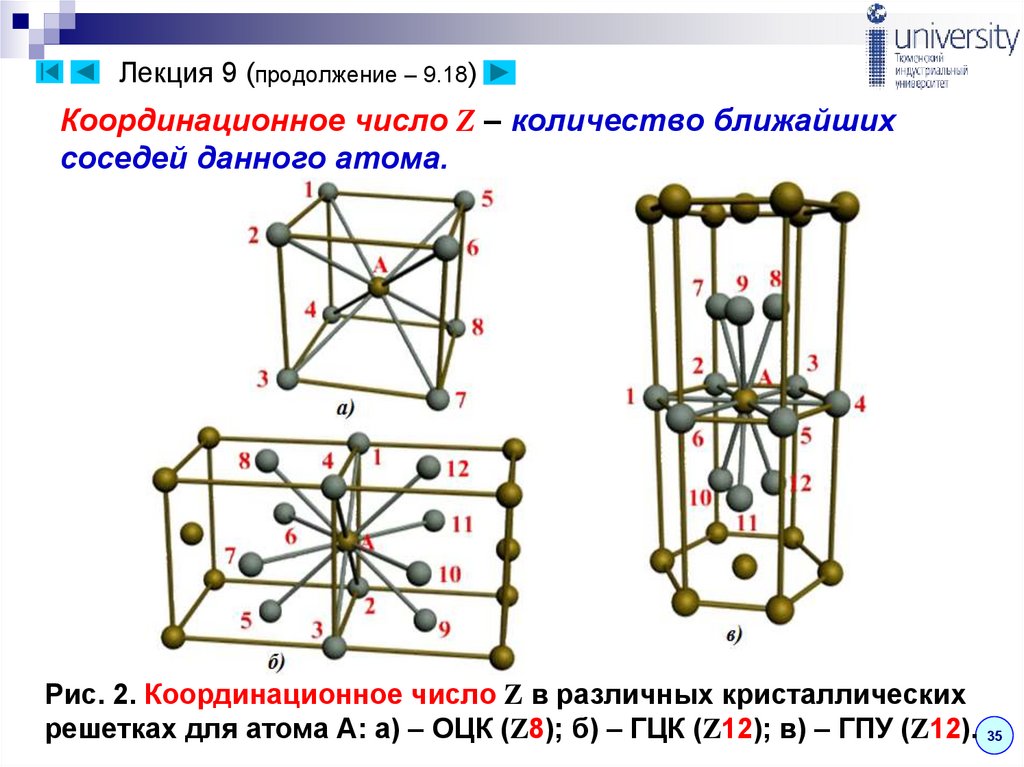
36. Лекция 9 (продолжение – 9.18)
Координационное число Z – количество ближайшихсоседей данного атома.
Рис. 2. Координационное число Z в различных кристаллических
решетках для атома А: а) – ОЦК (Z8); б) – ГЦК (Z12); в) – ГПУ (Z12). 35
37. Лекция 9 (продолжение – 9.19)
В ОЦК решетке (рис. 2,а) атом А (в центре) находится нанаиболее близком равном расстоянии от восьми атомов,
расположенных в вершинах куба, т.е. координационное
число этой решетки равно 8 (Z8). Атом А, находящийся в
центре куба, полностью принадлежит данной ячейке.
36
38. Лекция 9 (продолжение – 9.20)
В ГЦК решетке (рис. 2,б) атом А (на грани куба) находится нанаиболее близком равном расстоянии от четырех атомов
1,2,3,4, расположенных в вершинах куба, от четырех
атомов 5,6,7,8, расположенных на гранях куба в левой
части и, от четырех атомов 9,10,11,12, расположенных на
гранях куба в правой части кристаллической ячейке.
Атомы 9,10,11,12 симметричны атомам 5,6,7,8.
Т.о., ГЦК решетки координационное число равно 12 (Z12).
Для ГЦК – решетки, каждый
атом, находящийся на гранях
куба (центрирующий грань)
принадлежит двум ячейкам.
37
39. Лекция 9 (продолжение – 9.21)
В ГПУ решетке при с/а = 1,633 (рис. 2,в) атом А в центрешестигранного основания призмы находится на
наиболее близком равном расстоянии от шести атомов
1,2,3,4,5,6, размещенных в вершинах шестигранника, и
от трех атомов 7,8,9, расположенных в
средней плоскости призмы.
Кроме того, атом А оказывается на таком
же расстоянии еще от трех атомов 10,11,12,
принадлежащих кристаллической ячейке,
лежащей ниже основания.
Атомы 10,11,12 симметричны атомам 7,8,9.
Т.о., для ГПУ решетки координационное
число равно 12 (Z12).
38
40. Лекция 9 (продолжение – 9.22)
Плотность упаковки это отношение суммарного объема,атомов в кристаллической решетке, к ее полному объему.
Различные типы кристаллических решеток имеют разную
плотность упаковки атомов.
В ГЦК решетке атомы занимают 74 % всего объема
кристаллической решетки, а межатомные промежутки
(«поры») 26 %.
В ОЦК решетке атомы занимают 68 % всего объема, а
«поры» 32 %.
Компактность решетки K зависит от особенностей
электронной структуры металлов и характера связи между
их атомами.
От типа кристаллической решетки сильно зависят
свойства металла.
39
41. Лекция 9 (продолжение – 9.23)
2. Понятие об изотропии и анизотропии1. Первой особенностью металлов является
анизотропия свойств кристаллов, т. е. различие
свойств кристаллов в разных направлениях.
В кристаллических телах атомы правильно
располагаются в пространстве, причем по разным
направлениям расстояния между атомами неодинаковы,
что предопределяет существенные различия в силах
взаимодействия между ними и, в конечном результате,
разные свойства. Зависимость свойств от направления
называется анизотропией.
В аморфных телах с хаотическим расположением
атомов в пространстве расстояния между атомами в
различных направлениях равны, т.е., свойства будут
одинаковые, поэтому аморфные тела изотропны.
40
42. Лекция 9 (продолжение – 9.24)
2. Второй особенностью металлов как телкристаллического строения является наличие
у них плоскостей скольжения (спайности).
По этим плоскостям происходит сдвиг или
отрыв (разрушение) частиц кристаллов под
действием внешних усилий.
У аморфных тел смещение частиц происходит не
по определённым плоскостям, а беспорядочно.
Излом аморфного тела всегда имеет неправильную,
искривлённую форму.
41
43. Лекция 9 (продолжение – 9.25)
3. Третьей особенностью металлов как телкристаллического строения является то, что
процесс перехода их из твёрдого состояния в
жидкое и наоборот происходит при определённой
температуре, называемой температурой
плавления (затвердевания).
Аморфные тела переходят в жидкое состояние
постепенно и не имеют определённой
температуры плавления.
42
44. Лекция 9 (продолжение – 9.26)
3. Дефекты кристаллического строенияУ металлических тел анизотропия свойств не
выражена так резко, как у отдельных кристаллов.
Металлы являются поликристаллическими телами,
т.е. они состоят не из одного, а из бесчисленного
количества кристаллов, по-разному ориентированных.
Произвольность ориентировки каждого кристалла
приводит к тому, что в любом направлении
располагается приблизительно одинаковое
количество различно ориентированных кристаллов.
В результате получается, что свойства
поликристаллических тел будут одинаковы во
всех направлениях - это явление получило
название «квазиизотропия» (ложная изотропия).
43
45. Лекция 9 (продолжение – 9.27)
Металлы и сплавы состоят из большого количествакристаллов, то есть, имеют поликристаллическое строение.
Эти кристаллы называются зернами.
Они имеют неправильную форму и различно
ориентированы в пространстве. Каждое зерно имеет свою
ориентировку кристаллической решетки, отличную от
ориентировки соседних зерен, вследствие чего свойства
реальных металлов усредняются, и явления анизотропии
не наблюдается
У реальных кристаллических веществ есть одна важная
особенность строения – это структурные неоднородности,
обычно называемые дефектами, которые нарушают связи
между атомами и оказывают влияние на свойства
металлов.
44
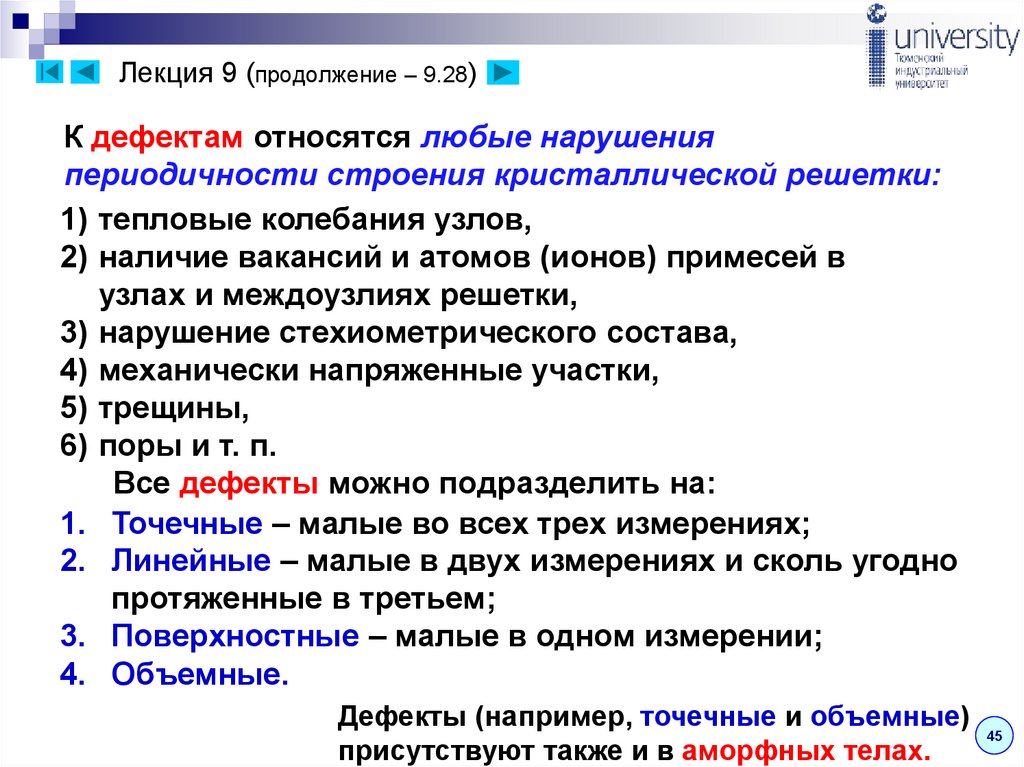
46. Лекция 9 (продолжение – 9.28)
К дефектам относятся любые нарушенияпериодичности строения кристаллической решетки:
1) тепловые колебания узлов,
2) наличие вакансий и атомов (ионов) примесей в
узлах и междоузлиях решетки,
3) нарушение стехиометрического состава,
4) механически напряженные участки,
5) трещины,
6) поры и т. п.
Все дефекты можно подразделить на:
1. Точечные – малые во всех трех измерениях;
2. Линейные – малые в двух измерениях и сколь угодно
протяженные в третьем;
3. Поверхностные – малые в одном измерении;
4. Объемные.
Дефекты (например, точечные и объемные)
45
присутствуют также и в аморфных телах.
47. Лекция 9 (продолжение – 9.29)
Дефекты кристаллической решетки:Точечные дефекты
Вакансии
Дислоцированные атомы
Атомы примесей
Линейные дефекты
Краевая дислокация
Винтовая дислокация
Поверхностные дефекты
Границы зерен
Свободные поверхности
кристалла
Ряды и сетки
дислокаций
46
48.
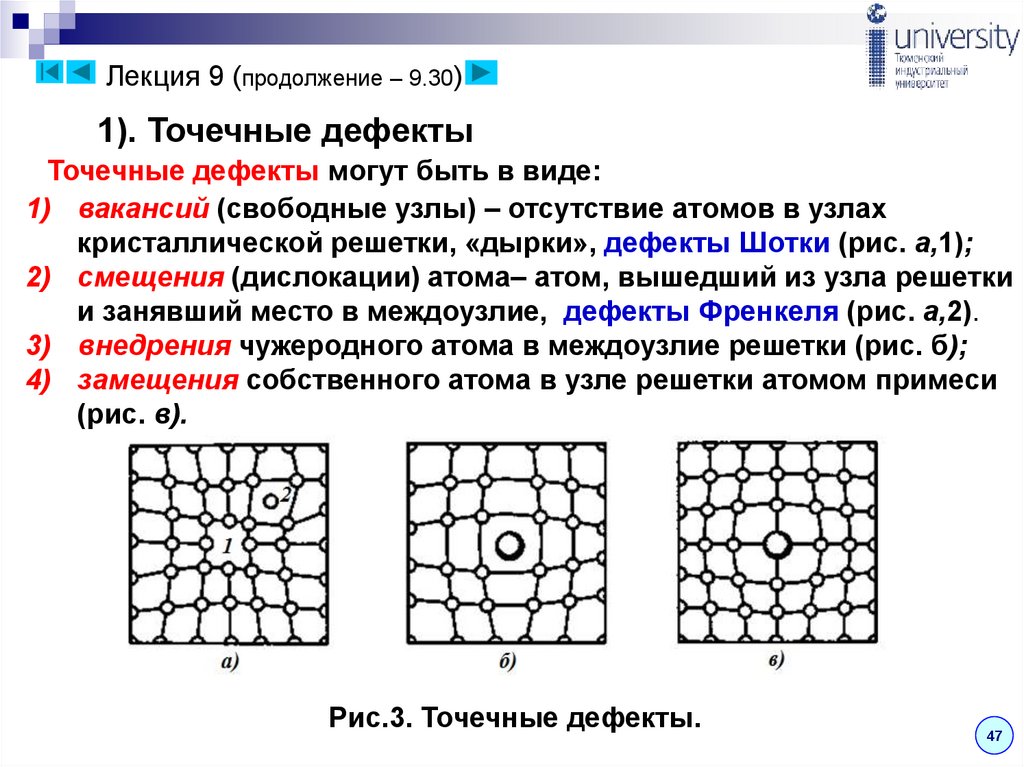
Лекция 9 (продолжение – 9.30)1). Точечные дефекты
Точечные дефекты могут быть в виде:
1) вакансий (свободные узлы) – отсутствие атомов в узлах
кристаллической решетки, «дырки», дефекты Шотки (рис. а,1);
2) смещения (дислокации) атома– атом, вышедший из узла решетки
и занявший место в междоузлие, дефекты Френкеля (рис. а,2).
3) внедрения чужеродного атома в междоузлие решетки (рис. б);
4) замещения собственного атома в узле решетки атомом примеси
(рис. в).
Рис.3. Точечные дефекты.
47
49.
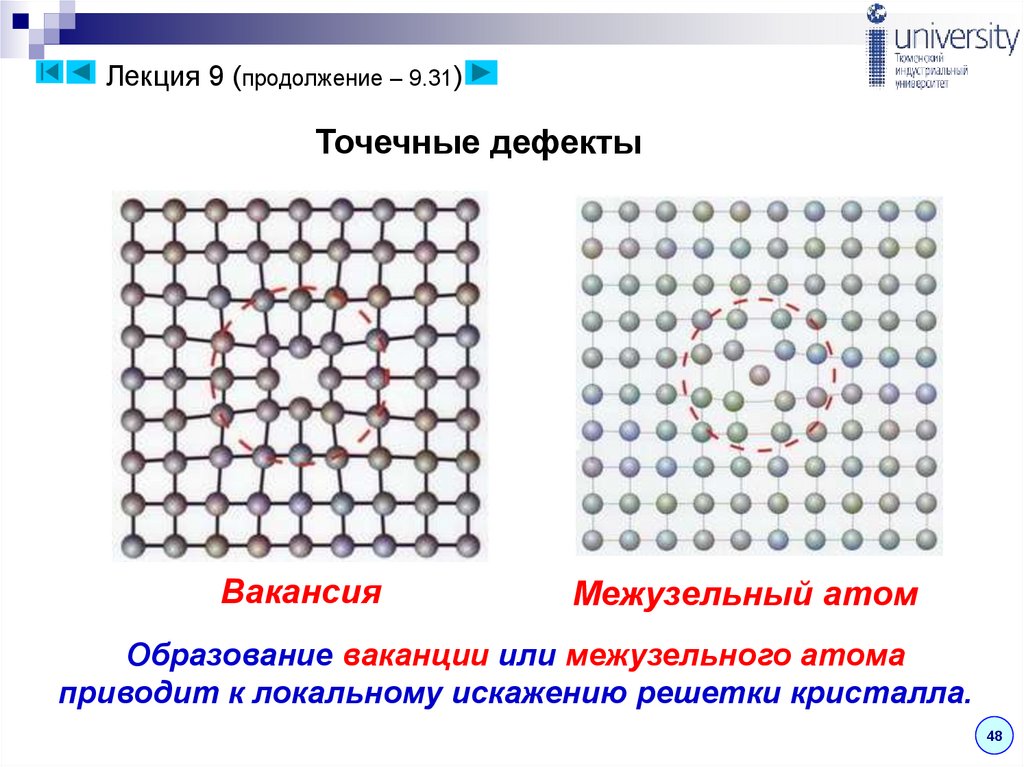
Лекция 9 (продолжение – 9.31)Точечные дефекты
Вакансия
Межузельный атом
Образование ваканции или межузельного атома
приводит к локальному искажению решетки кристалла.
48
50.
Лекция 9 (продолжение – 9.32)Вакансии образуются под действием тепловой энергии
и пластической деформации, поэтому чем выше
температура и степень деформации, тем больше вакансий
и тем чаще они перемещаются от одного узла к другому.
При внедрении атомов в междоузлие, особенно примесных
атомов, решетка деформируется сильнее, чем при наличии
вакансий, и тем сильнее, чем больше разница между
размерами атома внедрения и атома данной решетки.
Точечные дефекты фактически обусловливают
электропроводность диэлектриков, у металлических
проводников влияют на ее величину, а у полупроводников –
не только на величину, но, что очень важно, – на ее тип.
Например, тысячные доли процента некоторых примесей
(10-3) увеличивают удельную электропроводность
полупроводников в 105 – 106 раз.
49
51.
Лекция 9 (продолжение – 9.33)2). Линейные дефекты.
Линейные (одномерные) дефекты кристаллической решетки
называют дислокациями (dislocation – смещение).
Дислокация - это дефекты кристаллического строения,
представляющие собой линии, вдоль и вблизи которых
нарушено характерное для кристалла правильное
расположение атомных плоскостей.
Простейшие виды дислокаций –
краевые и винтовые.
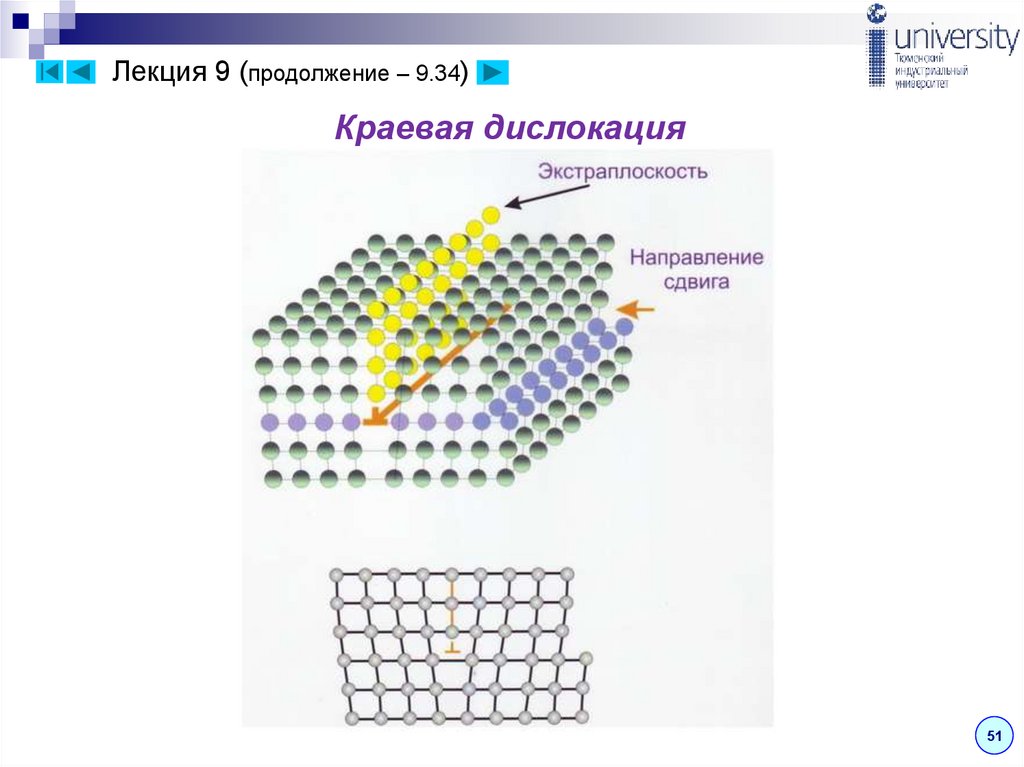
Краевая дислокация представляет собой
линию, вдоль которой обрывается внутри
кристалла край «лишней» полуплоскости
(рис. ) Неполная плоскость называется
Рис. 4. Линейный дефект –
краевая дислокация
экстраплоскостью.
Если экстраплоскость находится в верхней части кристалла,
то краевая дислокация – положительная ( ), если в нижней,
то – отрицательная ( ). Дислокации одного знака
50
отталкиваются, а противоположные притягиваются
52.
Лекция 9 (продолжение – 9.34)Краевая дислокация
51
53.
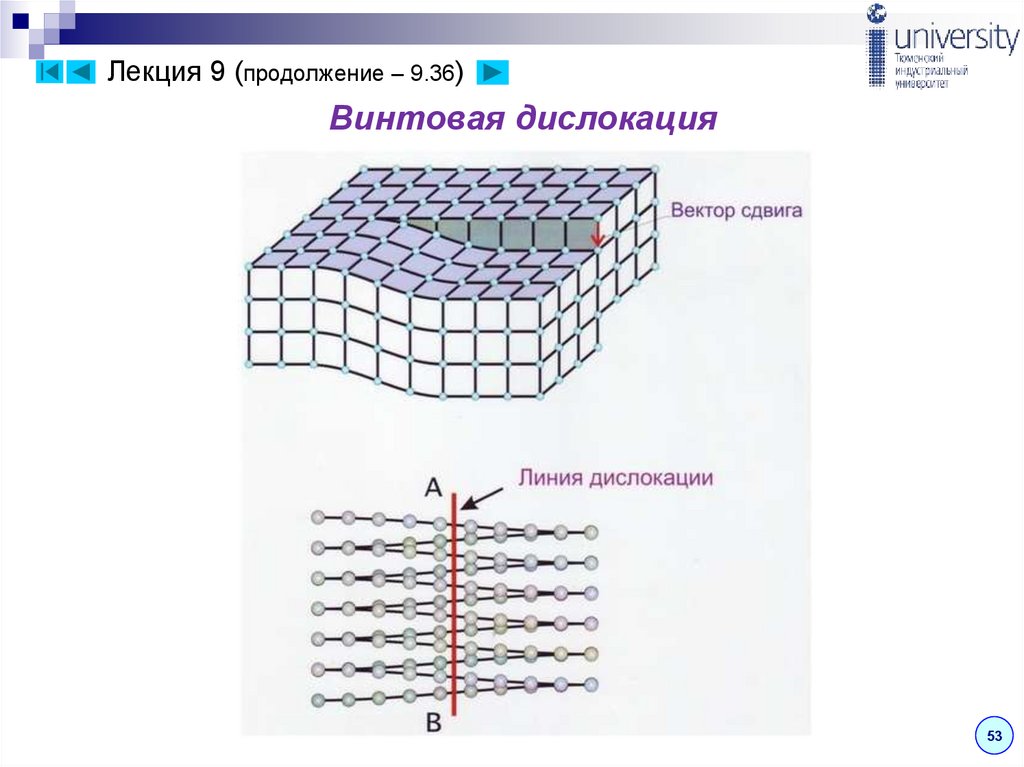
Лекция 9 (продолжение – 9.35)Винтовая дислокация получена при помощи частичного сдвига по
плоскости Q вокруг оси АВ. На поверхности кристалла образуется
ступенька, проходящая от оси до края кристалла.
Такой сдвиг нарушает параллельность атомных
слоев, кристалл превращается в одну атомную
плоскость, закрученную по винту вокруг оси АВ,
которая представляет границу, отделяющую
часть плоскости скольжения, где сдвиг уже
произошел, от части, где сдвиг не начинался.
Вдоль оси АВ наблюдается макроскопический
характер области несовершенства, в других
Рис. 5. Линейный дефект –
винтовая дислокация
направлениях ее размеры составляют
несколько периодов.
Если переход от верхних горизонтов к нижним осуществляется по
часовой стрелке, то дислокация правая, а если против – левая.
Важной характеристикой дислокаций является их плотность –
число выходов дислокаций на единицу площади (см-2). В металле
52
плотность дислокаций огромна и составляет 104 – 1012 см-2.
54.
Лекция 9 (продолжение – 9.36)Винтовая дислокация
53
55.
Лекция 9 (продолжение 9.37)3). Поверхностные дефекты.
Поверхностные дефекты – дислоцированы на границе зерен,
фрагментов и блоков (рис. 6). На границе кристаллических
зерен атомы менее правильно расположены, чем в объеме
зерна.
Рис.6. Разориентация
зерен и блоков в
металле
Размеры зерен составляют до 1мм. Углы разориентации
составляют до нескольких десятков градусов (Θ).
Граница между зернами представляет собой тонкую в 5 – 10
атомных диаметров поверхностную зону с максимальным
54
нарушением порядка в расположении атомов.
56.
Лекция 9 (продолжение 9.38)На границе зерен скапливается большое количество
дислокаций и вакансий. Внутри зерна никогда не
наблюдается идеального строения кристаллической
решетки. Поэтому такие же дефекты, но меньше
числом, скапливаются и на границах блоков в зерне.
Имеются участки, разориентированные один
относительно другого на несколько градусов (θ1).
Эти участки называются фрагментами.
Каждый фрагмент состоит из блоков, размерами
менее 10 мкм, разориентированных на угол менее
одного градуса (θ2 ).
Такую структуру называют блочной или мозаичной.
55
57.
Лекция 9 (продолжение 9.39)Границы зерен и субзерен
56
58.
Лекция 9 (продолжение – 9.40)4). Объемные дефекты.
Объемные (трехмерные) дефекты имеют сравнительно
большие размеры во всех трех измерениях.
К этому виду дефектов относятся пустоты (поры и
трещины), инородные включения (в твердом или жидком
состоянии), включения иной кристаллографической
модификации или с другим стехиометрическим
составом и т. п.
Каждый дефект (вакансия, дислокация) деформирует
решетку. Число дефектов с повышением температуры
и пластической деформации резко возрастает.
При этом, если точечные дефекты существенно влияют
на удельную электропроводность материалов, то
линейные дефекты – на механические свойства.
57
59. Лекция 9 (продолжение – 9.41)
4. Строение материаловВ зависимости от соотношения энергии теплового
движения атомов, ионов или молекул, образующих
данное вещество, и энергии их взаимодействия все
материалы при нормальных условиях могут находиться
в газообразном, жидком, твердом состоянии
Особым видом существования вещества является
плазменное состояние, которое образуется при высоких
температурах (выше 5000°С) или при воздействии
электрических разрядов и представляет собой сильно
ионизированный газ.
Переход вещества из газообразного состояния в
жидкое и далее в твердое сопровождается ростом
упорядоченности в расположении частиц в
пространстве.
58
60. Лекция 9 (продолжение – 9.42)
5961. Лекция 9 (продолжение – 9.43)
В газообразном состоянии энергия теплового движениячастиц превышает энергию их взаимодействия.
Такими частицами в газах являются молекулы: реже
одноатомные (Не, Ne, Аг, Кг, Хе, Rn), чаще двух-, трех- и
многоатомные (Н2, N2, О2, СО2, Н2О, СН4, С2Н6 И Т.П.).
Молекулы газа находятся в постоянном хаотическом
движении.
В жидком состоянии энергия теплового движения частиц
сравнима с энергией их взаимодействия.
В твердом состоянии энергия взаимодействия частиц
превышает энергию их теплового движения. Такими
частицами являются атомы, ионы или молекулы, которые
расположены либо в геометрически правильном порядке,
образуя кристаллическое тело, либо хаотически, в
беспорядке, образуя аморфное тело.
60
62. Лекция 9 (продолжение – 9.44)
6163. Лекция 9 (продолжение – 9.45)
В аморфных телах в расположении частиц (атомов,ионов или молекул) имеет место только ближний
порядок. Они проявляют изотропность свойств –
имеют одинаковые физико-химические свойства во
всех трех измерениях. Материалы с такими
свойствами часто называют изотропными.
В кристаллических телах наблюдается как ближний, так
и дальний порядок расположения частиц, т. е. частицы
размещаются в пространстве на определенном
расстоянии друг от друга в геометрически правильном
порядке, образуя кристалл. В кристалле сформирована
пространственная кристаллическая решетка.
Многократно повторяющимся элементом решетки
является элементарная ячейка, вершины которой
называют узлами, а расстояние между двумя
соседними узлами – периодом (постоянной решетки).
62
64. Лекция 9 (продолжение – 9.46)
5. Типы связейОбъединение атомов в молекулы вещества,
находящегося в газообразном, жидком, твердом
состоянии, а также объединение атомов или ионов в
твердое тело с атомным, металлическим или ионным
строением происходит по химической связи.
Природа химической и межмолекулярной связей
единая – электрическая.
В твердых телах рассматривают четыре типа связей:
1. Ван-дер-ваальсовые;
2. Ковалентные;
3. Металлические;
4. Ионные.
63
65. Лекция 9 (продолжение – 9.47)
Энергия связи Есв для различных кристаллов различна:Кристалл
Энергия
Кдж/моль
Тип связи
Ar
CH4
Алмаз
SiC
LiF
NaCl
Fe
La
7,5
10
750
1180
1000
750
390
110
Молекулярная Ковалентная
Ионная
Металлическая
а – молекулярная (Ван-дер-Ваальсовая); б – ковалентная (алмаз); в – ионная (NaCl);
г – металлическая. 1,2 -атомное ядро и остов, 3-обобщенные электроны
Энергия связи определяет температуру плавления,
модуль упругости, температурный коэффициент
линейного расширения и другие ряда основных
свойств конструкционных материалов.
64
66. Лекция 9 (продолжение – 9.48)
1) Молекулярные или Ван-дер-ваальсовые связи.Аналогичные связи действуют между молекулами в
кристаллах двухатомных газов H2, N2, Cl2 (при очень
низких температурах), в кристаллах I2, H2O, CO2, CH4 и
др. органических веществ – при нормальных условиях.
Типичной решеткой для инертных газов является –
гранецентрическая кубическая (ГЦК).
Энергия связи сил Ван-дер-Ваальса невелика, поэтому
молекулярные кристаллы имеют низкие температуры
плавления и легко возгоняются.
Молекулярные кристаллы – диэлектрики, плохо
проводящие электрический ток.
65
67. Лекция 9 (продолжение – 9.49)
Молекулярные или Ван-дер-ваальсовые связи.66
68. Лекция 9 (продолжение – 9.49)
2) Ковалентные связиИх образуют элементы IV, V, VI групп, Периодической
системы элементов (ПСЭ): углерод, кремний, германий,
сурьма, висмут и др
Ковалентная связь осуществляется в результате
попарного обобществления валентных электронов.
Каждая связь образуется парой электронов, движущихся
по замкнутым орбитам между двумя атомами..
Число атомов n, с которыми происходит
обобществление электронов, зависит от валентности
элемента и может быть определено по формуле
n = 8 – N где N – валентность элемента.
Например, у молекулы хлора одна пара валентных
электронов образует ковалентную связь (n = 1), у
молекулы азота – три пары (n = 3), у молекулы
углерода – четыре пары (n = 4).
67
69. Лекция 9 (продолжение – 9.50)
Ковалентные связи68
70.
Лекция 9 (продолжение – 9.51)Т. о., ковалентная связь может быть одинарной, напр. у
Сl2, и кратной (двойной, тройной), например у N2.
Вследствие большой энергии связи ковалентные кристаллы
характеризуются высокими температурами плавления.
Если молекула состоит из атомов одного и того же
химического элемента (Cl2, N2, H2), то электронная пара (одна
или несколько) в одинаковой степени принадлежит этим
атомам.
В этом случае ковалентная связь является неполярной или
нейтральной, и образуемые молекулы тоже являются
неполярными
В неполярных молекулах центры положительных и
отрицательных зарядов совпадают и, следовательно,
электрический дипольный момент равен нулю μ = ql = 0.
69
71.
).Лекция 9 (продолжение – 9.52)
3) Металлические связи
В металлическом кристалле при взаимодействии с
элементами других групп атомы легко отдают свои
валентные электроны и превращаются в
положительные ионы.
Валентные электроны свободно перемещаются по общей
зоне со свободными подуровнями.
Т.о., валентные электроны нельзя считать потерянными
или приобретенными.
Они обобществлены атомами в объеме всего кристалла в
отличие от ковалентных кристаллов, в которых такое
обобществление ограничено одной парой атомов.
Металлическая связь ненаправленная. Поэтому высокое
координационное число и большая компактность
кристаллических структур металлов (ГЦК,К12и ГП, К12).
70
72.
).Лекция 9 (продолжение – 9.53)
1 – атомное ядро;
2 – атомный остов;
3 – обобщенные
электроны.
Металлические связи
71
73.
).Лекция 9 (продолжение – 9.54)
ГЦК – решетку имеют Ni, Cu, Ag, Au, Fe, Pt, Al, Pb.
ГП – решетку со сферической симметрией (с/а = 1.633)
имеют Mg и Co.
ГП – решетку с отклонениями от сферической симметрии
(в связи с наличием доли ковалентной связи) имеют Zn и
Cd (с/а >1.633), Be, Tiα, Zrα (c/а <1.633).
ОЦК – решетку имеют Feα, Cr, Mo, W, V и др. Такая
структура не обладает большой плотностью упаковки.
Для большинства случаев с увеличением энергии связи
растут температуры плавления Tпл, модуль упругости Е,
энергия активации самодиффузии Qдиф, плотность γ, а
коэффициент линейного расширения α, наоборот,
уменьшается (табл.1).
72
74.
).Лекция 9 (продолжение – 9.55)
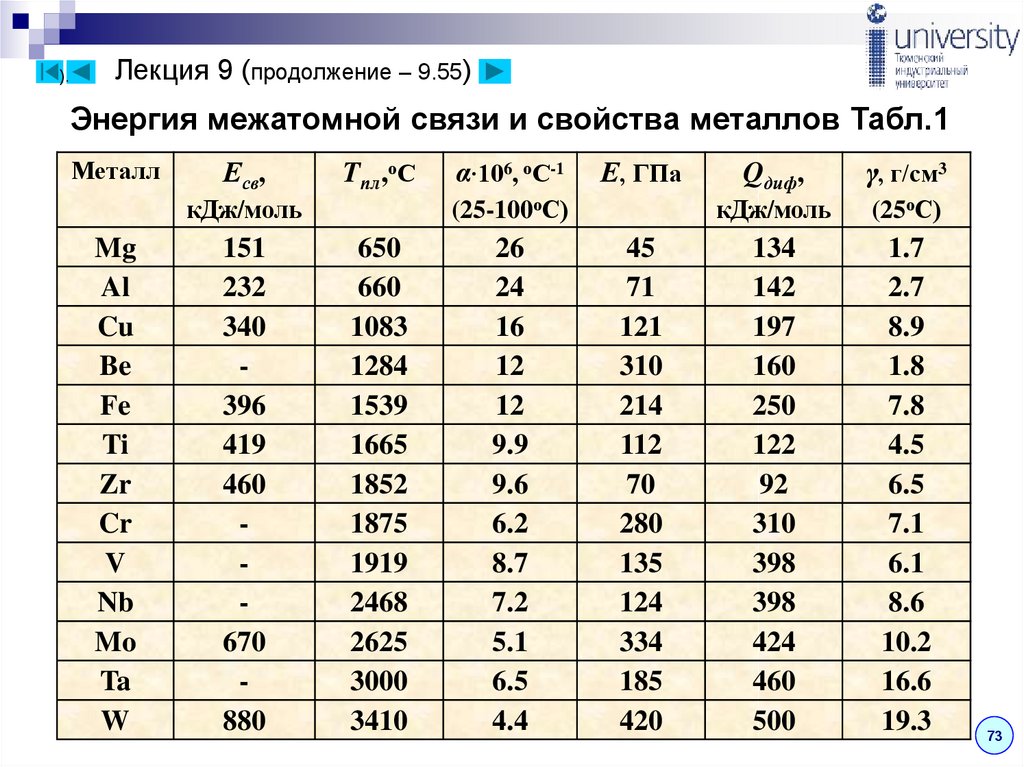
Энергия межатомной связи и свойства металлов Табл.1
Металл
Есв,
Tпл,оС
151
232
340
396
419
460
670
880
Е, ГПа
(25-100оС)
кДж/моль
Mg
Al
Cu
Be
Fe
Ti
Zr
Cr
V
Nb
Mo
Ta
W
α∙106, оС-1
650
660
1083
1284
1539
1665
1852
1875
1919
2468
2625
3000
3410
26
24
16
12
12
9.9
9.6
6.2
8.7
7.2
5.1
6.5
4.4
45
71
121
310
214
112
70
280
135
124
334
185
420
Qдиф,
γ, г/см3
кДж/моль
(25оС)
134
142
197
160
250
122
92
310
398
398
424
460
500
1.7
2.7
8.9
1.8
7.8
4.5
6.5
7.1
6.1
8.6
10.2
16.6
19.3
73
75.
).Лекция 9 (продолжение – 9.56)
Закономерность обнаружена экспериментально и имеет
ряд исключений: аномально завышен Е у бериллия, что
позволяет использовать его сплавы как материалы
повышенной жесткости; титан и цирконий имеют
заниженные значения не только Е, но и Qдиф (последнее
объясняет их пониженную жаропрочность).
Энергия металлической связи несколько меньше, чем
ковалентной, поэтому металлы в большинстве случаев
по сравнению с ковалентными кристаллами имеют
более низкие температурные плавления
Т.о. вследствие ненаправленности металлической
связи и образования плотноупакованных структур
металлические кристаллы более пластичны и менее
тверды, чем ковалентные.
74
76.
Лекция 9 (продолжение – 9.57)4. Ионная связь
Ионная связь возникает между атомами, имеющими
очень большую разность электроотрицательность (ЭО).
В этом случае электронная пара настолько смещается в
сторону атома с большей ЭО, что он фактически
становится заряженным отрицательным зарядом, в то
время как атом с меньшей ЭО-положительным зарядом.
Т.к. между элементами происходит перераспределение
электронов: электроположительный элемент теряет
валентные электроны, а электроотрицательный –
приобретает их.
Т.о., ионная связь образуется в результате перехода
электрона от одного атома к другому – с большей ЭО,
при этом возникают разноименно заряженные ионы,
вызывающие силы электростатического притяжения.
75
77.
Лекция 9 (продолжение – 9.58)Например, в NaCl атом Сl имеет по отношению к атому Na
большую ЭО, поэтому электрон атома Na переходит к
атому Сl, при этом первый приобретает положительный
заряд, второй – отрицательный:
Na + Cl = Na+Cl(Кристалл FeO, решетка которого
состоит из отрицательно-заряженных
ионов O2- и положительнозаряженных ионов Fe2+).
В решетке кристалла ионы укладываются как шары разных диаметров.
Радиус неметалла больше радиуса
металлического иона и поэтому
металлические ионы заполняют
поры в кристаллической решетке,
образованной ионами неметалла. 76
78.
Лекция 9 (продолжение – 9.59)Ионная связь
77
79.
Лекция 9 (продолжение – 9.60)Приведенные в табл.2 значения отношений радиуса металла (Rм) к
радиусу неметалла (Rнм) и соответствующие им координационные
числа вытекают из геометрии упаковки шаров разных диаметров:
К
Rм/Rнм
8
1-0,73
6
4
0,73-0,41 0,41-0,22
2
0,22
Для FeO К равно 6, т.к. указанное соотношение равно 0.54.
Ионы О образуют ГЦК–решетку. Ионы Fe занимают в ней поры
Каждый ион Fe окружен шестью ионами О и наоборот, каждый ион
О окружен шестью ионами Fe. В связи с этим в ионных кристаллах
нельзя выделить пару ионов, которые можно было бы считать
молекулой. При испарении такой кристалл распадается на
молекулы.
Энергия связи ионного кристалла по своему значению близка к
энергии связи ковалентного кристалла. И превышает энергию
связи металлического, а тем более, молекулярного кристалла.
Поэтому ионные кристаллы имеют высокие температуры
плавления и модуль упругости и низкие коэффициенты
78
сжимаемости и линейного расширения.
80.
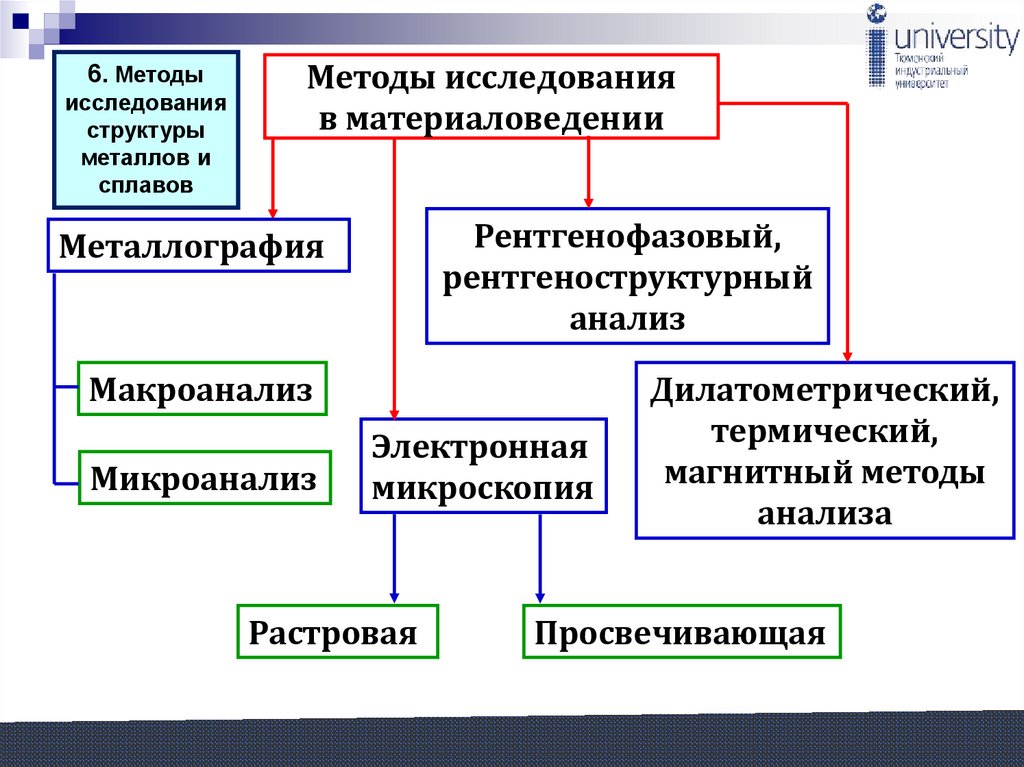
6. Методыисследования
структуры
металлов и
сплавов
Методы исследования
в материаловедении
Рентгенофазовый,
рентгеноструктурный
анализ
Металлография
Макроанализ
Микроанализ
Электронная
микроскопия
Растровая
Дилатометрический,
термический,
магнитный методы
анализа
Просвечивающая
81.
Лекция 9 (продолжение – 9.62)6. Методы исследования структуры металлов и сплавов:
а). Макроскопический анализ.
б). Микроскопический анализ.
в). Рентгеноструктурный анализ и рентгеновская дефектоскопия.
а). Макроскопический анализ.
Строение металлов и сплавов, видимое невооружённым глазом или
при небольших увеличениях с помощью лупы (до 30 раз),
называется макроструктурой.
Макроструктура изучается путём макроанализа.
б). Микроскопический анализ.
Микроструктурный анализ – изучение поверхности при помощи
оптических микроскопов при увеличении до 3000 раз. Позволяет
обнаружить элементы структуры размером до 0,2 мкм. Электронный
микроскоп позволяет изучать структуру при увеличении до 3000 раз.
в).Рентгеноструктурный анализ и рентгеновская дефектоскопия.
Рентгеновские лучи имеют ту же природу, что и световые лучи, т.е.
представляют собой электромагнитные колебания, но длина их
волн другая: световых лучей от 7,5 х10-5 до 4 х10-5 см,
80
рентгеновских - от 2 х10-7 до 10-9 см.
82.
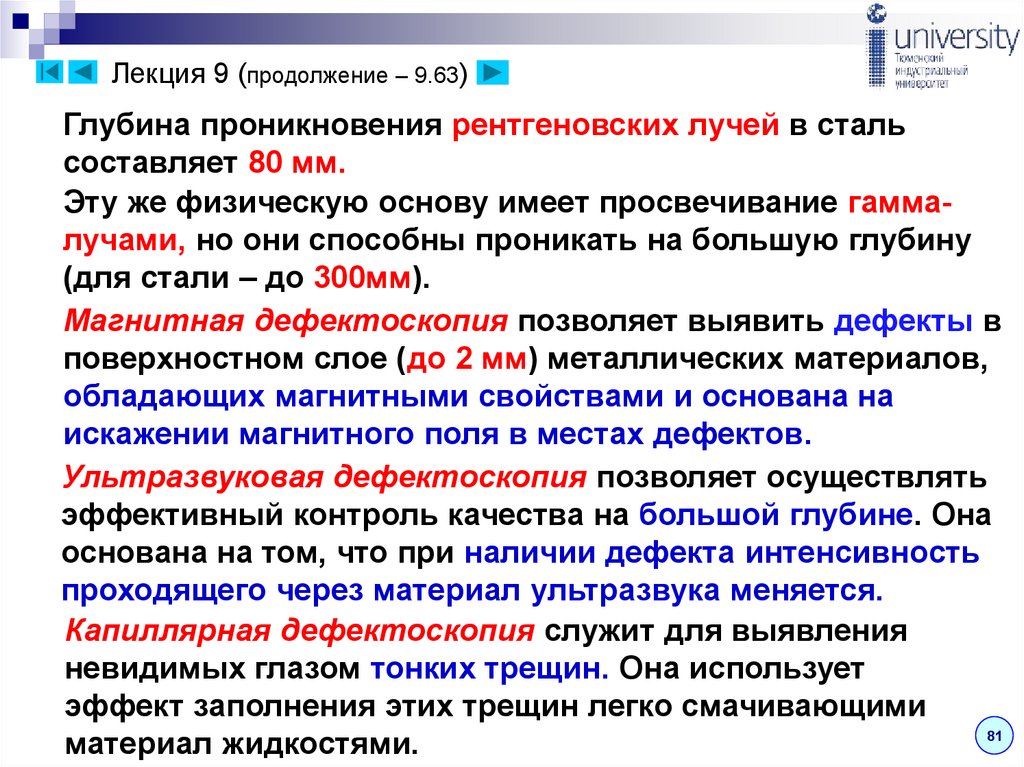
Лекция 9 (продолжение – 9.63)Глубина проникновения рентгеновских лучей в сталь
составляет 80 мм.
Эту же физическую основу имеет просвечивание гаммалучами, но они способны проникать на большую глубину
(для стали – до 300мм).
Магнитная дефектоскопия позволяет выявить дефекты в
поверхностном слое (до 2 мм) металлических материалов,
обладающих магнитными свойствами и основана на
искажении магнитного поля в местах дефектов.
Ультразвуковая дефектоскопия позволяет осуществлять
эффективный контроль качества на большой глубине. Она
основана на том, что при наличии дефекта интенсивность
проходящего через материал ультразвука меняется.
Капиллярная дефектоскопия служит для выявления
невидимых глазом тонких трещин. Она использует
эффект заполнения этих трещин легко смачивающими
81
материал жидкостями.
83.
Лекция 9 (продолжение – 9.64)Контрольные вопросы.
Что называют структурой металлов?
В чём различие между макро- и микроструктурой металлов?
Какими способами исследуется макроструктура?
В чём состоит различие макро- и микрошлифами?
Почему металлографические микроскопы работают не на
проходящем, а на отражённом свете?
6. Почему отдельные кристаллы анизотропны, а свойства
металлических изделий одинаковы во всех направлениях?
7. Какие свойства присущи телам кристаллического строения в
отличие от аморфных тел?
8. Какова природа рентгеновских лучей и как они образуются?
9. Как определяется тип кристаллической решётки металла?
10. Какие типы кристаллических решёток вы знаете?
11. Каким из известных вам способов можно обнаружить
газовую раковину в стальной отливке на глубине 200 мм,
не разрушая заготовки?
1.
2.
3.
4.
5.
82




































































 Химия
Химия








