Похожие презентации:
Водород. Распространенность в природе
1. Водород
2. План
1) Распространенность в природе2) Историческая справка
3) Строение атома
4) Положение в периодической системе
5) Строение молекулы
6) Физические свойства
7) Химические свойства
8) Получение
9) Применение
3. 1. Распространенность в природе
Водородная туманность «Сердце»4. 2. Историческая справка
1766 г. – водород открыл Г. Кавендиш1784 г. – А. Лавуазье назвал водород
hydrogene (др.-греч. hydro genes порождающий воду)
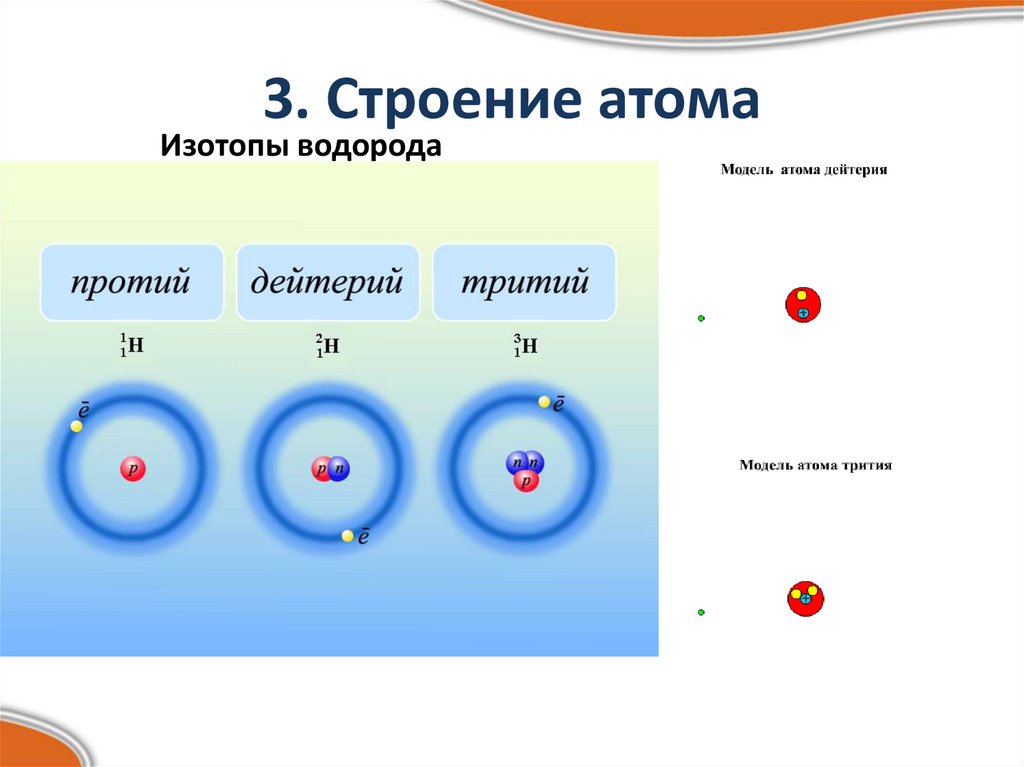
5. 3. Строение атома
6. 3. Строение атома
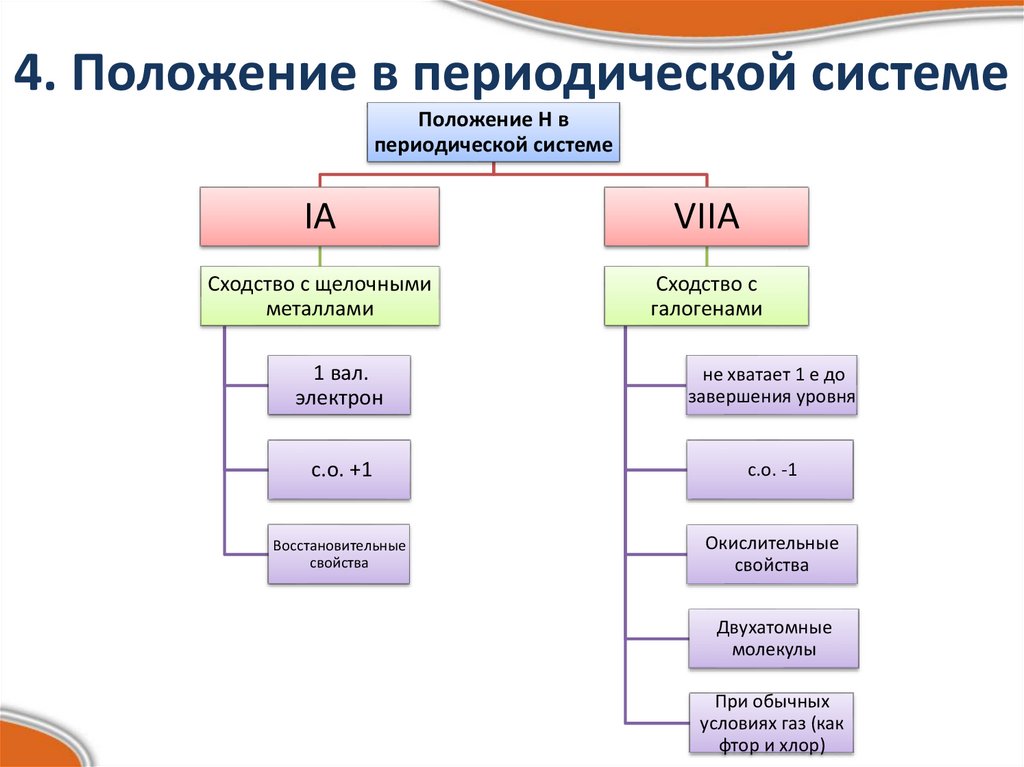
Изотопы водорода7. 4. Положение в периодической системе
Положение Н впериодической системе
IА
VIIА
Сходство с щелочными
металлами
Сходство с
галогенами
1 вал.
электрон
не хватает 1 е до
завершения уровня
с.о. +1
с.о. -1
Восстановительные
свойства
Окислительные
свойства
Двухатомные
молекулы
При обычных
условиях газ (как
фтор и хлор)
8. 5. Строение молекулы
9. 6. Физические свойства
1. Газ без цвета, вкуса изапаха.
2. Легче воздуха в 14,5 раз.
3. Плохо растворим в воде.
4. Хорошо растворим в
некоторых металлах
(например, Pd).
5. Самая высокая
теплопроводность среди
газообразных веществ (в 7
раз выше
теплопроводности
воздуха).
10. 7. Химические свойства
1) Взаимодействие с металлами:Ca + H2 = CaH2
CaH2 + 2H2O = Ca(OH)2 + 2H2
2) Взаимодействие с неметаллами
H2 + F2 = 2HF
t
2H2 + C = CH4
t
2H2 + O2 = 2H2O
3) Восстановление металлов из оксидов:
t
Fe2O3 + 3H2 = 2Fe + 3H2O
11. 8. Получение
I. В промышленности – конверсией водяныхпаров с углем или метаном:
t
С + H2O = CO + H2
t
CH4 + H2O = CO + 3H2
12. 8. Получение
II. В лаборатории:1) действием разбавленных кислот (кроме HNO3)
на металлы: Zn + HCl =
2) взаимодействием кальция с водой:
Ca + 2H2O =
3) разложением гидридов водой:
NaH + H2O = NaOH + H2
4) действием щелочей на Zn или Al:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
5) электролизом воды:
эл.ток
2H2O = 2H2 + O2
13. 8. Получение
Аппарат Киппа1. Сосуд
2. Шаровая воронка
3. Тубус
2
3
1
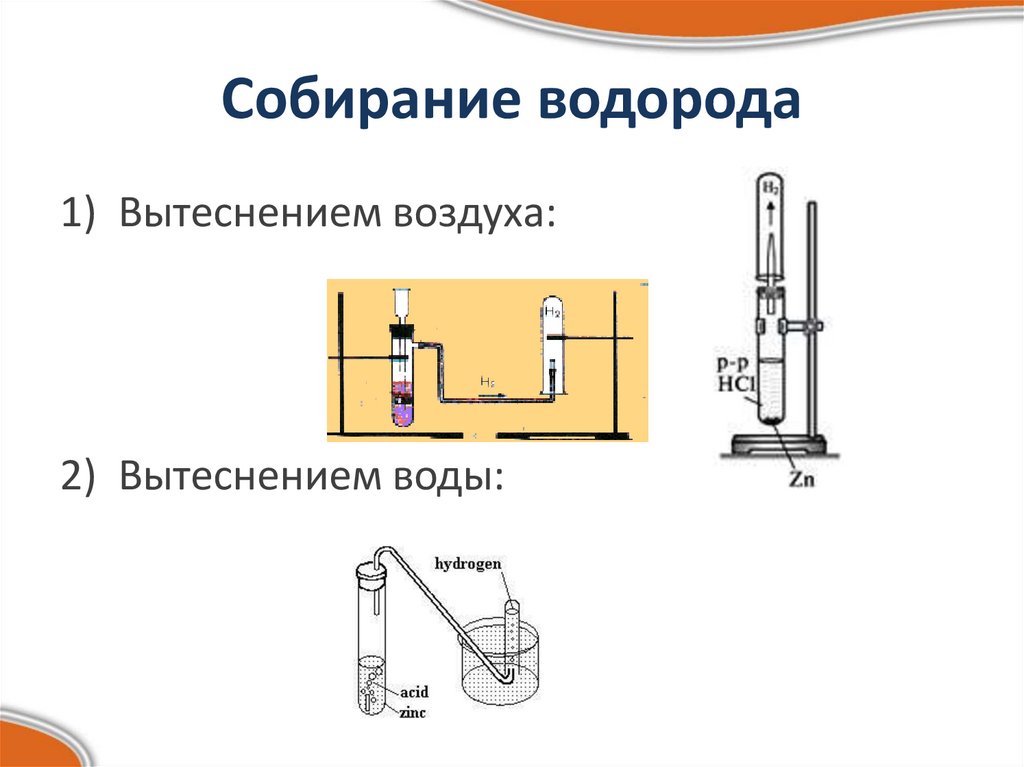
14. Собирание водорода
1) Вытеснением воздуха:2) Вытеснением воды:
15. 9. Применение
1) Химическая промышленность: получениеаммиака, метанола, мыла, пластмасс и др.
16. 9. Применение
2) Пищевая промышленность:а) производство маргарина
б) пищевая добавка Е949 (упаковочный газ)
17. 9. Применение
3) Топливо (ракетное, машинное)18. 9. Применение
4) Военная промышленность (производствоводородных бомб)
19. 9. Применение
5) Резка и сварка металловПламенем водородной горелки
можно резать и сваривать металлы
20. Задание
На каком рисунке (а или б) отображен способ"переливания" водорода из одного сосуда в
другой? Ответ поясните.
21. Задание
Водород является продуктомвзаимодействия:
1) Cu + HCl;
2) Zn + HCl;
3) Cu + H2O;
4) S + NaOH
22. Задание
Водород не реагирует с:1) N2;
2) S;
3) O2;
4) HCl
23. Задание
Водород реагирует:1) только с простыми веществами;
2) с простыми и сложными веществами;
3) только со сложными веществами;
4) только с неметаллами.
24. Задание
Водород реагирует с:1) Н2О;
2) SO3;
3) Cl2;
4) Au
25. Домашнее задание
§17, решить цепочку превращений:+CuO
эл.ток
+C
H2→MgH2 → H2 → X1 → H2 → X2 → H2






















 Химия
Химия








