Похожие презентации:
Подгруппа кислорода (9 класс)
1. Соединения серы
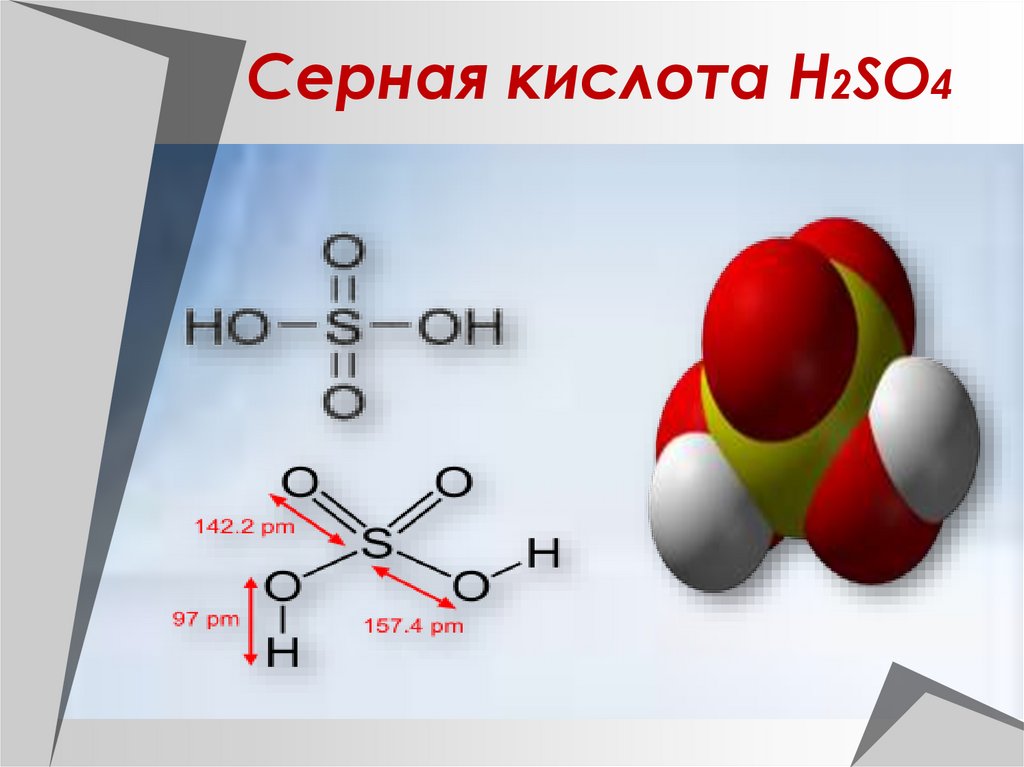
Тема: «Подгруппа кислорода», химия, 9 класс2. Серная кислота Н2SO4
3.
НАХОЖДЕНИЕ В ПРИРОДЕВулкан Малый Семячик
Вулканический хребет длиной около 3
км., на гребне кот орого имеют ся т ри
крат ера.
В южном (крат ер Троицкого) на
глубине 170м. находит ся необычное
кислое
озеро.
Температ ура
эт ого
непрозрачного
озера колеблет ся от +270С до +420С, а
уровень минерализации соот вет ст вует
раст вору серной и соляной кислот
средней
концент рации.
Поражают размеры озера: ширина
около полукиломет ра, а глубина - до
140м.
Сущест вуют
предположения,
чт о
кислот ное
озеро
возникло
сравнит ельно недавно в результ ат е
извержения вулкана, произошедшего
незамет но
для
людей.
3
4. Физические свойства серной кислоты.
Безводная серная кислот а - эт обесцвет ная маслянист ая жидкост ь
без запаха,
смешивает ся с водой в любых
от ношениях,
t пл. =10,30 С, t кип = 2960С,
=1, 84 г/см3.
Обладает
сильным
водоот нимающим дейст вием.
4
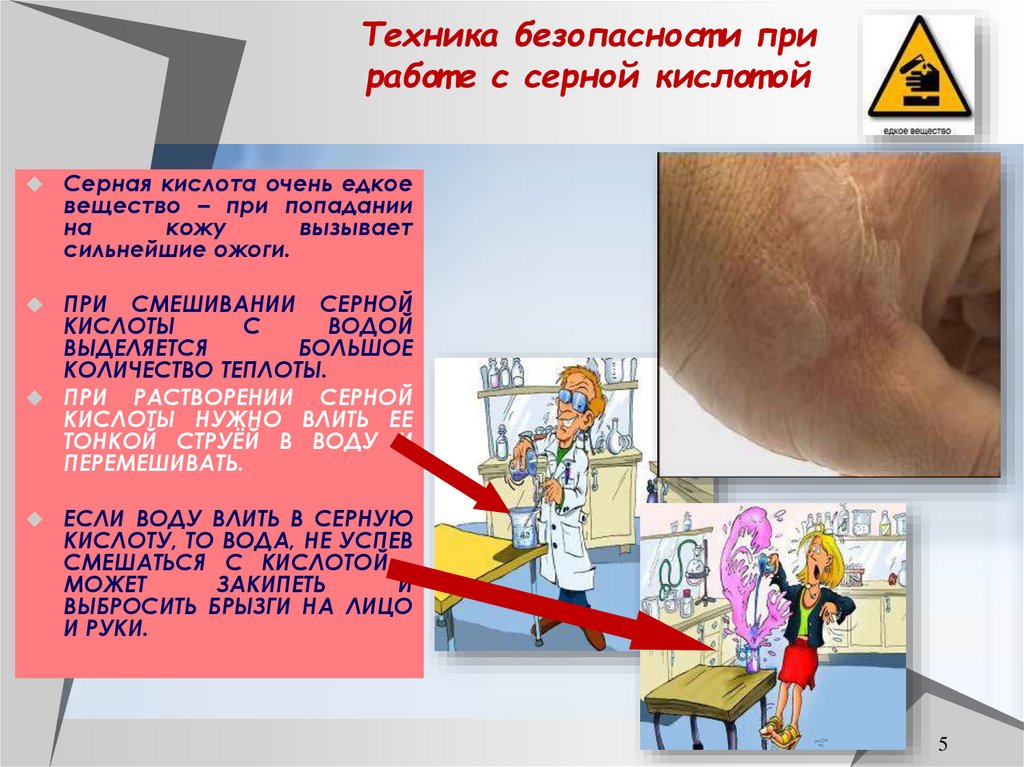
5. Техника безопасности при работе с серной кислотой
Техника безопасност и приработ е с серной кислот ой
Серная кислота очень едкое
вещество – при попадании
на
кожу
вызывает
сильнейшие ожоги.
ПРИ СМЕШИВАНИИ СЕРНОЙ
КИСЛОТЫ
С
ВОДОЙ
ВЫДЕЛЯЕТСЯ
БОЛЬШОЕ
КОЛИЧЕСТВО ТЕПЛОТЫ.
ПРИ РАСТВОРЕНИИ СЕРНОЙ
КИСЛОТЫ НУЖНО ВЛИТЬ ЕЕ
ТОНКОЙ СТРУЁЙ В ВОДУ И
ПЕРЕМЕШИВАТЬ.
ЕСЛИ ВОДУ ВЛИТЬ В СЕРНУЮ
КИСЛОТУ, ТО ВОДА, НЕ УСПЕВ
СМЕШАТЬСЯ С КИСЛОТОЙ ,
МОЖЕТ
ЗАКИПЕТЬ
И
ВЫБРОСИТЬ БРЫЗГИ НА ЛИЦО
И РУКИ.
5
6. ХИМИЧЕСКИЕ СВОЙСТВА
Раст вор серной кислот ы взаимодейст вует смет аллами , ст оящими в ряду акт ивност и
до водорода.
Ag + H2SO4 = т .к. серебро ст оит в ряду
акт ивност и после водорода
2Al + 3H2SO4 = Al2(SO4)3 +3H2
2Al0 + 6H+ = 2Al 3+ +3H20
6
7. Раствор серной кислоты взаимодействует с основными и амфотерными оксидами.
МgO + H2SO4 = MgSO4 + H2OМgO + 2H+ = Mg2+ + H2O
Mn2O7 + H2SO4 = т.к. Mn2O7 -
кислотный оксид
7
8. Серная кислота взаимодействует с основаниями и амфотерными гидроксидами.
2КOН + H2SO4 = К2SO4 + 2H2Oсульфат калия
ОН- + H+ = H2O
КOН + H2SO4 = КНSO4 + Н2O
гидросульфат калия
OН- + 2H+ + SO42- = НSO4- + H2O
8
9. Серная кислота взаимодействует с солями, если образуется газ или осадок.
FeS + H2SO4 =FeSO4 +H2SFeS + 2H+ =Fe2+ +H2S
Mg(NO3)2 + H2SO4 =
Ba(NO3)2 + H2SO4 = BaSO4 + 2HNO3
Ba2+ + SO42- = BaSO4
K2CO3 + H2SO4 = K2SO4 + CO2 + H2O
CO3 2- + 2H+ = CO2 + H2O
9
10. Соли серной кислоты
Серная кислот а как двухосновная кислот аобразует два ряда солей - кислые гидросульфат ы и средние - сульфат ы. В
безводном сост оянии выделены т олько
гидросульфат ы щелочных мет аллов.
Средние сульфат ы (безводные) - как
правило, бесцвет ные крист аллические
вещест ва, склонные к образованию
крист аллогидрат ов (част о окрашеных),
например:
Na2SO4*10H2O - глауберова соль (мирабилит ) бесцвет ная
MgSO4*7H2O - горькая (английская) соль бесцвет ная
CuSO4*5H2O - медный купорос - голубой
FeSO4*7H2O - железный купорос - голубоват озеленый
CaSO4*2H2O - гипс - белый
11. Взаимодействие H2SO4 (конц.) с металлами
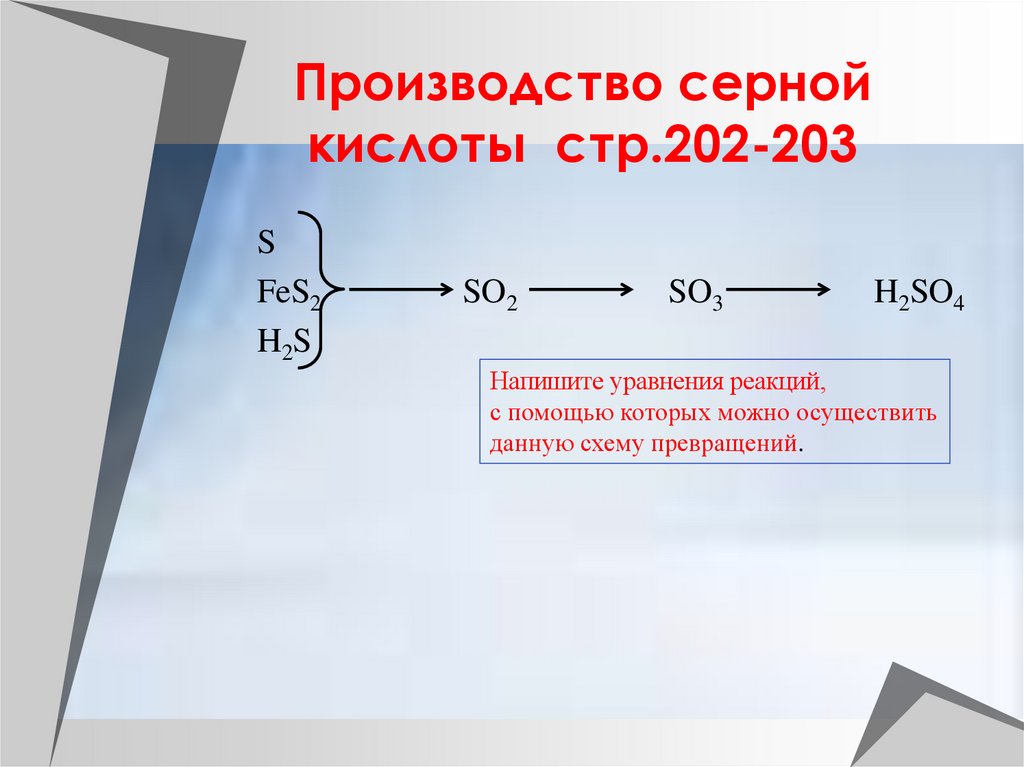
12. Производство серной кислоты стр.202-203
SFeS2
H2S
SO2
SO3
H2SO4
Напишите уравнения реакций,
с помощью которых можно осуществить
данную схему превращений.
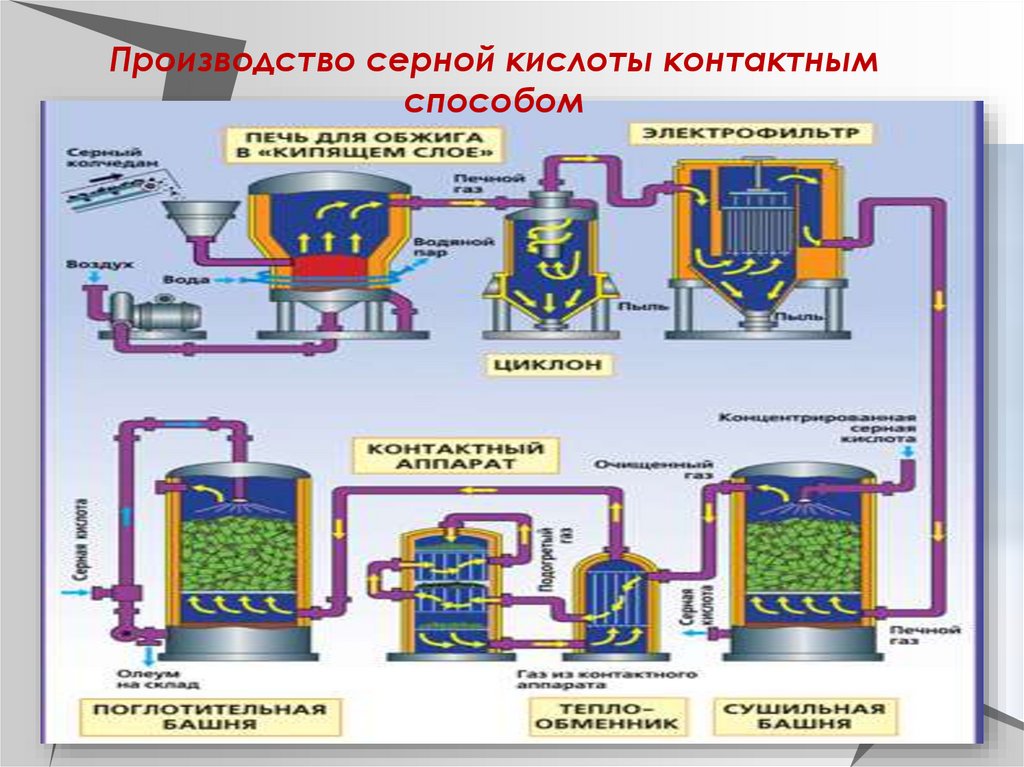
13.
Производство серной кислоты контактнымспособом
14. Серная кислота используется для получения фосфорных и азотных удобрений: простого суперфосфата, двойного суперфосфата,
Серная кислот а использует ся для полученияфосфорных и азот ных удобрений:
прост ого суперфосфат а, двойного суперфосфат а,
преципит ат а и сернокислого аммония.
при производст ве 1 т .
суперфосфат а из фт орапат ит а,
не содержащего
гигроскопической воды,
расходует ся 600 кг. 65процент ной серной кислот ы
14
15. Применение серной кислоты в металлургии
«Травление»–
обнаружение
поверхност и
т рещин
на
мет аллов.
В
гальванических
цехах
серную кислот у используют
для
обезжиривания
поверхност и мет алла перед
нанесением покрыт ия.
Переработ ка
руд
редких
мет аллов
15
16.
Серная кислотаиспользуется в
качестве электролита в
автомобильных
аккумуляторах.
16
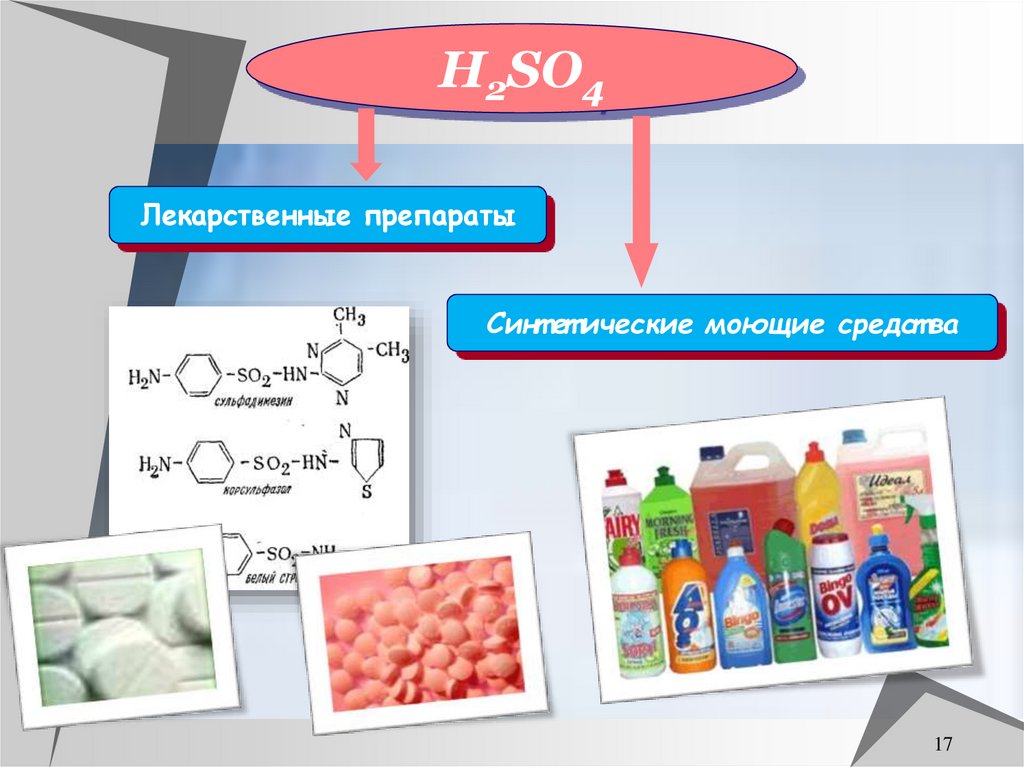
17.
H2SO4Лекарственные препараты
Синт ет ические моющие средст ва
17
18.
Домашнее задание§27
Упр.3 стр.204
письменно
18
19. Осуществите превращения по схеме:
H2SO4+Hg =H2SO4+Fe =
H2SO4+Li =














 Химия
Химия








