Похожие презентации:
Поверхностные процессы (лекция 7)
1.
Федеральное государственное бюджетное образовательное учреждениевысшего образования
Кемеровский государственный медицинский университет
Министерства здравоохранения Российской Федерации
Кафедра фармацевтической и общей химии
Поверхностные процессы
2.
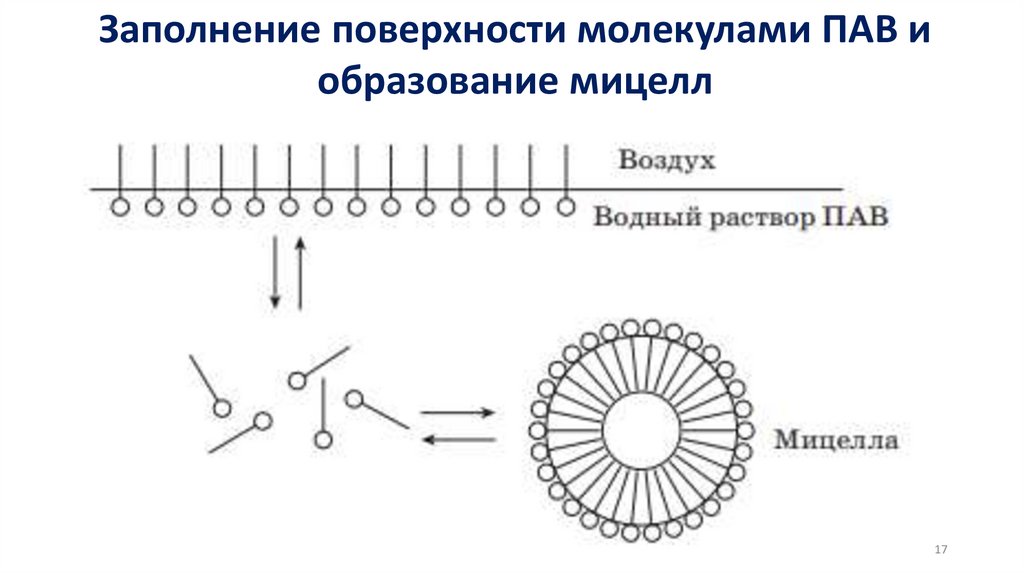
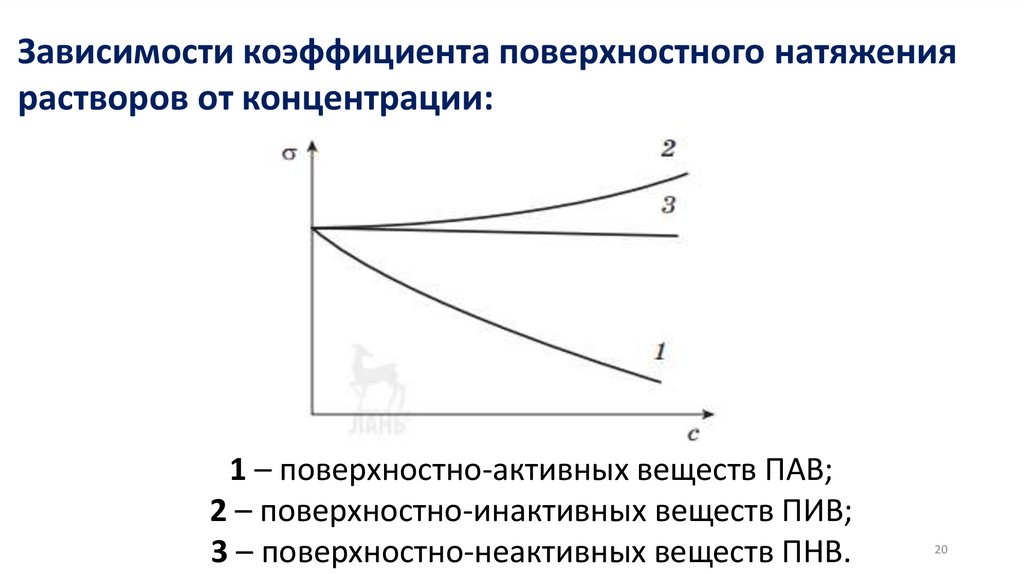
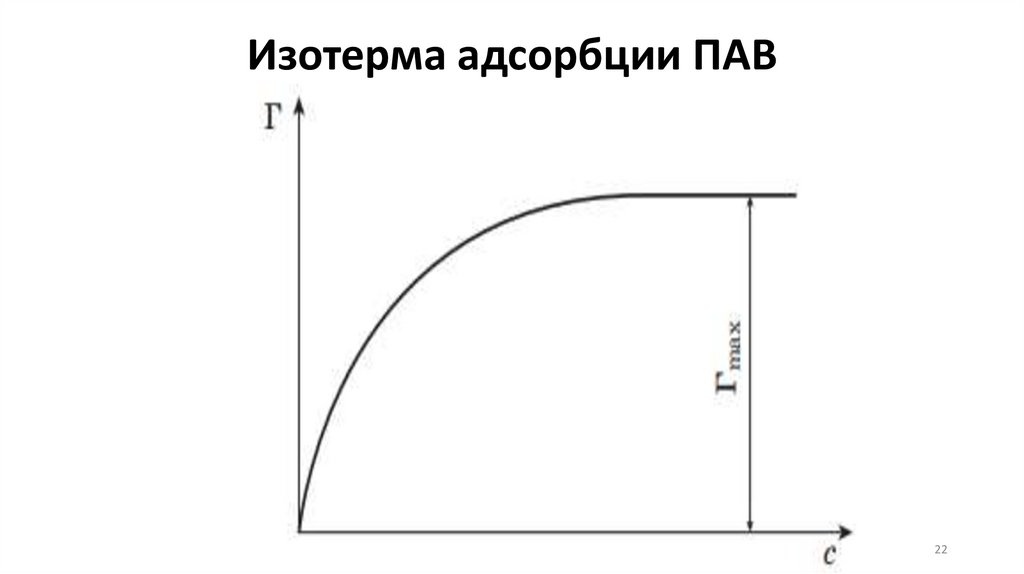
ПЛАН ЛЕКЦИИ:1. Адсорбционные равновесия и процессы. Поверхностная
энергия Гиббса и поверхностное натяжение. Адсорбция.
Поверхностно-активные и поверхностно неактивные
вещества. Изотерма адсорбции. Ориентация молекул в
поверхностном слое и структура биомембран.
2. Значение адсорбционных процессов для
жизнедеятельности.
3. Физико-химические основы адсорбционной терапии,
гемосорбции, применения в медицине ионитов.
2
3.
1. Адсорбционные равновесия и процессы.Поверхностная энергия Гиббса и
поверхностное натяжение. Адсорбция.
Поверхностно-активные и поверхностно
неактивные вещества. Изотерма адсорбции.
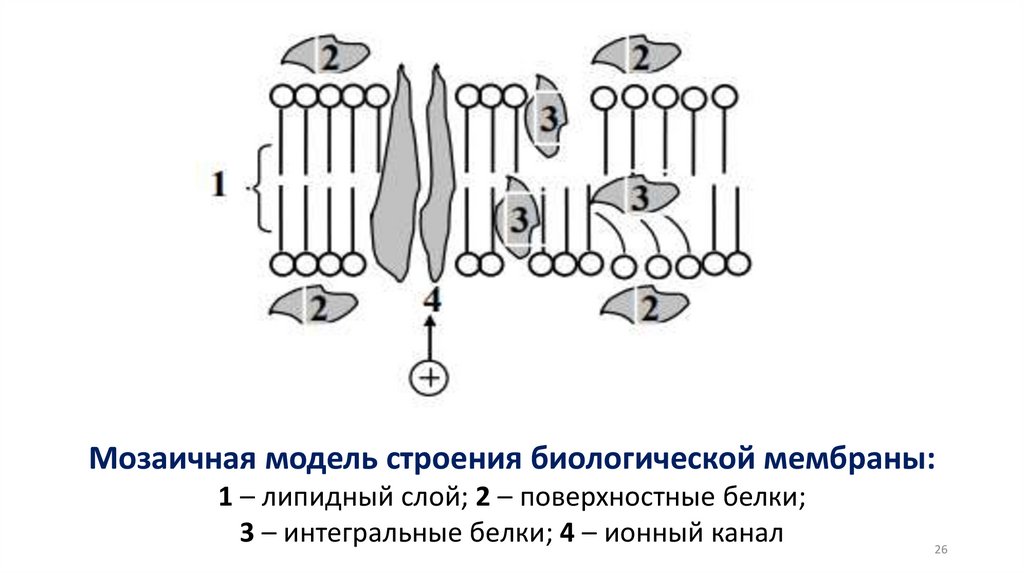
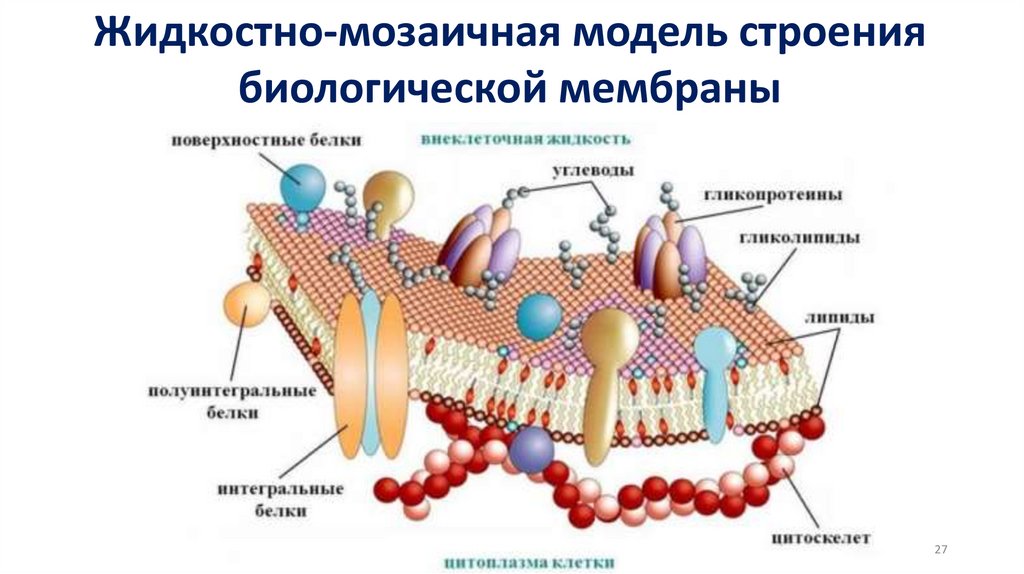
Ориентация молекул в поверхностном слое
и структура биомембран
3
4.
Поверхностные процессы – это явления,происходящие на границе (поверхности)
раздела фаз, обусловленные
особенностями состава и структуры
поверхности (поверхностное натяжение,
сорбция, адгезия, смачивание и др.).
4
5.
Сорбция – поглощение одного вещества другим.Адсорбция – накопление (концентрирование)
одного вещества на поверхности другого (газ –
твердое, жидкость – твердое).
Абсорбция – поглощение одного вещества всем
объемом другого вещества в системах: газ –
жидкость, жидкость – жидкость.
Адсорбент – вещество, на поверхности которого
накапливается другое вещество.
Адсорбат (адсорбтив) – вещество, которое
накапливается на поверхности другого.
5
6.
Хемосорбция – процесс поглощениясопровождающийся химической реакцией
(например, поглощение аммиака водой, диоксида
углерода оксидом кальция).
Десорбция – процесс, обратный адсорбции, то есть
перенос вещества с поверхности раздела фаз в
объём фазы.
6
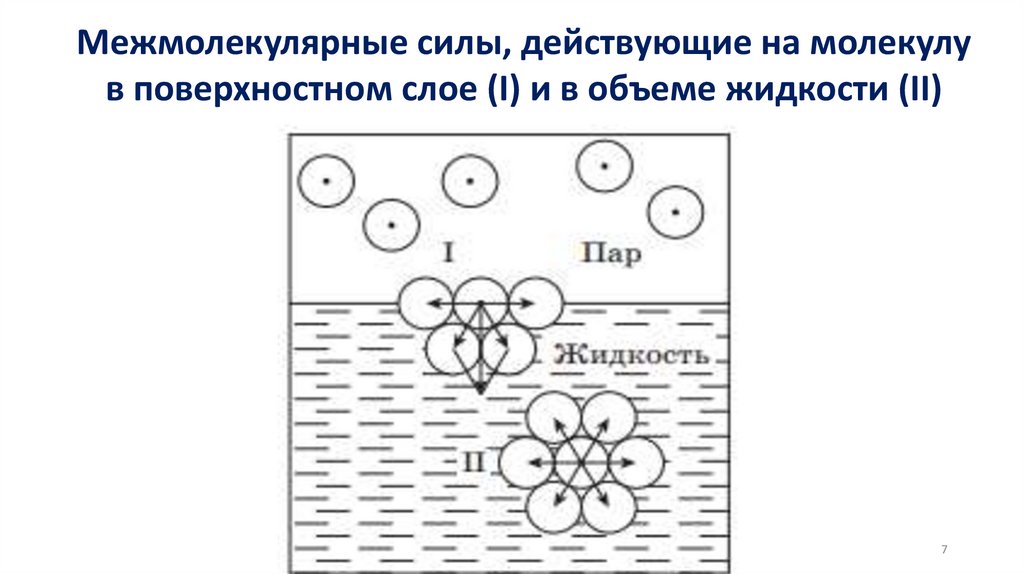
7.
Межмолекулярные силы, действующие на молекулув поверхностном слое (I) и в объеме жидкости (II)
7
8.
Поверхностная энергия Гиббса (Gs) –термодинамическая функция,
характеризующая энергию межмолекулярного
взаимодействия частиц, находящихся на
поверхности раздела, с частицами каждой из
граничащих фаз:
Gs = σ ⋅ S,
где σ – коэффициент поверхностного
натяжения (удельная поверхностная энергия).
8
9.
Коэффициент поверхностного2
натяжения σ (Дж/м или Н/м) –
величина, определяемая
энергией, необходимой для
увеличения поверхности жидкости
на единицу площади.
9
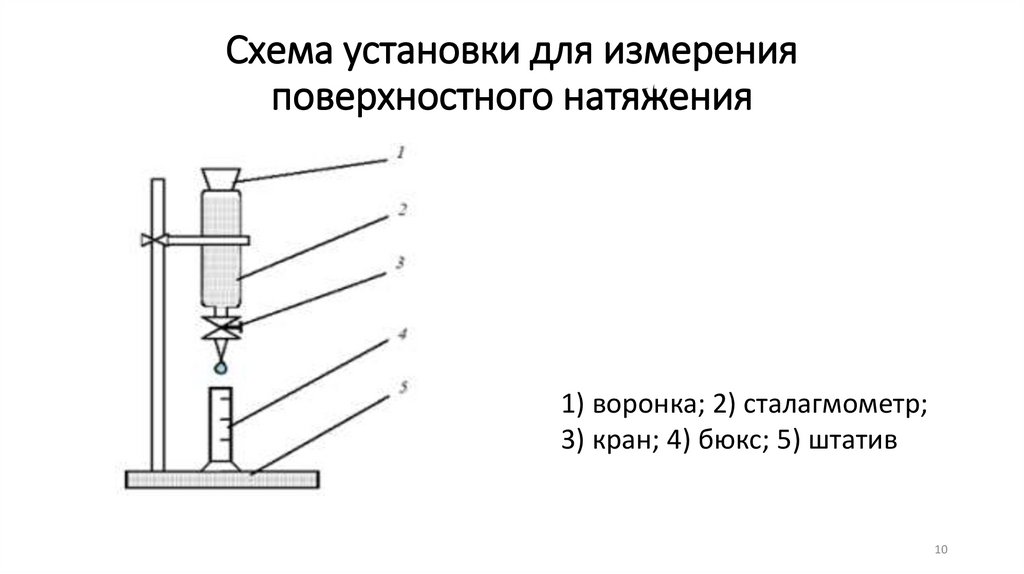
10.
Схема установки для измеренияповерхностного натяжения
1) воронка; 2) сталагмометр;
3) кран; 4) бюкс; 5) штатив
10
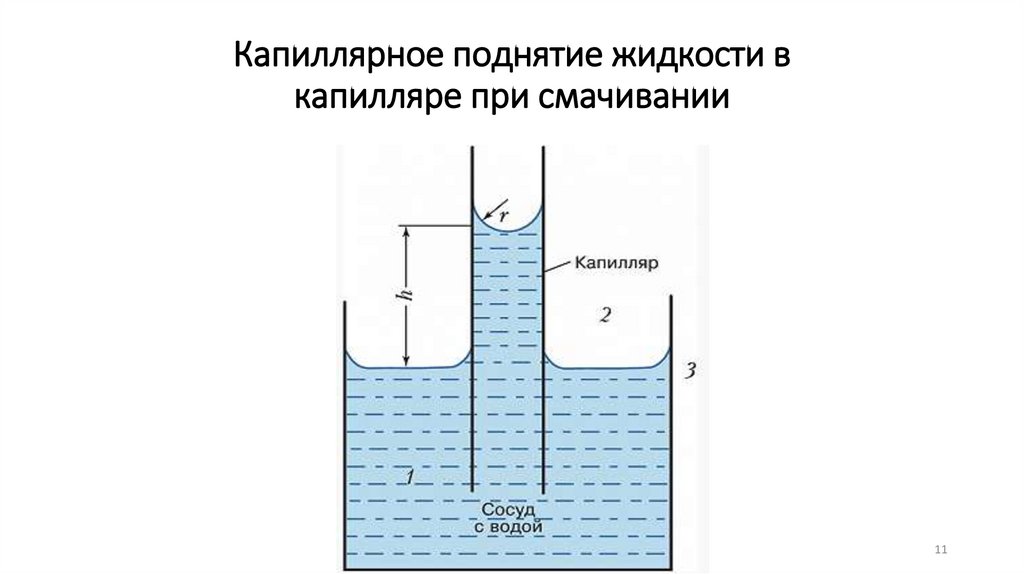
11.
Капиллярное поднятие жидкости вкапилляре при смачивании
11
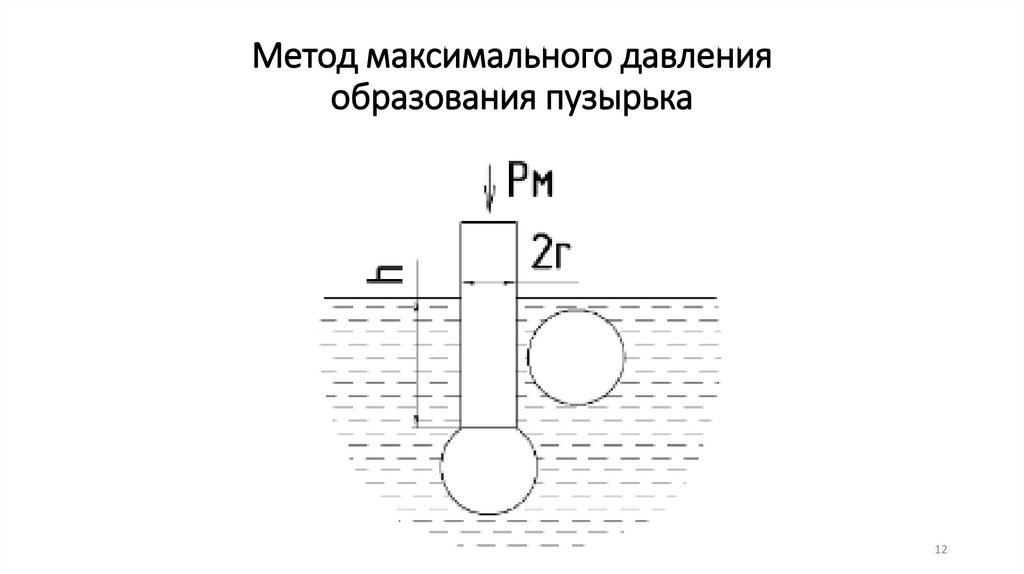
12.
Метод максимального давленияобразования пузырька
12
13.
Самопроизвольные поверхностные явления суменьшением поверхностной энергии (ΔGs < 0)
возможны за счет уменьшения :
1) площади поверхности раздела фаз (ΔS < 0);
2) поверхностного натяжения (Δσ < 0).
13
14.
Положительная адсорбция –концентрирование вещества (адсорбата) в
поверхностном слое.
Отрицательная адсорбция –
концентрация вещества в объеме фазы
больше, чем в поверхностном слое.
Мера адсорбции – величина адсорбции
Γ – количество растворенного вещества,
приходящегося на единицу площади
поверхности (моль/м2).
14
15.
Уравнение Гиббса:Сср











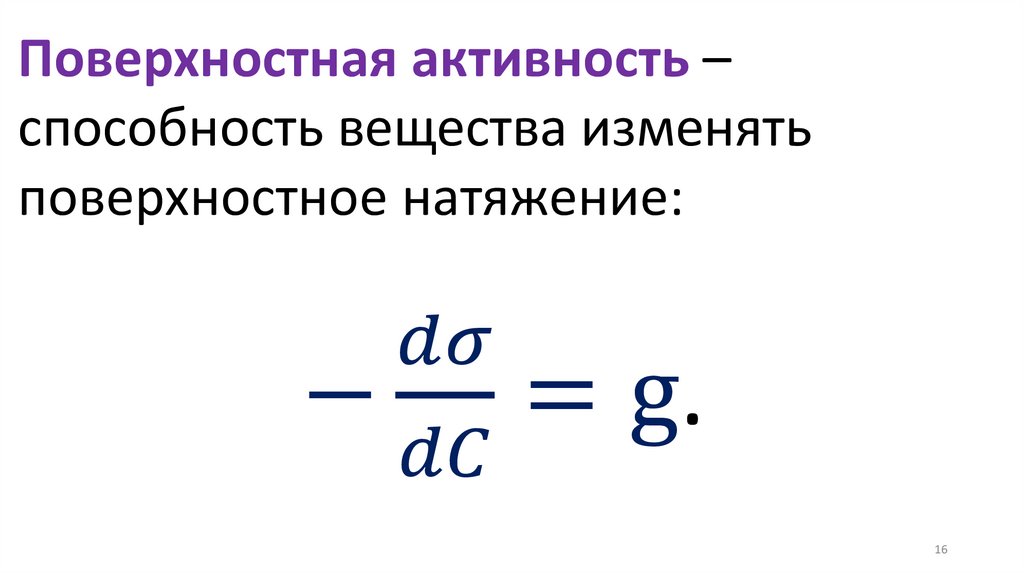











 Химия
Химия








