Похожие презентации:
Железо
1.
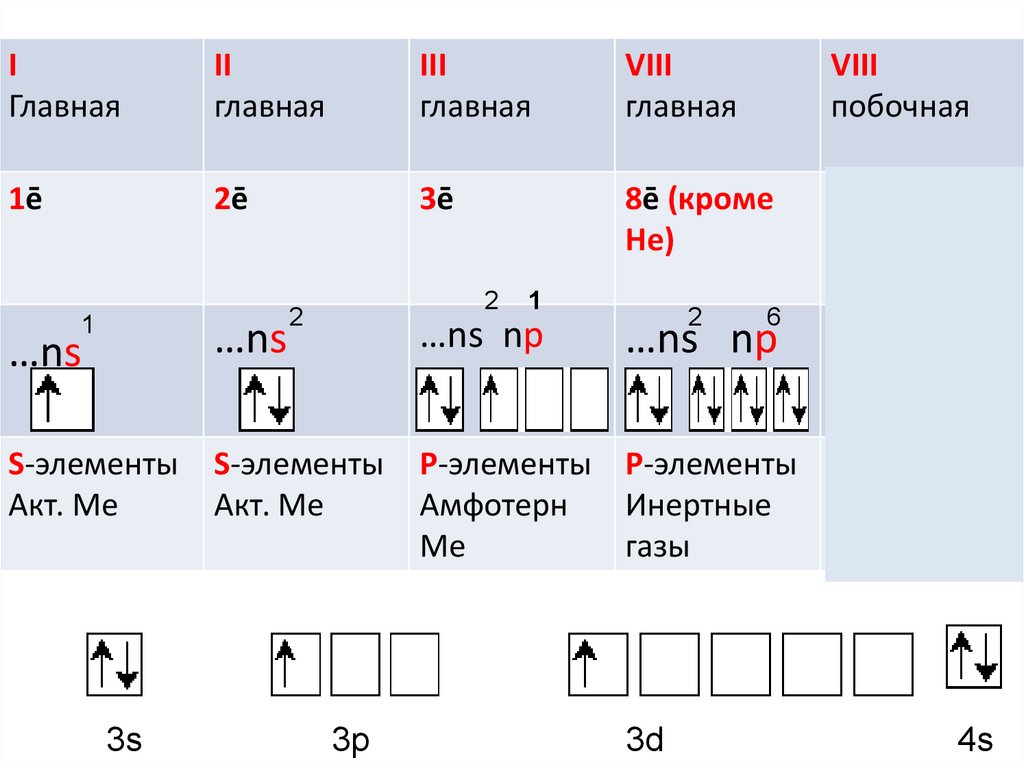
IГлавная
II
главная
III
главная
VIII
главная
VIII
побочная
1ē
2ē
3ē
8ē (кроме
Не)
?
1
2
2
…ns np
…ns
…ns
S-элементы
Акт. Ме
S-элементы
Акт. Ме
3s
1
3p
2
6
…ns np
Заполняется
d-подуровень
P-элементы P-элементы d –элементы
Амфотерн
Инертные
Только ме
Ме
газы
3d
4s
2.
Электронное строение атома:В атоме кальция 4 энергетических уровня,
электроны расположены следующим образом:
+20Ca: 2ē 8ē 8ē 2ē
Электронная формула: 1S22S2 2P63S23P64S2
1S 2S
2P
3S
См другую презент. Сл №5
3P
4S
3. Железо – d элемент (…3d64s2)
-2ē-3ē
0
+2
+2,+3
Fe
Fe
Fe
Слабые
окислители:
растворы HCl,
H2SO4
растворы
солей (CuSO4)
сера (S)йод (I2)
O2 (t), H2O
(t)→
Fe3O4
(железная
окалина)
+3
Fe
Сильные окислители:
Гал2 (Cl2, Br2), HNO3,
H2SO4(к)
H2SO4(к) и HNO3(к) при
комнат. t пассивируют
железо (как и
алюминий)
4.
Fe+2Fe+2 +3
Fe+3
Привести уравнения реакций со стр.203-204
5.
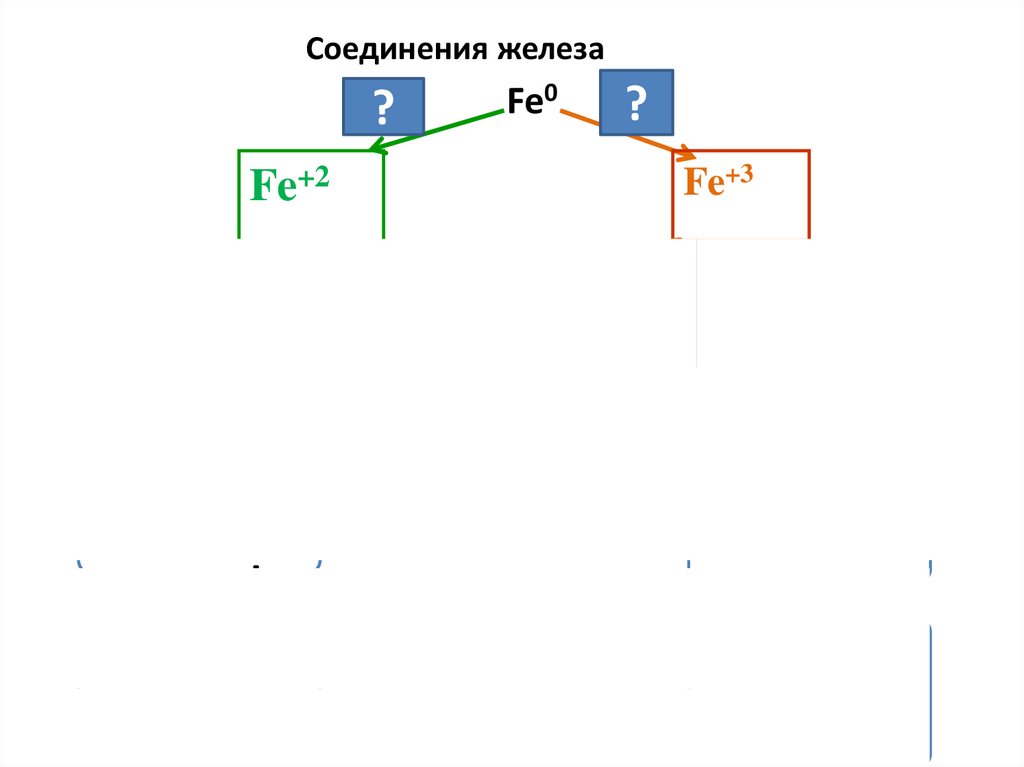
Соединения железаFe0
HCl
?
Fe+2
Легко
окисляются,
восстановители
Fe(OH)2
Cl?2
Fe+3
окисление
OH-
OH-
+О2, Н2О
окисление
Устойчивы,
окислители
Fe(OH)3
t
t
FeO
Fe2O3
основный
амфотерный
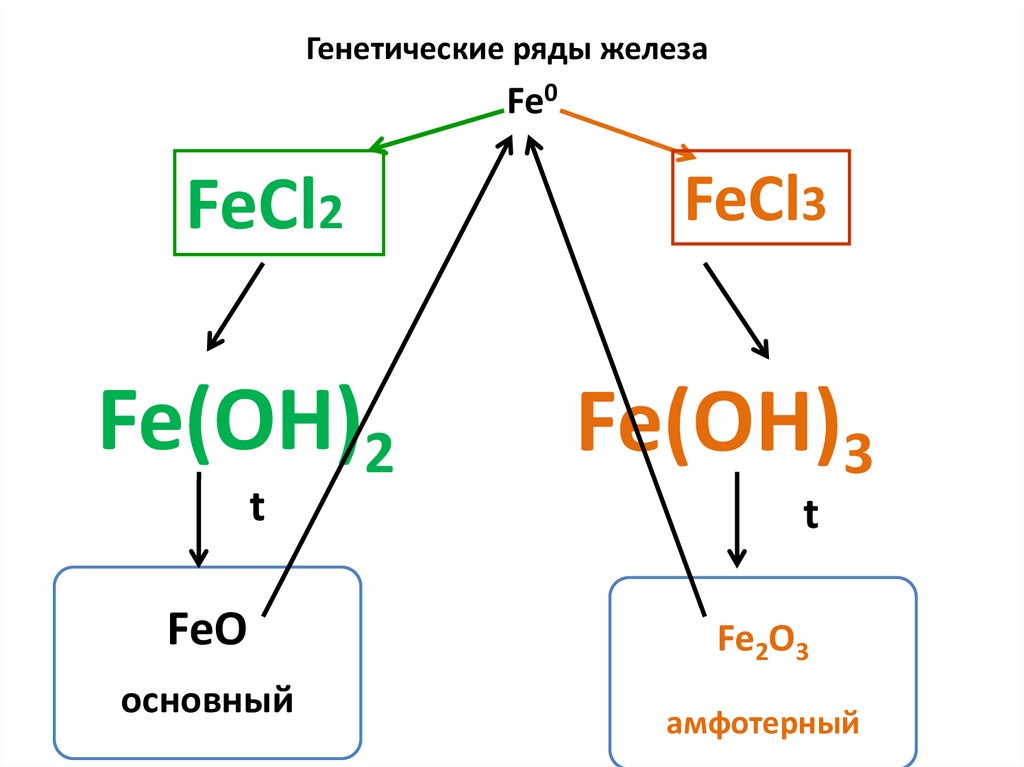
6.
Генетические ряды железаFe0
FeCl2
Fe(OH)2
t
FeO
основный
FeCl3
Fe(OH)3
t
Fe2O3
амфотерный



 Химия
Химия








