Похожие презентации:
Дисперсные системы
1.
Федеральное государственное бюджетное образовательное учреждениевысшего образования
Кемеровский государственный медицинский университет
Министерства здравоохранения Российской Федерации
Кафедра фармацевтической и общей химии
Дисперсные системы
2.
ПЛАН ЛЕКЦИИ:1. Классификация дисперсных систем. Диализ,
электродиализ.
2. Устойчивость дисперсных систем.
Седиментационная и агрегативная устойчивость
лиозолей.
3. Принципы функционирования искусственной
почки.
2
3.
1. Классификация дисперсных систем.Диализ, электродиализ
3
4.
Дисперсные системы – гетерогенныесистемы, в которых одна фаза является
непрерывной, а другая представляет
собой совокупность частиц, размеры
которых превосходят молекулярные.
Непрерывная фаза (дисперсионная среда),
совокупность частиц (дисперсная фаза).
4
5.
Классификационные признаки дисперсных систем:– агрегатное состояние фаз;
– размер частиц дисперсной фазы;
– характер взаимодействия между дисперсной
фазой и дисперсионной средой;
– структурно-механические свойства;
– седиментационная устойчивость и др.
5
6.
Классификация коллоидных систем по агрегатномусостоянию дисперсной фазы и дисперсионной среды
Агрегатное
состояние
дисперсионной
среды
Тип системы
Газ
Аэрозоль
Жидкость
Лиозоль
Агрегатное состояние
дисперсной фазы
Жидкость
Твердое тело
Газ
Жидкость
Твердое тело
Газ
Твердое тело Солидозоль
Жидкость
Система
Туман
Дым
Пена
Эмульсия
Суспензия
Твердая пена
(пемза)
Твердый
эмульсоид
6
7.
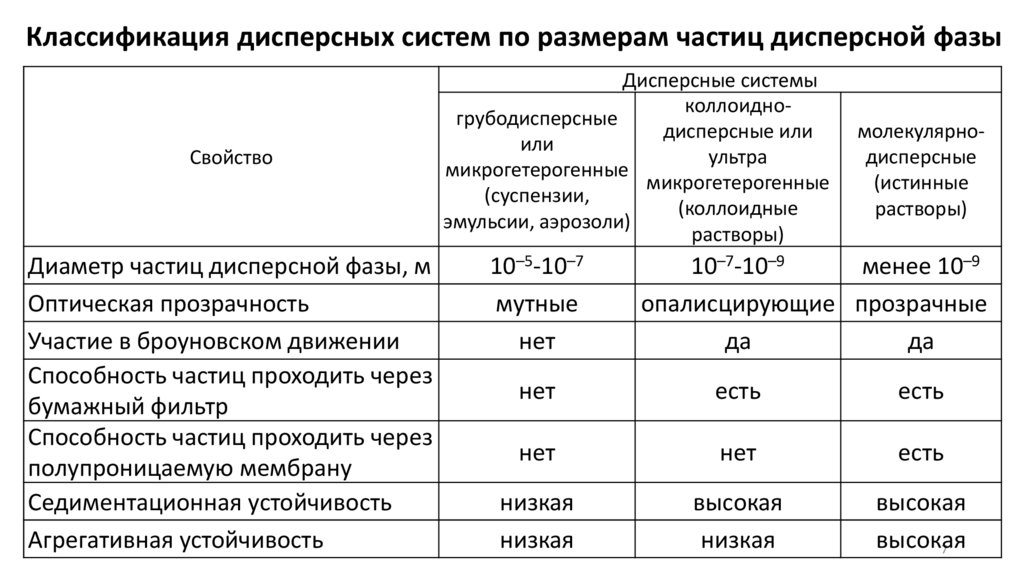
Классификация дисперсных систем по размерам частиц дисперсной фазыСвойство
Диаметр частиц дисперсной фазы, м
Оптическая прозрачность
Участие в броуновском движении
Способность частиц проходить через
бумажный фильтр
Способность частиц проходить через
полупроницаемую мембрану
Седиментационная устойчивость
Агрегативная устойчивость
Дисперсные системы
коллоидногрубодисперсные
дисперсные или
или
ультра
микрогетерогенные
микрогетерогенные
(суспензии,
(коллоидные
эмульсии, аэрозоли)
растворы)
10–5-10–7
мутные
нет
молекулярнодисперсные
(истинные
растворы)
10–7-10–9
менее 10–9
опалисцирующие прозрачные
да
да
нет
есть
есть
нет
нет
есть
низкая
низкая
высокая
низкая
высокая
высокая
7
8.
Лиофобные золи – коллоидные системы со слабымвзаимодействием между дисперсной фазой и дисперсионной
средой называют (необратимые системы).
Лиофильные – с сильным взаимодействием (обратимые
системы).
Если дисперсионная среда – вода – системы гидрофобные или
гидрофильные (соответственно).
Связаннодисперсные системы (гели) – если в коллоидной
системе существуют устойчивые связи между частицами
дисперсной фазы.
Свободнодисперсные (коллоидные растворы) – связи
отсутствуют.
8
9.
Условия получения коллоидных растворов:1) обеспечить коллоидную степень
дисперсности;
2) подобрать дисперсионную среду, в которой
нерастворимо вещество дисперсной фазы;
3) подобрать третий компонент – стабилизатор,
сообщающий коллоидной системе
устойчивость.
9
10.
Способы достижения коллоидной степени дисперсности:– диспергирование – получение частиц дисперсной фазы путем дробления
более крупных частиц;
– конденсация – получение частиц дисперсной фазы путем объединения
атомов, молекул, ионов.
Способы достижения степени дисперсности, соответствующей коллоидным
10
системам (d – диаметр частиц)
11.
Фильтрация основана наспособности коллоидных частиц
проходить через поры обычных
фильтров.
11
12.
Диализ – удаление с помощьюмембран низкомолекулярных
соединений из коллоидных
растворов и растворов
высокомолекулярных соединений.
12
13.
Электродиализ используют дляувеличения скорости диализа
низкомолекулярных электролитов.
13
14.
Ультрафильтрацию применяютдля очистки систем, содержащих
частицы коллоидных размеров
(золи, растворы ВМС, взвеси
бактерий и вирусов).
14
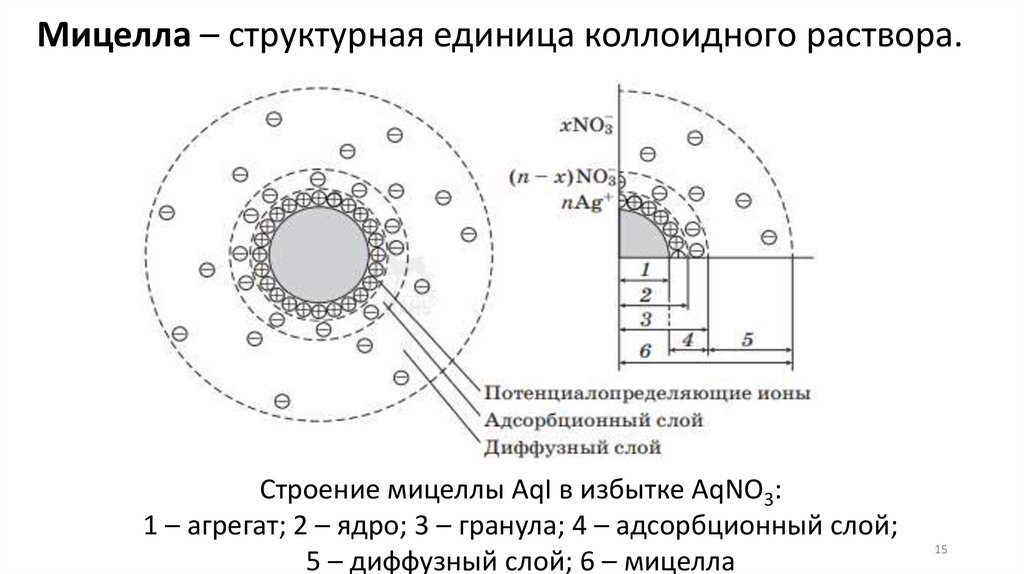
15.
Мицелла – структурная единица коллоидного раствора.Строение мицеллы AqI в избытке AqNO3:
1 – агрегат; 2 – ядро; 3 – гранула; 4 – адсорбционный слой;
5 – диффузный слой; 6 – мицелла
15
16.
Рассмотрим строение мицеллызоля:
AgNO3 + KI → KNO3 + AgI↓
16
17.
Схема мицеллы (избыток AqNO3):m – число формульных единиц AgI в агрегате; n – количество
потенциалопределяющих ионов; х – число противоионов в составе
17
диффузного слоя
18.
Мицелла (избыток KI):–
+
x–
+
{m[AgI] nI (n – x)K } xK
18
19.
Получение золя железисто-синеродистой меди(гексоцианоферрат II меди):
а) в избытке CuSO4;
б) в избытке K4[Fe(CN)6].
2CuSO4 + K4[Fe(CN)6] → Cu2[Fe(CN)6]↓ + 2K2SO4
19
20.
2+2–
2х+
2–
а) {m[Cu2(FeCN)6] nCu (n – x)SO4 } хSO4
4–
+
х–
+
б) {m[Cu2(FeCN)6] n[Fe(CN)6] 4(n – x)K } xK
20
21.
Получение золя диоксида марганцаметодом восстановления:
KMnO4 + Na2S2O3 + H2O →
21
22.
8KMnO4 + 3Na2S2O3 + H2O →→ 8MnO2↓ + 3K2SO4 + 2KOH + 3Na2SO4
–
+
х–
+
{mMnO2 nMnO4 (n – x)K } xK
22
23.
2. Устойчивость дисперсных систем.Седиментационная и агрегативная
устойчивость лиозолей.
23
24.
Виды устойчивости дисперсныхсистем:
– кинетическая (седиментационная);
– агрегативная.
24
25.
Седиментационная устойчивость –это устойчивость частиц к оседанию
под действием силы тяжести.
25
26.
Агрегативная устойчивость – этоспособность дисперсных систем
сохранять размер частиц,
противостоять их агрегации
(укрупнению).
26
27.
Грубодисперсные системыседиментационно неустойчивы
(системам не свойственно
броуновское движение)
27
28.
Коллоидно-дисперсные системыседиментационно устойчивыми
(частицы дисперсной фазы
принимают участие в
броуновском движении)
28
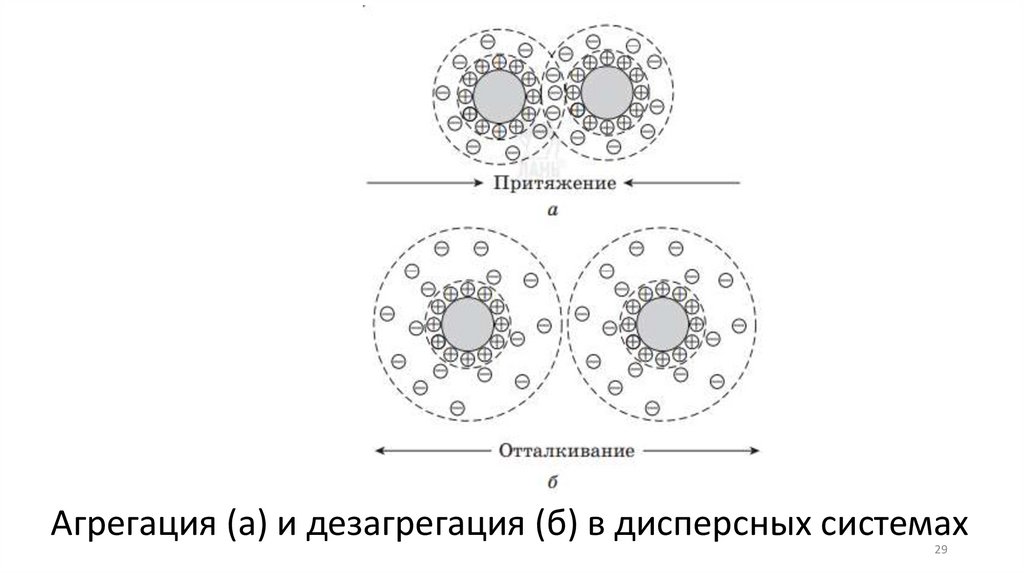
29.
Агрегация (а) и дезагрегация (б) в дисперсных системах29
30.
3031.
Факторы, вызывающие коагуляцию коллоидныхрастворов:
– изменение концентрации коллоидного раствора;
– диализ;
– механическое воздействие;
– изменение температуры;
– различные виды излучений;
– добавление электролитов.
31
32.
Порог коагуляции (Спор) – критическая концентрацияиона в золе:
С Х ×















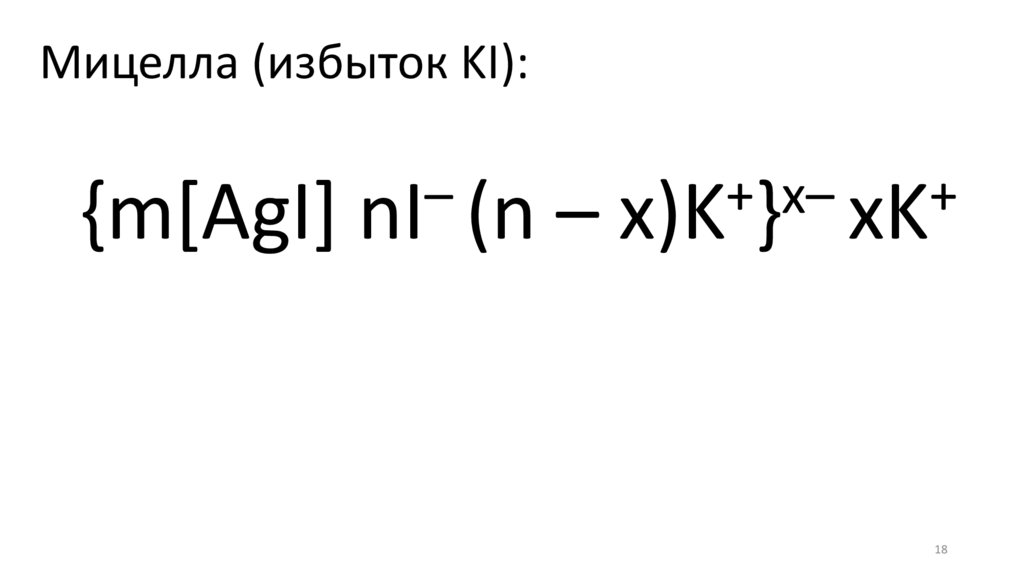

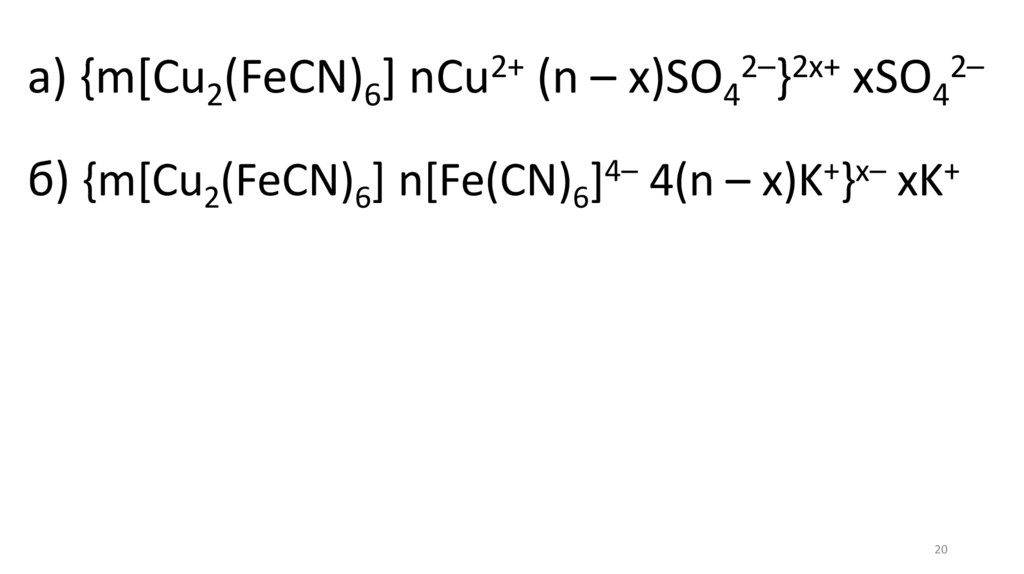

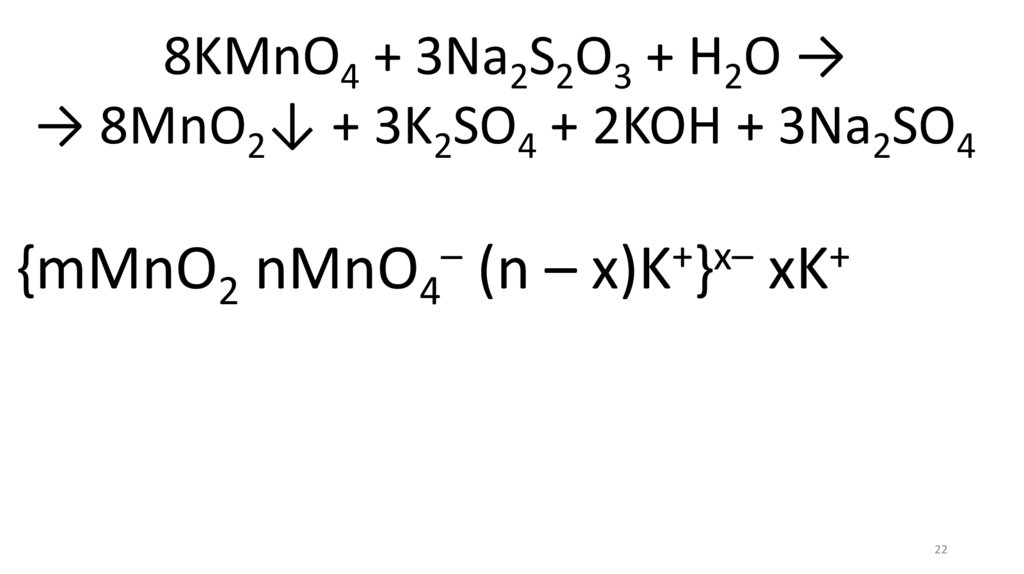















 Химия
Химия








