Похожие презентации:
Влияние температуры на скорость ферментативнокатализируемой реакции
1.
Министерство науки и высшего образования Российской ФедерацииФедеральное государственное бюджетное образовательное учреждение высшего образования
«Уфимский государственный нефтяной технический университет»
Кафедра биохимии и технологии микробиологического производства
Презентация на тему:
«Влияние температуры на скорость ферментативнокатализируемой реакции»
По дисциплине: «Избранные главы биохимии»
Выполнил:
студент гр. МФБ-23-01
А.Н. Максимова
Проверил:
Д.х.н., профессор
В.В. Зорин
Уфа-2023
2.
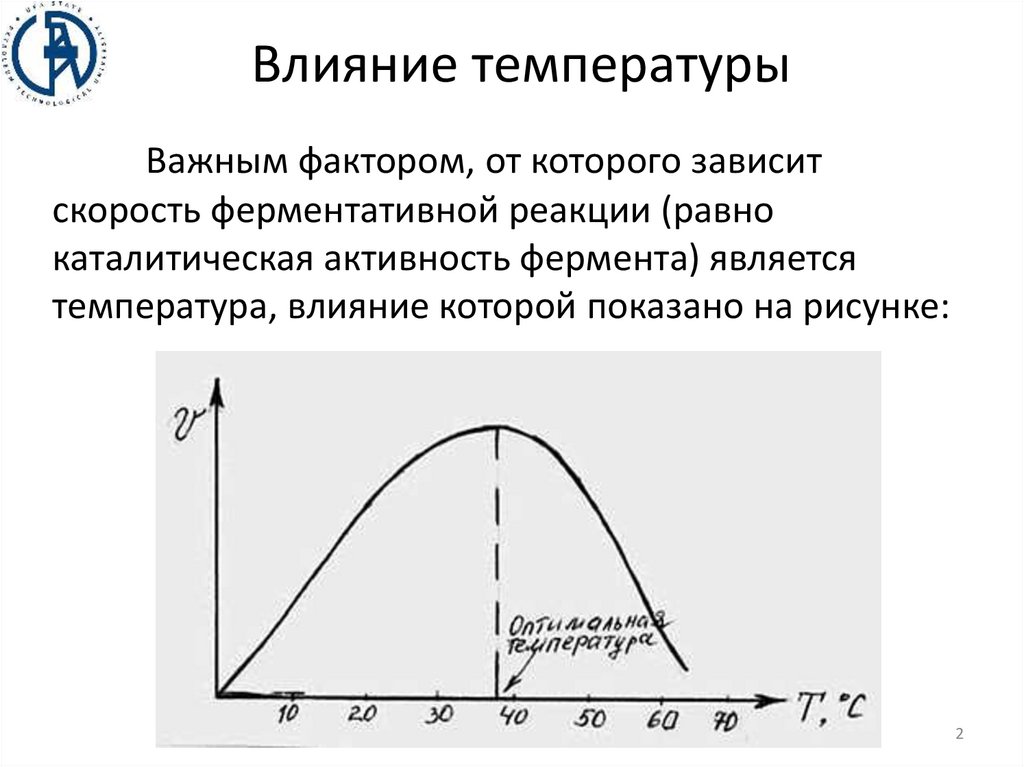
Влияние температурыВажным фактором, от которого зависит
скорость ферментативной реакции (равно
каталитическая активность фермента) является
температура, влияние которой показано на рисунке:
2
3.
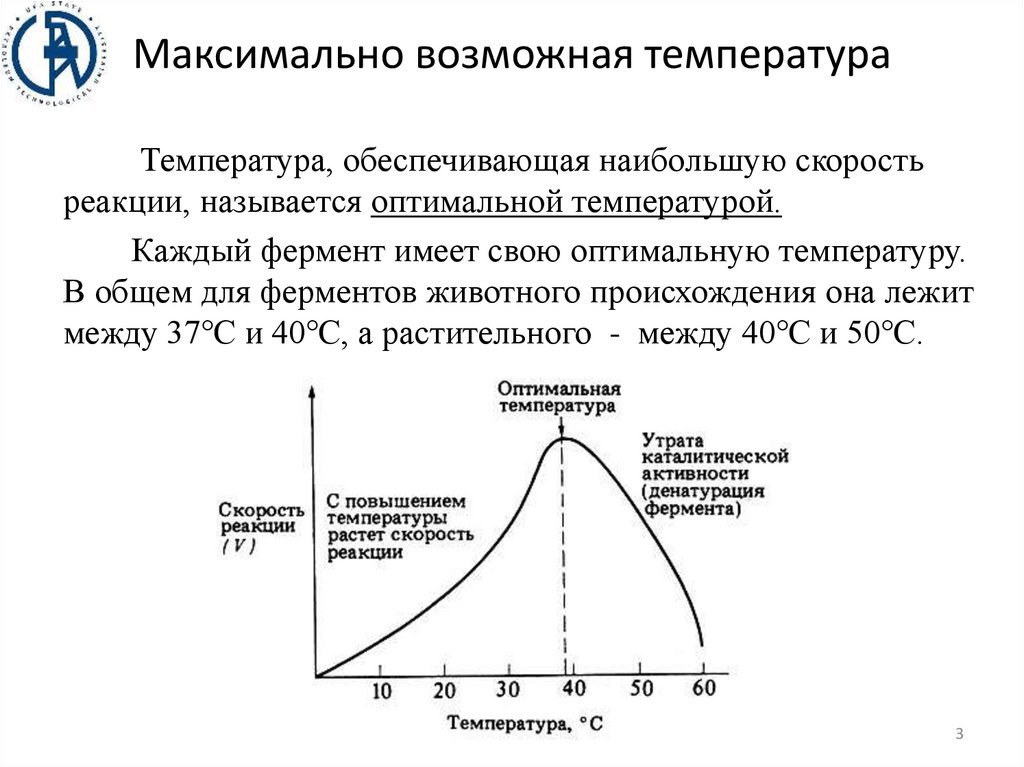
Максимально возможная температураТемпература, обеспечивающая наибольшую скорость
реакции, называется оптимальной температурой.
Каждый фермент имеет свою оптимальную температуру.
В общем для ферментов животного происхождения она лежит
между 37℃ и 40℃, а растительного - между 40℃ и 50℃.
3
4.
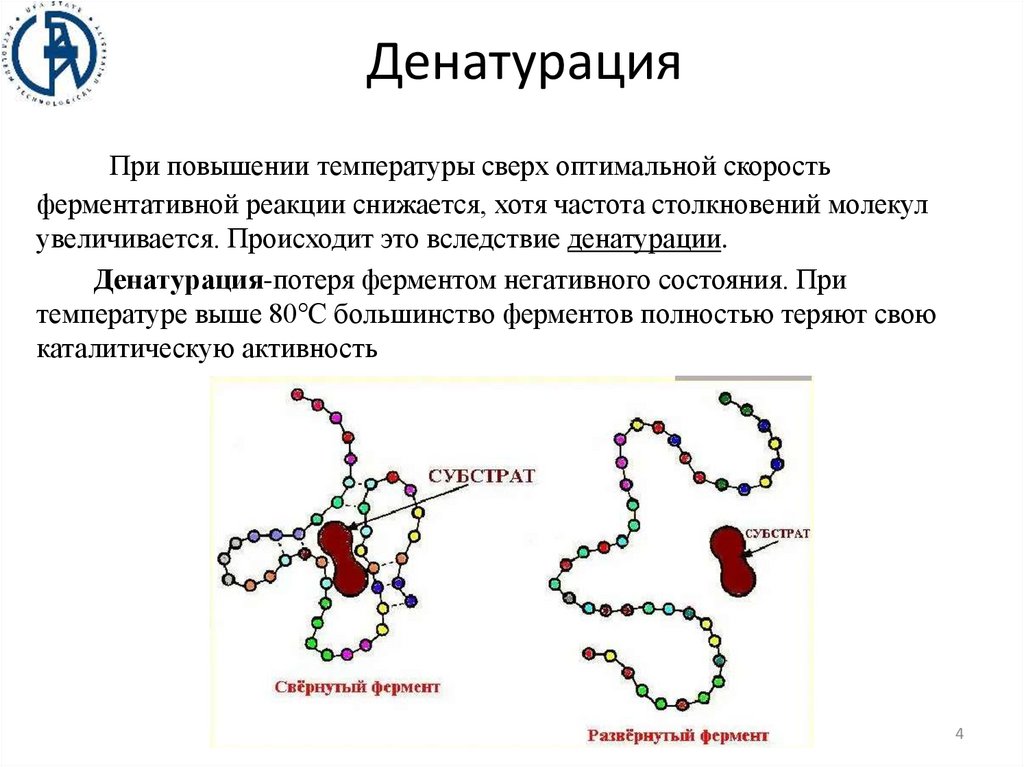
ДенатурацияПри повышении температуры сверх оптимальной скорость
ферментативной реакции снижается, хотя частота столкновений молекул
увеличивается. Происходит это вследствие денатурации.
Денатурация-потеря ферментом негативного состояния. При
температуре выше 80℃ большинство ферментов полностью теряют свою
каталитическую активность
4
5.
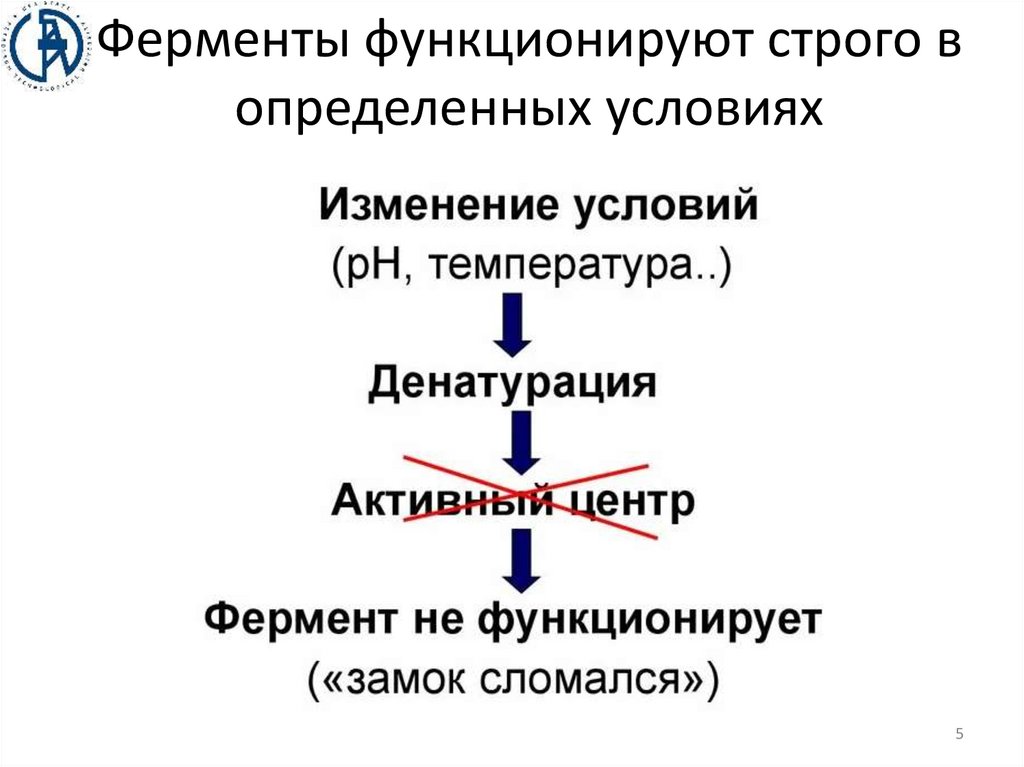
Ферменты функционируют строго вопределенных условиях
5
6.
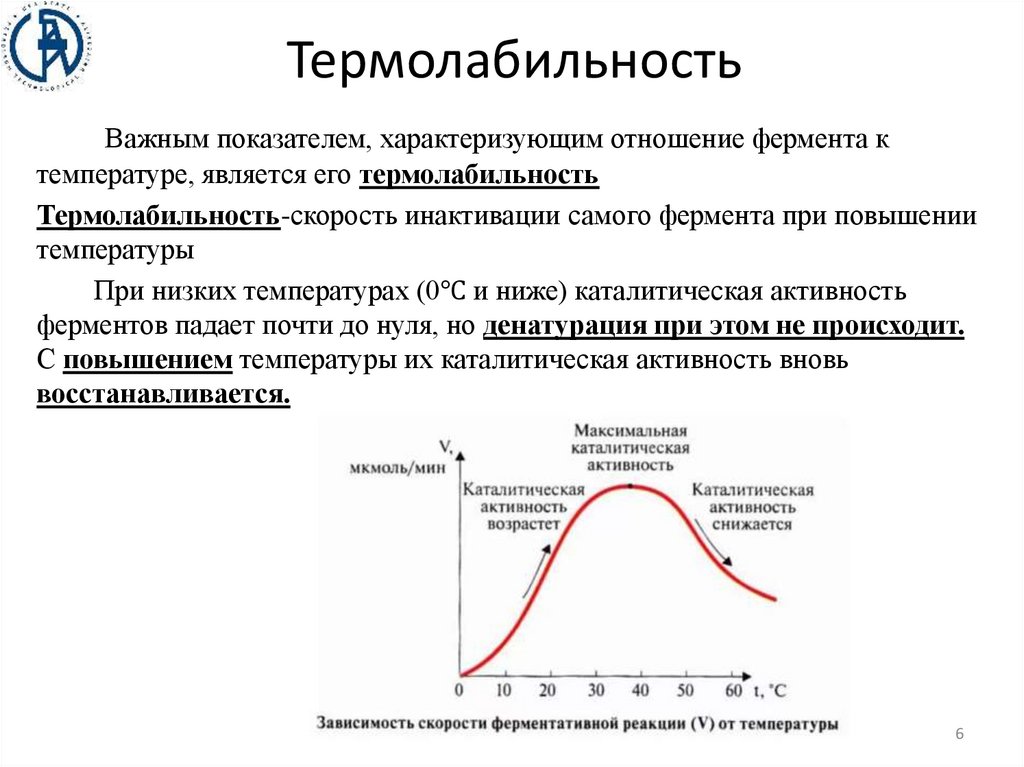
ТермолабильностьВажным показателем, характеризующим отношение фермента к
температуре, является его термолабильность
Термолабильность-скорость инактивации самого фермента при повышении
температуры
При низких температурах (0℃ и ниже) каталитическая активность
ферментов падает почти до нуля, но денатурация при этом не происходит.
С повышением температуры их каталитическая активность вновь
восстанавливается.
6
7.
Влияние температуры на скоростьреакции. Правило Вант-Гоффа
7
8.
Влияние температуры на скоростьреакции. Правило Вант-Гоффа
Число, показывающее, во сколько раз возрастает константа скорости
при повышении температуры на десять градусов, называется
температурным коэффициентом константы скорости, обозначается .
Правило Вант-Гоффа - приближенное, так как температурный
коэффициент сохраняет постоянное значение только в узкой температурной
области.
kT 10
2 4
kT
kT2
kT1
Т
10
8
9.
Энергия активации. ТеорияАррениуса.
Более точную зависимость скорости химической
реакции от температуры экспериментально установил
Аррениус, предложивший уравнение:
dlnK
E
dT
RT 2
где Е - энергия активации; К - константа скорости.
Еакт - некоторое избыточное количество энергии (по
сравнению со средней), необходимое для вступления молекул
в реакцию.
кДж
Еакт
моль
Еакт зависит от природы реагирующих веществ и
служит характеристикой каждой реакции
9
10.
Уравнение Аррениуса10






 Химия
Химия








