Похожие презентации:
Кинетика химических реакций
1.
Занятие 12Кинетика
химических
реакций
2.
СОДЕРЖАНИЕ ЗАНЯТИЯ• Модуль 1. Основные понятия кинетики
• Модуль 2. Понятие кинетики
• Модуль 3. Понятие кинетики
3.
Модуль 1. Основные понятия кинетикиБертоле
Клод Луи
Якоб Хендрик
Вант-Гофф
Сванте Август
Аррениус
• Кинетика (др.греч.
«движение») химических
реакций – раздел
физической химии,
изучающий закономерности
протекания химических
реакций во времени,
зависимости этих
закономерностей от
внешних условий, а также
механизмы химических
превращений
Основоположники
4.
Виды химических реакций• Гомогенная реакция —
реакция, в которой
реагирующие вещества
находятся в одной фазе
(газ-газ, жидкостьжидкость, твердое
вещество-твердое
вещество).
• Гетерогенная реакция —
реакция, происходящая на
границах раздела фаз (газ
- раствор, раствор-твёрдое
вещество, твёрдое и
газообразное вещества)
Реакция называется
простой, если продукт
образуется в результате
непосредственного
взаимодействия молекул
(частиц) реагентов.
Реакция называется
сложной, если конечный
продукт получается в
результате осуществления
двух и более простых
реакций (элементарных
актов) с образованием
промежуточных продуктов
5.
Молекулярность реакцииН2S= H2+S
CH3Br+KOH= CH3 OH+ KBr
NO+NO+O2=2NO3
Молекулярность элементарной реакции —
число частиц, которые, согласно
экспериментально установленному
механизму реакции, участвуют в
элементарном акте химического
взаимодействия:
Мономолекулярные реакции — реакции, в
которых происходит химическое
превращение одной молекулы
(изомеризация, диссоциация и т. д.):
Бимолекулярные реакции — реакции,
элементарный акт которых осуществляется
при столкновении двух частиц (одинаковых
или различных):
Тримолекулярные реакции — реакции,
элементарный акт которых осуществляется
при столкновении трёх частиц:
Одновременное столкновение более трёх
молекул практически невозможно. Большие
стехиометрические коэффициенты в
уравнении реакции (сумма коэффициентов
более 3) указывают на сложный механизм
реакции.
6.
Скорость химической реакции• Эта величина определяет, как изменяется концентрация компонентов
реакции с течением времени. Скорость химической реакции — величина
всегда положительная.
В 1865 г Н. Н. Бекетовым и в 1867 г К. М. Гульдбергом и П. Вааге был
сформулирован закон действующих масс, согласно которому скорость
химической реакции в каждый момент времени пропорциональна
концентрациям реагентов, возведённым в некоторые степени.
7.
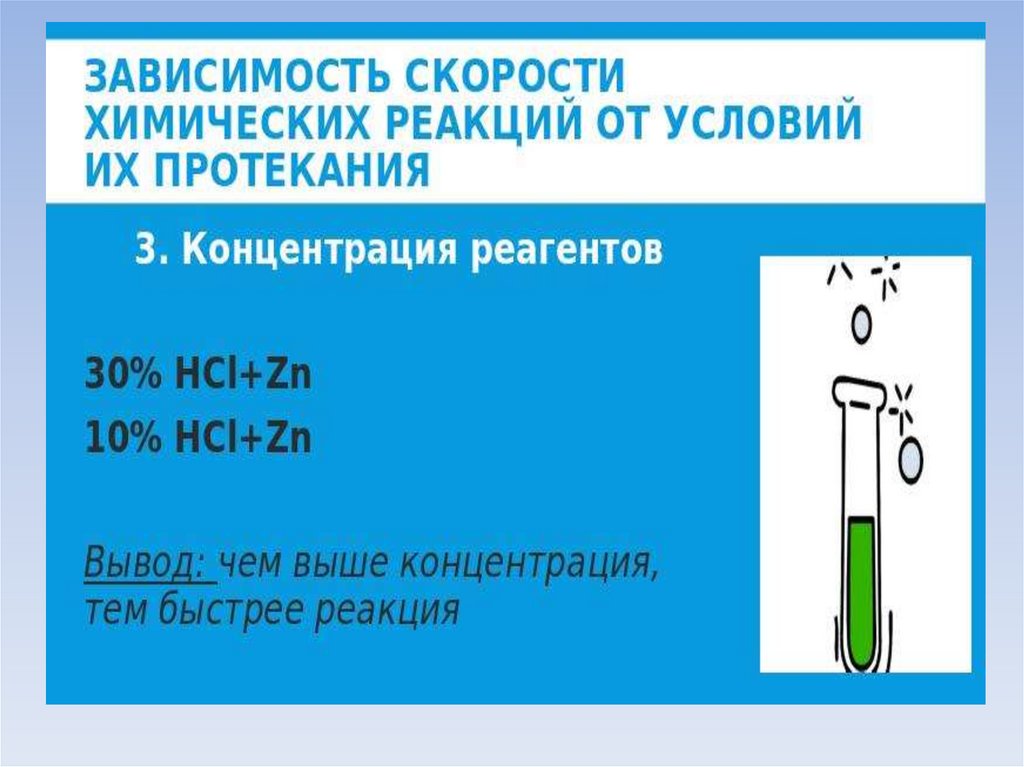
Зависимость скорости химическихреакций от условий их протекания
• Cu + HCl (разб) = Х
Медь является металлом,
поэтому не взаимодействует
с хлороводородной
разбавленной кислотой.
очевиден: невозможно по
формуле записать уравнение
2Cu + 4HCl (конц) → 2H[CuCl2] + H2.
В концентрированной соляной
кислоте медь растворяется.
Получаем водород с
дихлоркупратом водорода
1. Природа
реагирующих
веществ: чем
активнее
вещество, тем
быстрее реакция
8.
• Правило Вант-Гоффа:С повышением температуры на каждые
10° С скорость реакции возрастает в 2-4
раза











 Химия
Химия








