Похожие презентации:
Нуклеиновые кислоты. (Часть 2)
1.
2.
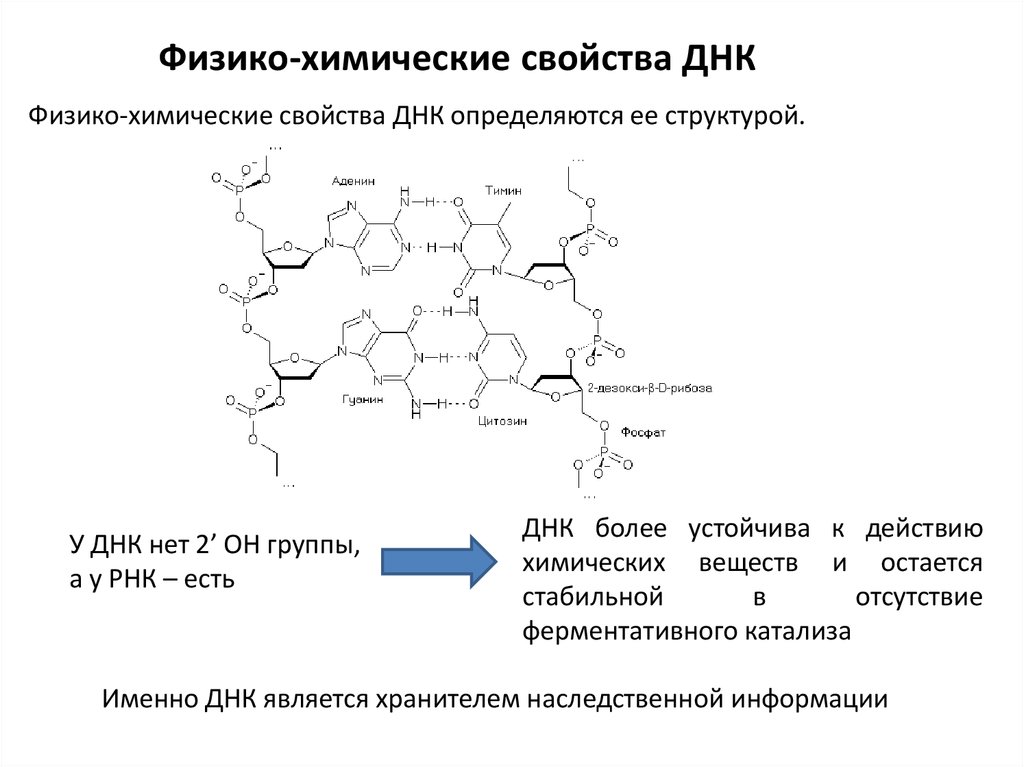
Физико-химические свойства ДНКФизико-химические свойства ДНК определяются ее структурой.
У ДНК нет 2’ ОН группы,
а у РНК – есть
ДНК более устойчива к действию
химических веществ и остается
стабильной
в
отсутствие
ферментативного катализа
Именно ДНК является хранителем наследственной информации
3.
Оптические свойства ДНК определяются:1. Пуриновыми и пиримидиновыми основаниями
2. Стэккинг-взаимодействиями между азотистыми основаниями
Пурины и пиримидины поглощают в УФ области спектра с максимумом
при 260 нм
Мах поглощения ДНК при λ = 260 нм
1 единица оптического поглощения соответствует
концентрации 50 мкг/мл ДНК
(Оптич.погл.
при
260нм / Оптич.погл.
при 280 нм)
>= 1,7
Проба ДНК достаточно
чиста от примесей
белка
4.
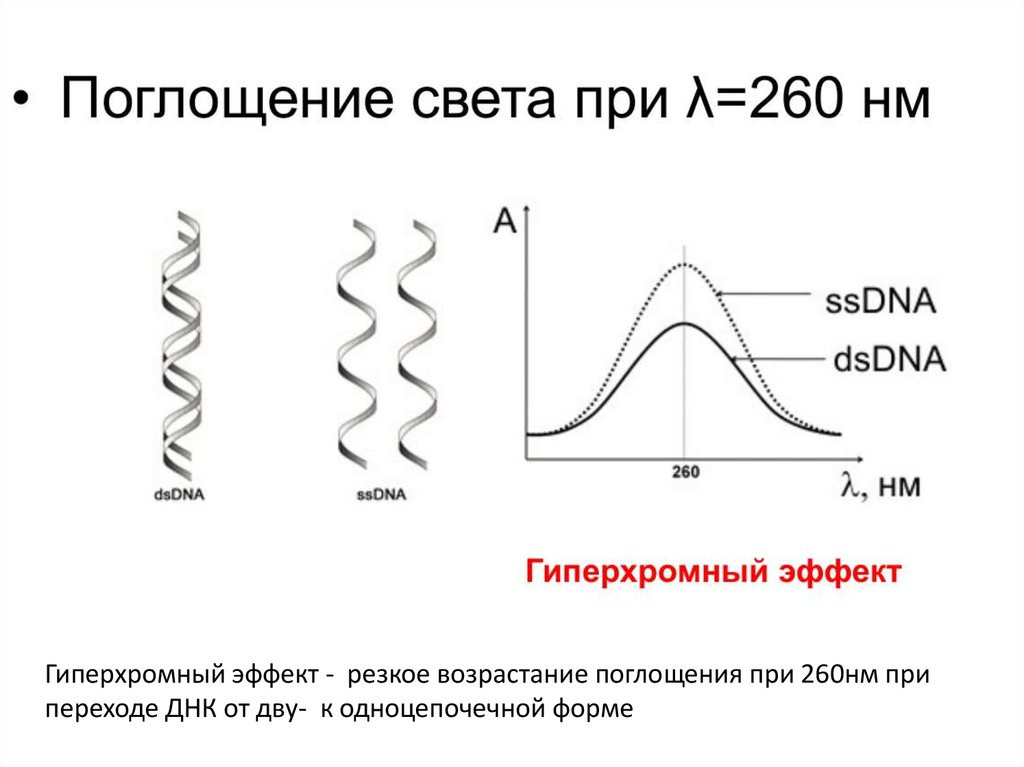
Гиперхромный эффект - резкое возрастание поглощения при 260нм припереходе ДНК от дву- к одноцепочечной форме
5.
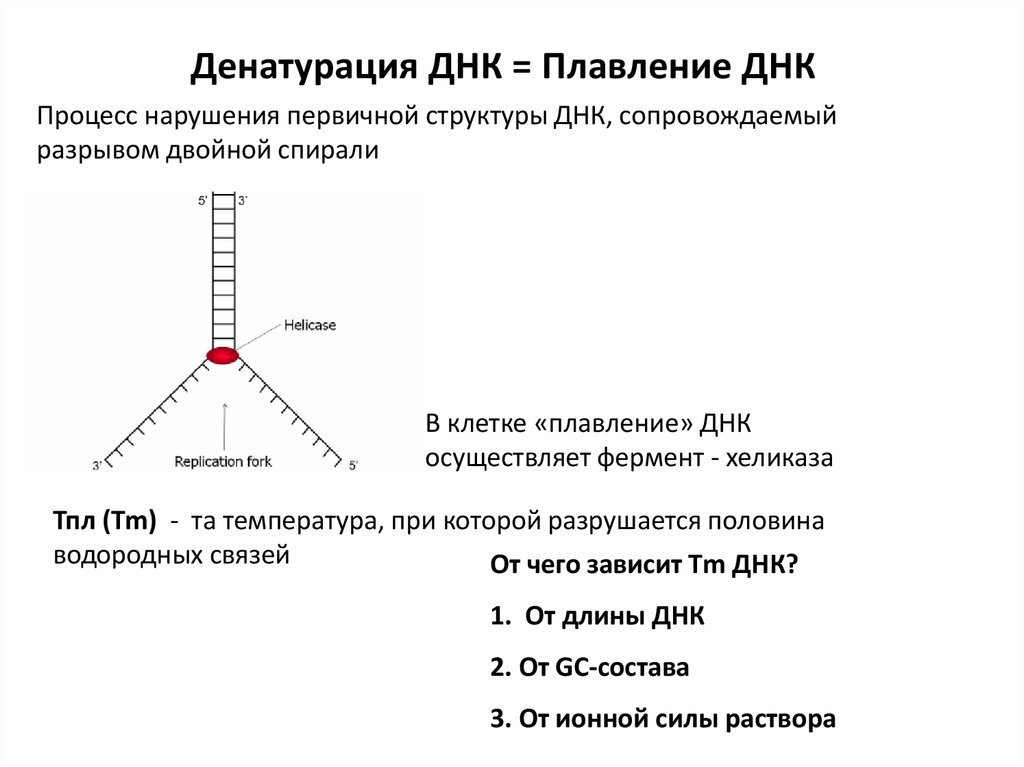
Денатурация ДНК = Плавление ДНКПроцесс нарушения первичной структуры ДНК, сопровождаемый
разрывом двойной спирали
В клетке «плавление» ДНК
осуществляет фермент - хеликаза
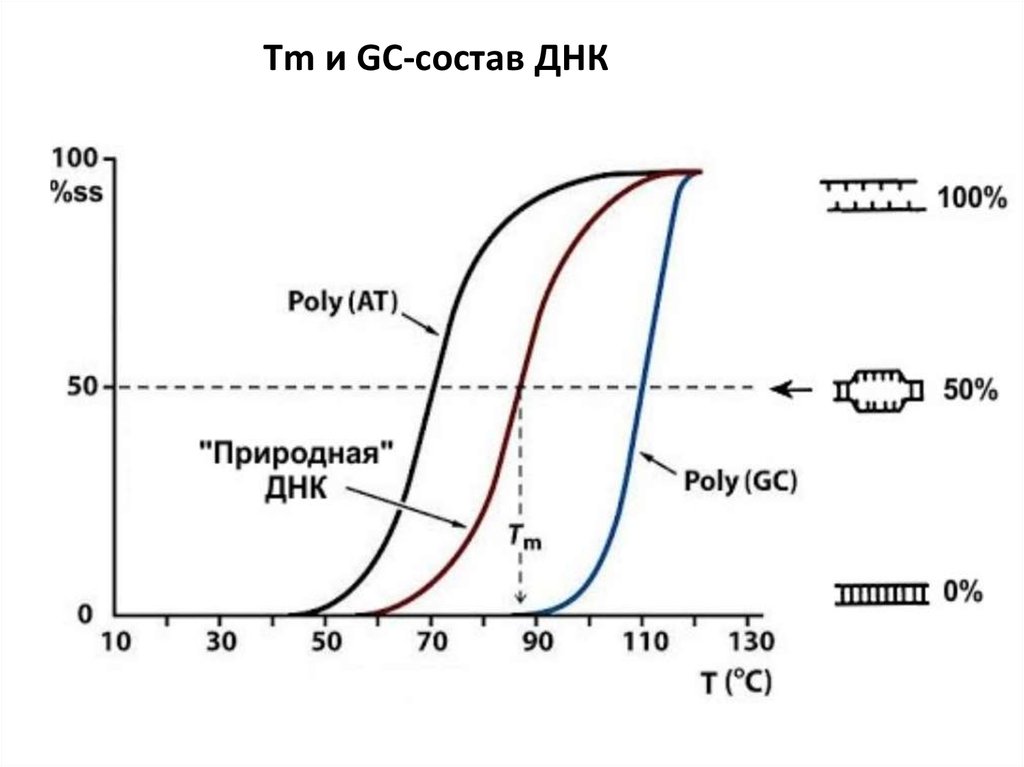
Тпл (Тm) - та температура, при которой разрушается половина
водородных связей
От чего зависит Тm ДНК?
1. От длины ДНК
2. От GC-состава
3. От ионной силы раствора
6.
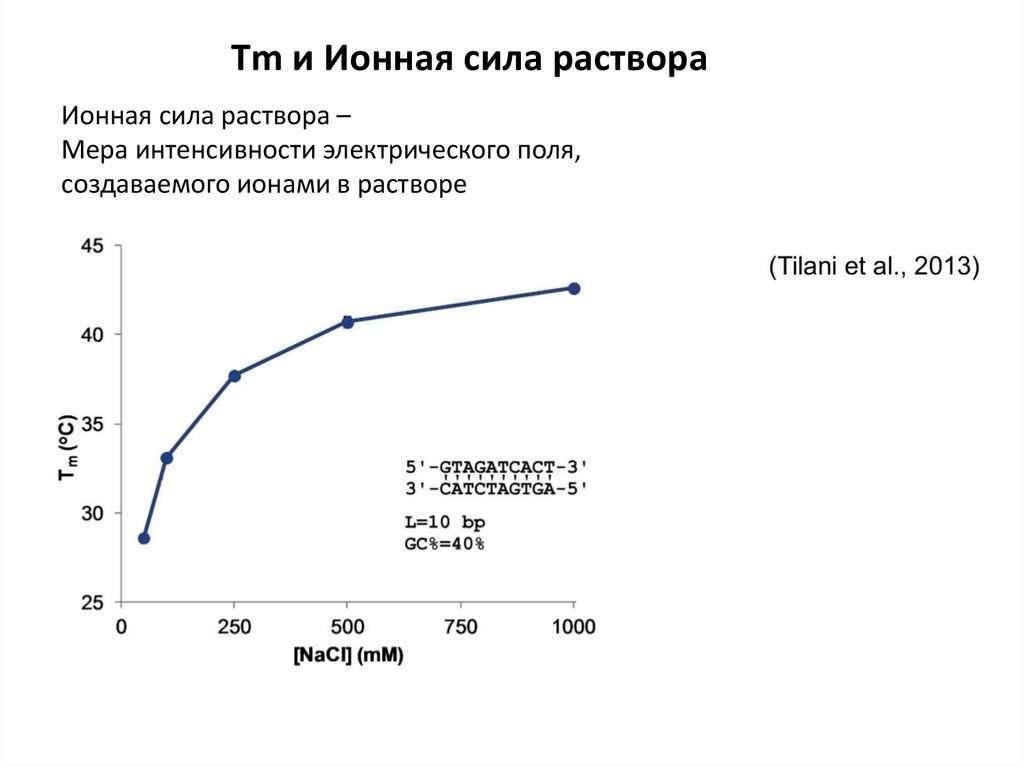
Тm и Ионная сила раствораИонная сила раствора –
Мера интенсивности электрического поля,
создаваемого ионами в растворе
7.
Тm и GC-состав ДНК8.
Формула для расчета Тm9.
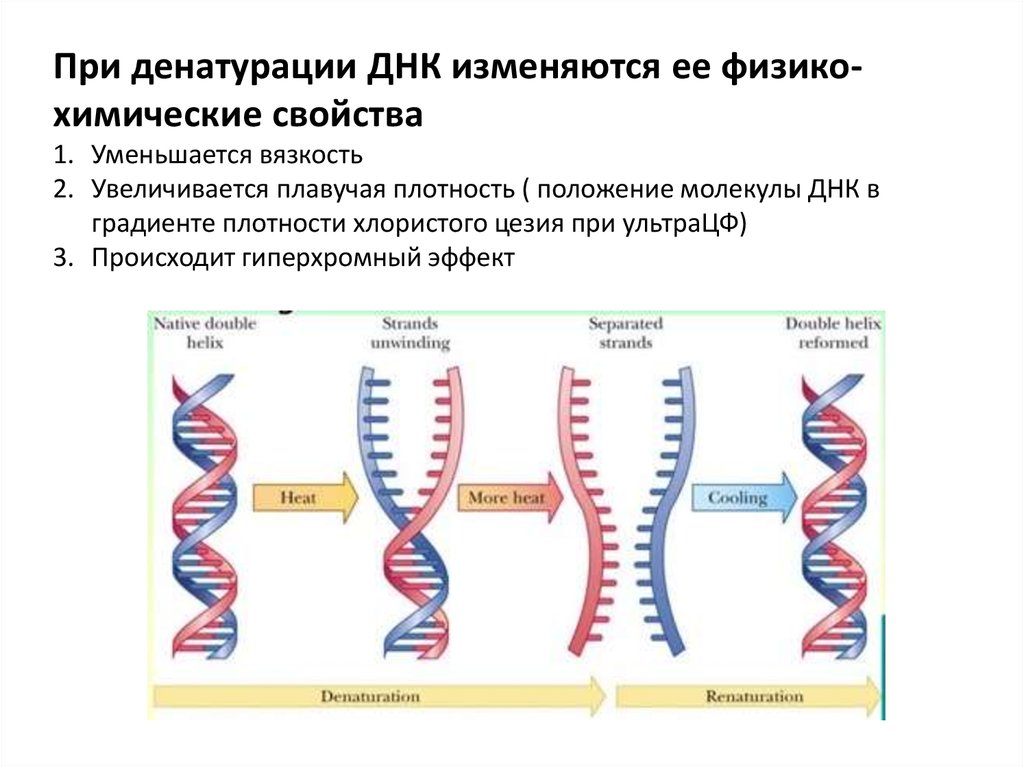
При денатурации ДНК изменяются ее физикохимические свойства1. Уменьшается вязкость
2. Увеличивается плавучая плотность ( положение молекулы ДНК в
градиенте плотности хлористого цезия при ультраЦФ)
3. Происходит гиперхромный эффект
10.
Электрофорез ДНКВ нейтральной и щелочной средах молекулы нуклеиновых кислот
заряжены отрицательно.
Отношение заряда к массе одинаково для всех нуклеиновых кислот
Разделение за счет размеров и формы!
11.
12.
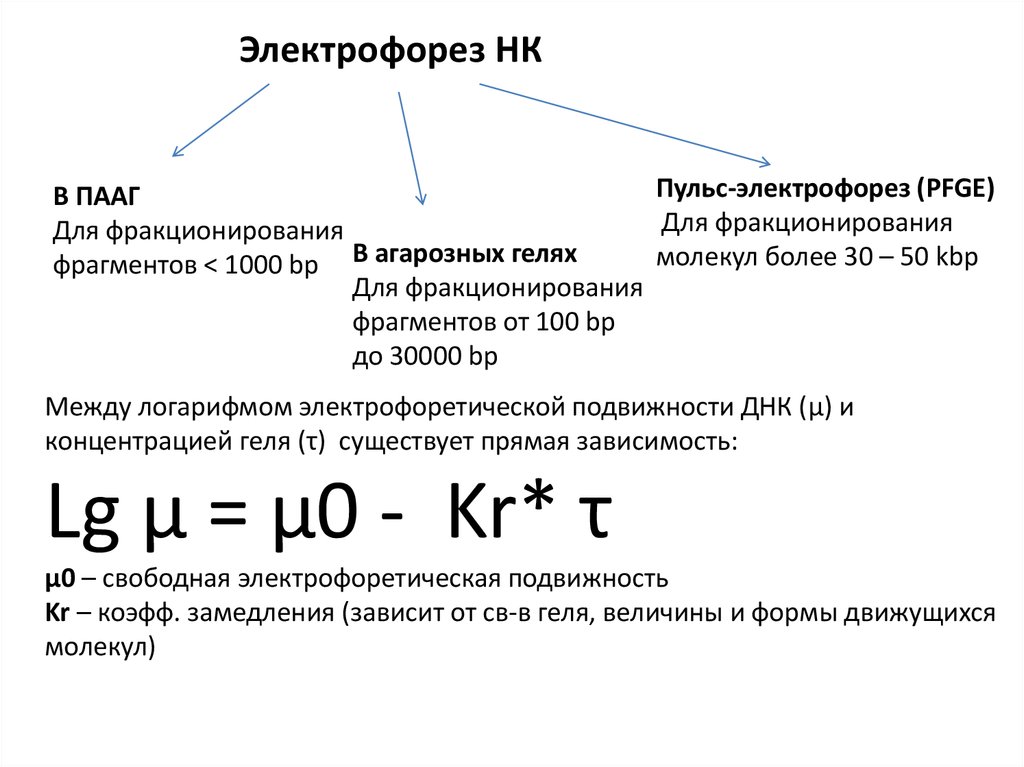
Электрофорез НКПульс-электрофорез (PFGE)
В ПААГ
Для фракционирования
Для фракционирования
молекул более 30 – 50 kbp
фрагментов < 1000 bp В агарозных гелях
Для фракционирования
фрагментов от 100 bp
до 30000 bp
Между логарифмом электрофоретической подвижности ДНК (μ) и
концентрацией геля (τ) существует прямая зависимость:
Lg μ = μ0 - Kr* τ
μ0 – cвободная электрофоретическая подвижность
Kr – коэфф. замедления (зависит от св-в геля, величины и формы движущихся
молекул)
13.
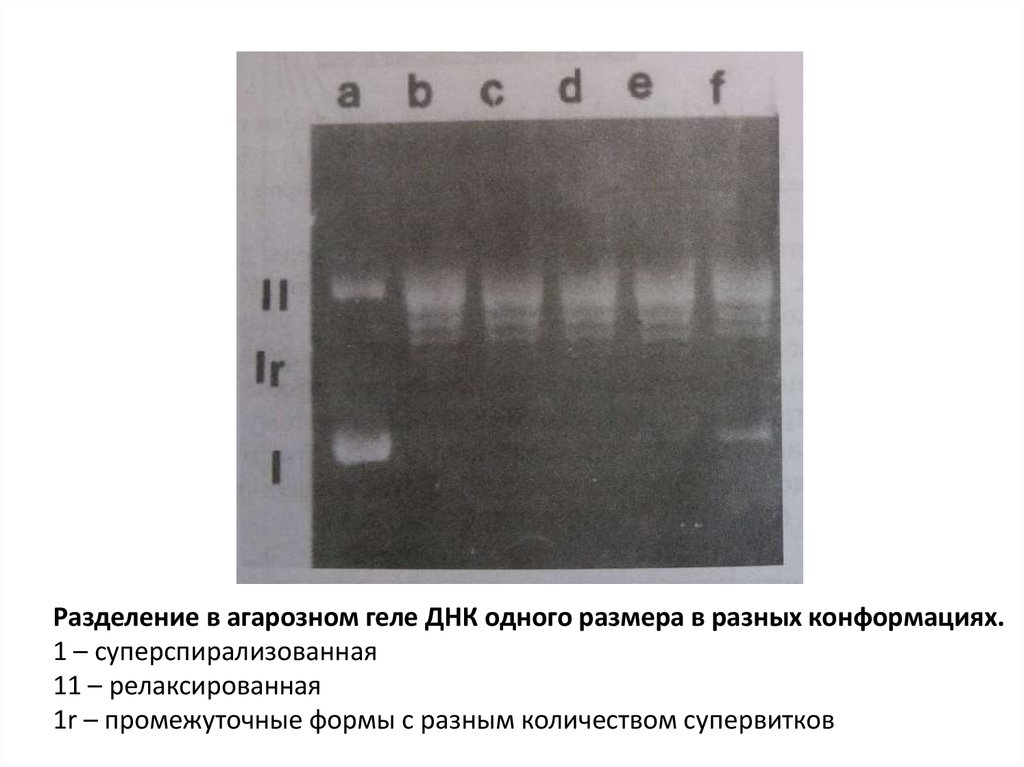
Разделение в агарозном геле ДНК одного размера в разных конформациях.1 – суперспирализованная
11 – релаксированная
1r – промежуточные формы с разным количеством супервитков
14.
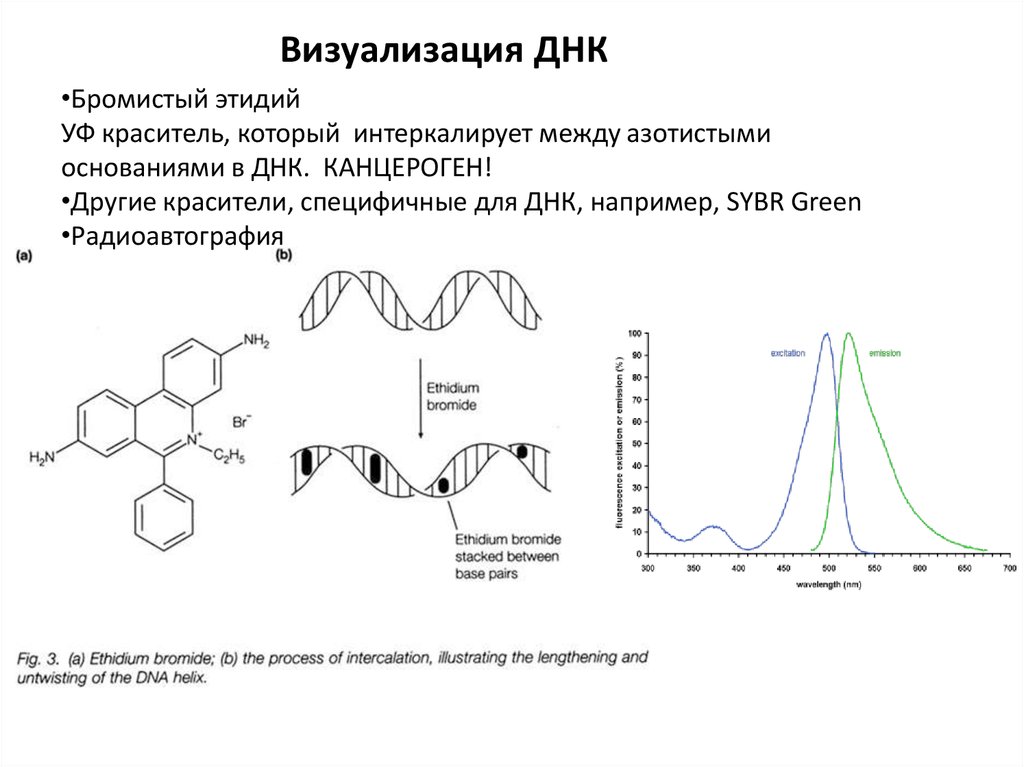
Визуализация ДНК•Бромистый этидий
УФ краситель, который интеркалирует между азотистыми
основаниями в ДНК. КАНЦЕРОГЕН!
•Другие красители, специфичные для ДНК, например, SYBR Green
•Радиоавтография
15.
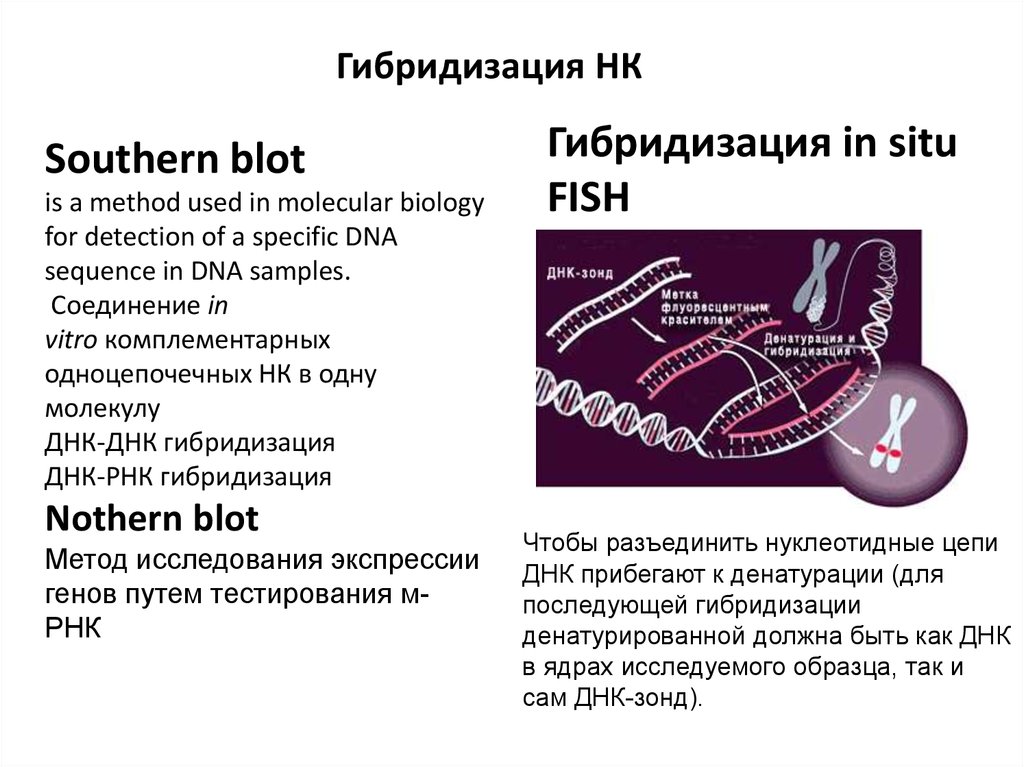
Гибридизация НКSouthern blot
is a method used in molecular biology
for detection of a specific DNA
sequence in DNA samples.
Соединение in
vitro комплементарных
одноцепочечных НК в одну
молекулу
ДНК-ДНК гибридизация
ДНК-РНК гибридизация
Nothern blot
Метод исследования экспрессии
генов путем тестирования мРНК
Гибридизация in situ
FISH
Чтобы разъединить нуклеотидные цепи
ДНК прибегают к денатурации (для
последующей гибридизации
денатурированной должна быть как ДНК
в ядрах исследуемого образца, так и
сам ДНК-зонд).
16.
Современные подходы к секвенированию ДНКТехника определения нуклеотидной последовательности ДНК и РНК для
получения формального описания её первичной структуры. Технология
методов секвенирования нового поколения (СНП) позволяет «прочитать»
единовременно сразу несколько участков генома, что является главным
отличием от более ранних методов секвенирования. СНП осуществляется с
помощью
повторяющихся
индуцированного
циклов
удлинения
полимеразой,
цепи,
или
многократного лигирования олигонуклеотидов. В ходе СНП могут
генерироваться
до
сотен
мегабаз
последовательностей за один рабочий цикл.
и
гигабаз
нуклеотидных
17.
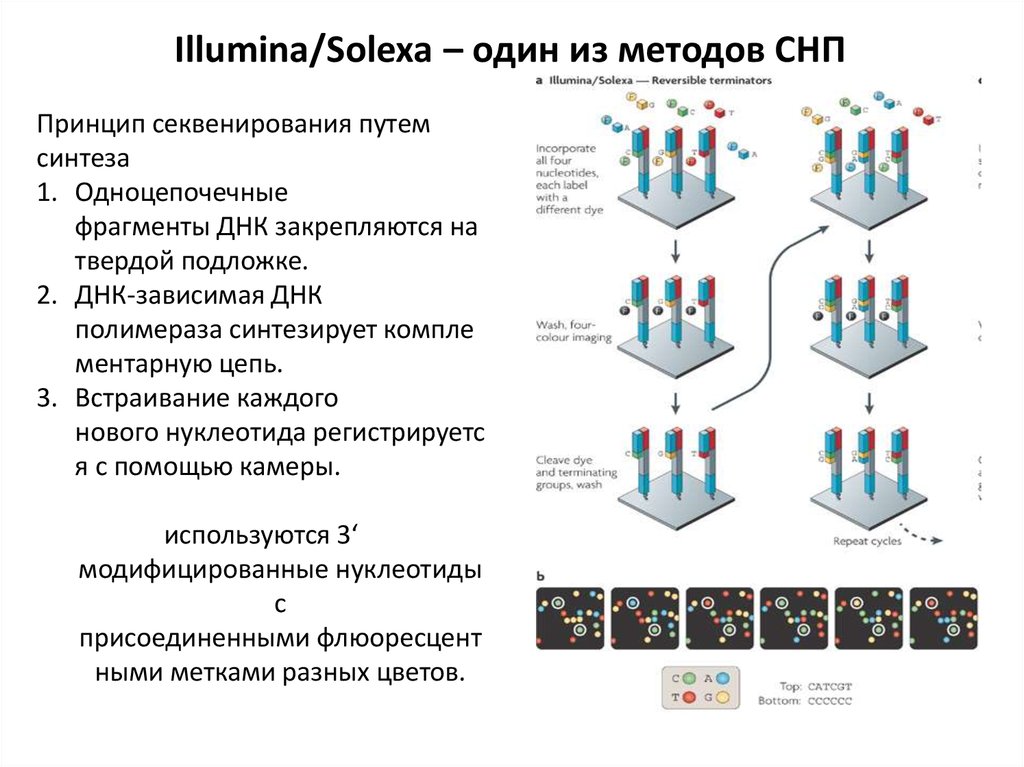
Illumina/Solexa – один из методов СНППринцип секвенирования путем
синтеза
1. Одноцепочечные
фрагменты ДНК закрепляются на
твердой подложке.
2. ДНК-зависимая ДНК
полимераза синтезирует компле
ментарную цепь.
3. Встраивание каждого
нового нуклеотида регистрируетс
я с помощью камеры.
используются 3‘
модифицированные нуклеотиды
с
присоединенными флюоресцент
ными метками разных цветов.
18.
•Первый секвенатор Genome Analyzer 1G был представленкомпанией Solexa в 2006 году. Длина прочтения составляла 30-35
нуклеотида, можно было получить около 1 Gb информации.
•HiSeq 2000 (2011 год) способен секвенировать 6 человеческих
геномов за 11 дней. Длина прочтения составляет 100 нуклеотидов,
можно получить 600 Gb информации
НАИБОЛЕЕ ПРОИЗВОДИТЕЛЬНЫЙ МЕТОД
19.
РНК-секвенирование.Изучение транскриптома.Современное полногеномное РНК-секвенирование (RNA-seq) основано на
прямом секвенировании фрагментов с-DNA
Анализ
экспрессии
генов
20.
Что мы делали на прошлом занятиии как оно связано с этим?
1. Выделили плазмидную ДНК
2. Определили ее концентрацию
3. Провели рестрикционный анализ выделенной ДНК с помощью рестриктаз
EcoR1 и Pstl
4. Сегодня будем проводить ЭФ для оценки рестрикции. Фрагменты какой длины
мы с вами должны будем увидеть?
5. + понаблюдаем за способностью ДНК к гиперхромному эффекту.









 Биология
Биология








