Похожие презентации:
Основные классы неорганических соединений
1. Основные классы неорганических соединений
2.
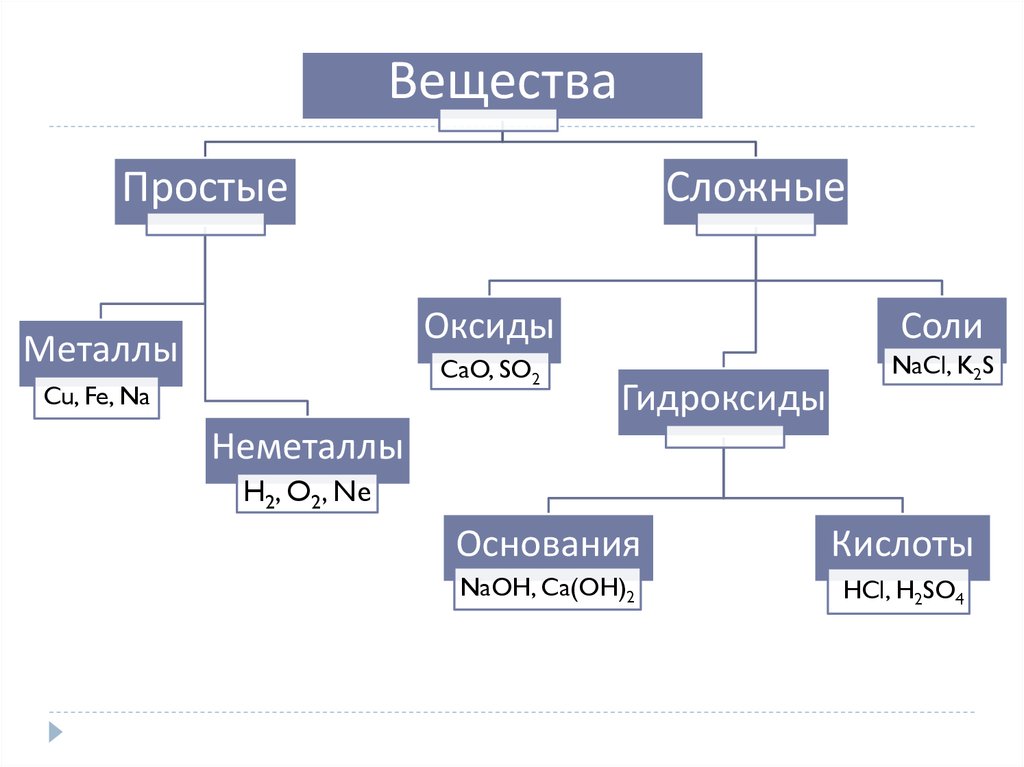
ВеществаПростые
Металлы
Cu, Fe, Na
Сложные
Оксиды
Соли
CaO, SO2
NaCl, K2S
Гидроксиды
Неметаллы
H2, O2, Ne
Основания
Кислоты
NaOH, Ca(OH)2
HCl, H2SO4
3. Простые вещества
МеталлыІ группа главная подгруппа – щелочные металлы
ІІ группа главная подгруппа – щелочноземельные металлы
Ag, Au, Ru, Rh, Pd, Os, Ir, Pt (иногда Re) – благородные
металлы
Неметаллы
V группа главная подгруппа – пниктогены
VІ группа главная подгруппа – халькогены
VІІ группа главная подгруппа – галогены
VІІІ группа главная подгруппа – благородные (инертные) газы
4. Металлы. Неметаллы
5. Физические свойства простых веществ
МеталлыНеметаллы
Твердые вещества (кроме ртути Hg) Твердые (B, C, Si, P4, As, S, Se, Te, I2, At);
жидкие (Br2);
газообразные вещества (H2, N2, O2, O3,
F2, Cl2, благородные газы)
Металлический блеск
Не имеют металлического блеска
(кроме: графит C, Te, I2)
Электро- и теплопроводны
Большинство не проводят
электрический ток
(кроме: графит C, Si)
Ковкие, пластичные, тягучие
В твердом состоянии - хрупкие
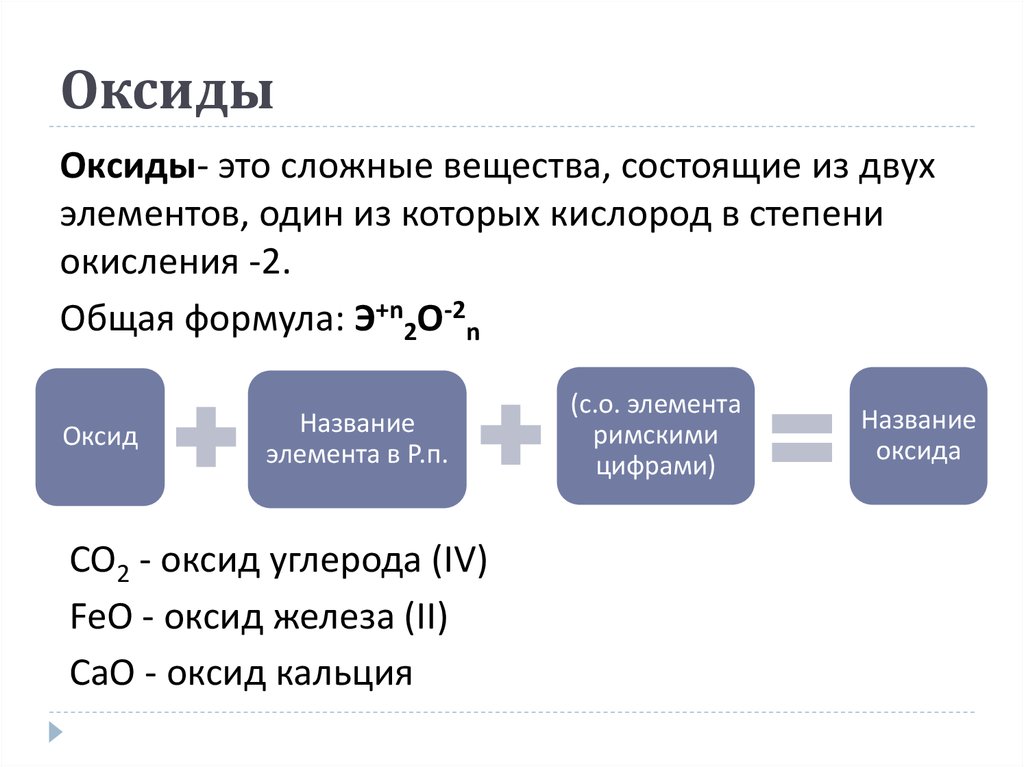
6. Оксиды
Оксиды- это сложные вещества, состоящие из двухэлементов, один из которых кислород в степени
окисления -2.
Общая формула: Э+n2O-2n
Оксид
Название
элемента в Р.п.
CO2 - оксид углерода (ІV)
FeO - оксид железа (ІІ)
CaO - оксид кальция
(с.о. элемента
римскими
цифрами)
Название
оксида
7. Оксиды
1) Несолеобразующие - CO, SiO, N2O, NO, NO22) Солеобразующие
Основные – металлы со с.о. +1, +2
При взаимодействии с водой образуют основания
Na2O, K2O, CaO
Амфотерные – металлы со с.о. +3, +4; исключения: BeO,
ZnO, CuO, GeO, SnO, PbO
При взаимодействии с водой образуют основания и кислоты
Al2O3, Fe2O3, GeO2
Кислотные – неметаллы; металлы со с.о. +5, +6, +7
При взаимодействии с водой образуют кислоты
Cl2O, CO2, Mn2O7
3) Двойные – Fe3O4 (FeO·Fe2O3), Pb3O4 (PbO·Pb2O3)
8. Гидриды
Гидриды - соединения водорода с металлами илименее электроотрицательными, чем водород,
неметаллами.
LiH, CaH2, AlH3
Иногда к гидридам относят соединения всех химических
элементов с водородом.
CH4, NH3, H2O, HCl
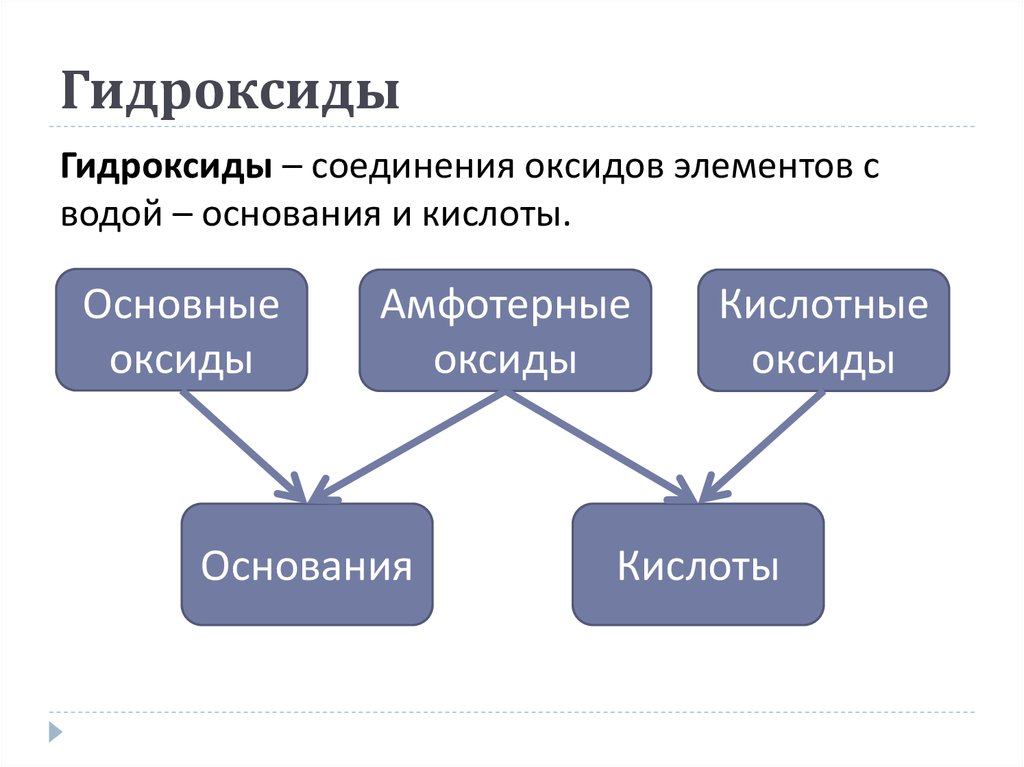
9. Гидроксиды
Гидроксиды – соединения оксидов элементов сводой – основания и кислоты.
Основные
оксиды
Амфотерные
оксиды
Основания
Кислотные
оксиды
Кислоты
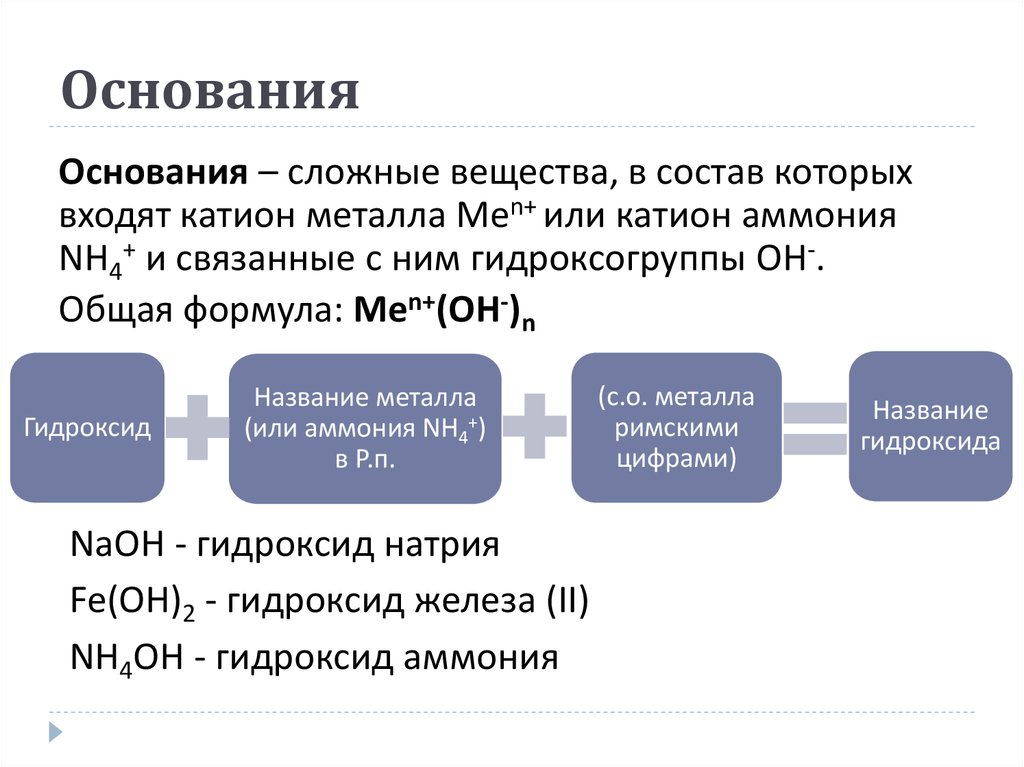
10. Основания
Основания – сложные вещества, в состав которыхвходят катион металла Men+ или катион аммония
NH4+ и связанные с ним гидроксогруппы OH-.
Общая формула: Men+(OH-)n
Гидроксид
Название металла
(или аммония NH4+)
в Р.п.
NaOH - гидроксид натрия
Fe(OH)2 - гидроксид железа (ІІ)
NH4OH - гидроксид аммония
(с.о. металла
римскими
цифрами)
Название
гидроксида
11. Основания
По числу гидроксогрупп OH:Однокислотные – NaOH, KOH
Двухкислотные – Ca(OH)2, Ba(OH)2
Многокислотные – Al(OH)3, Sn(OH)4
По растворимости в воде:
Растворимые (щелочи) – гидроксиды щелочных
(едкие щелочи) и щелочноземельных металлов –
LiOH, Ba(OH)2
Нерастворимые – Cu(OH)2, Cr(OH)3
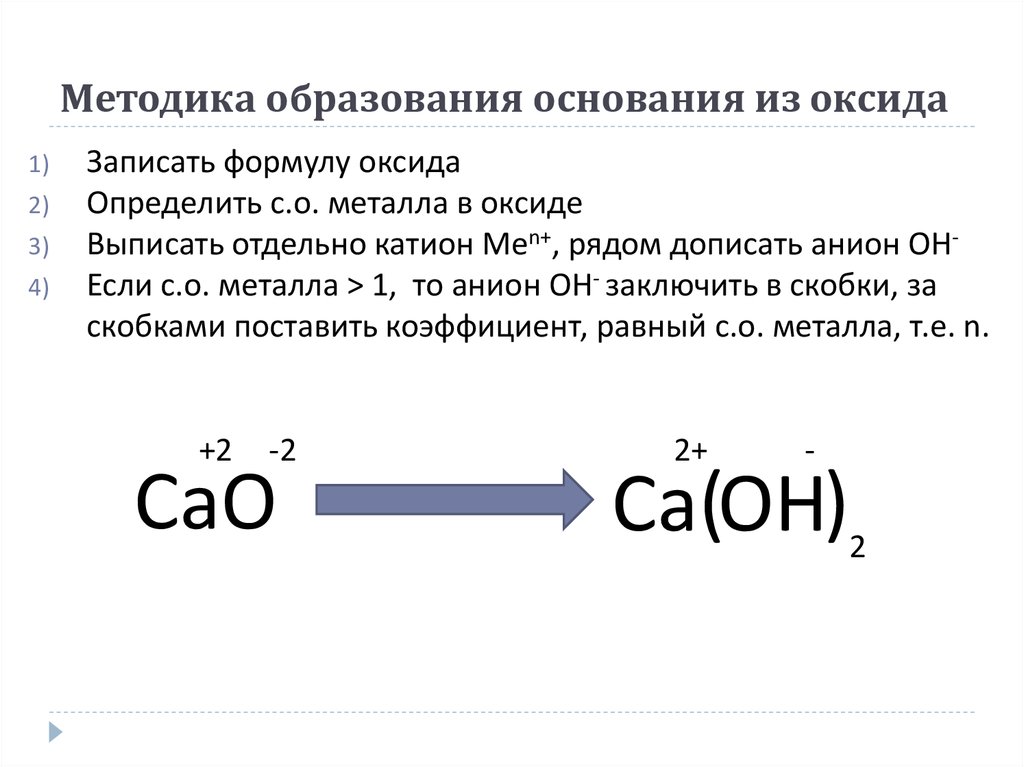
12. Методика образования основания из оксида
1)2)
3)
4)
Записать формулу оксида
Определить с.о. металла в оксиде
Выписать отдельно катион Men+, рядом дописать анион ОНЕсли с.о. металла > 1, то анион ОН- заключить в скобки, за
скобками поставить коэффициент, равный с.о. металла, т.е. n.
+2
-2
CaO
2+
-
Ca(OH)
2
13. Кислоты
Кислоты – сложные вещества, молекулы которыхсостоят из атомов водорода Н+ и кислотных остатков Аm-.
Общая формула: Н+mАm-
14. Кислоты
По основности:Одноосновные – HF, HCl
Двухосновные – H2S, H2SO4
Многоосновные – H3PO4, H3AsO4
По составу:
Бескислородные – HCl, HCN
Кислородсодержащие – HNO3, HClO
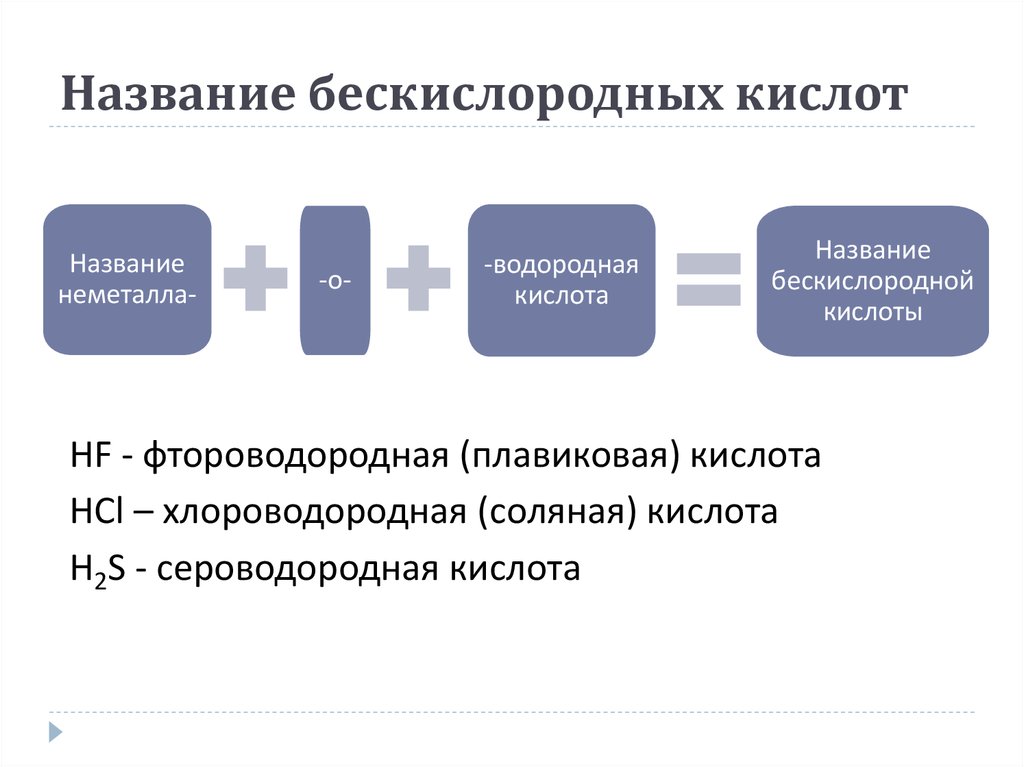
15. Название бескислородных кислот
Названиенеметалла-
-о-
-водородная
кислота
Название
бескислородной
кислоты
HF - фтороводородная (плавиковая) кислота
HCl – хлороводородная (соляная) кислота
H2S - сероводородная кислота
16. Название кислородсодержащих кислот
Русскийкорень
названия
элемента-
-ная/-вая – для
высшей с.о.
-истая – для средней
с.о.
HNO3 - азотная кислота
HNO2 - азотистая кислота
H2SO4 - серная кислота
H2SO3 - сернистая кислота
кислота
Название
кислородсодержащей
кислоты
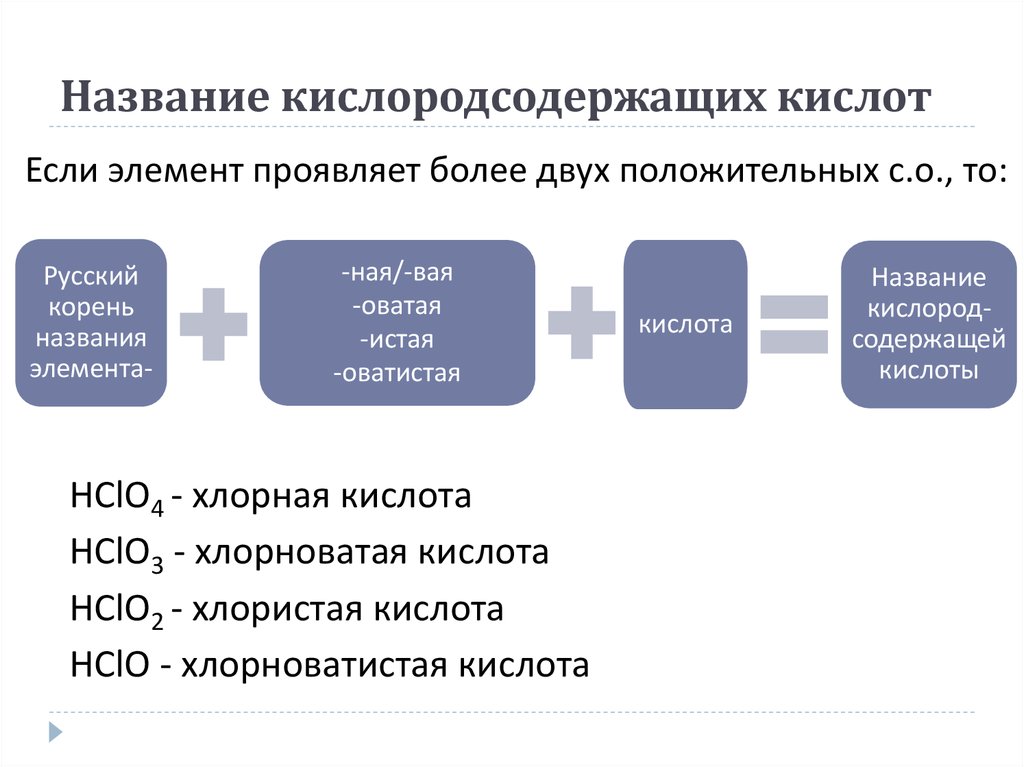
17. Название кислородсодержащих кислот
Если элемент проявляет более двух положительных с.о., то:Русский
корень
названия
элемента-
-ная/-вая
-оватая
-истая
-оватистая
HClO4 - хлорная кислота
HClO3 - хлорноватая кислота
HClO2 - хлористая кислота
HClO - хлорноватистая кислота
кислота
Название
кислородсодержащей
кислоты
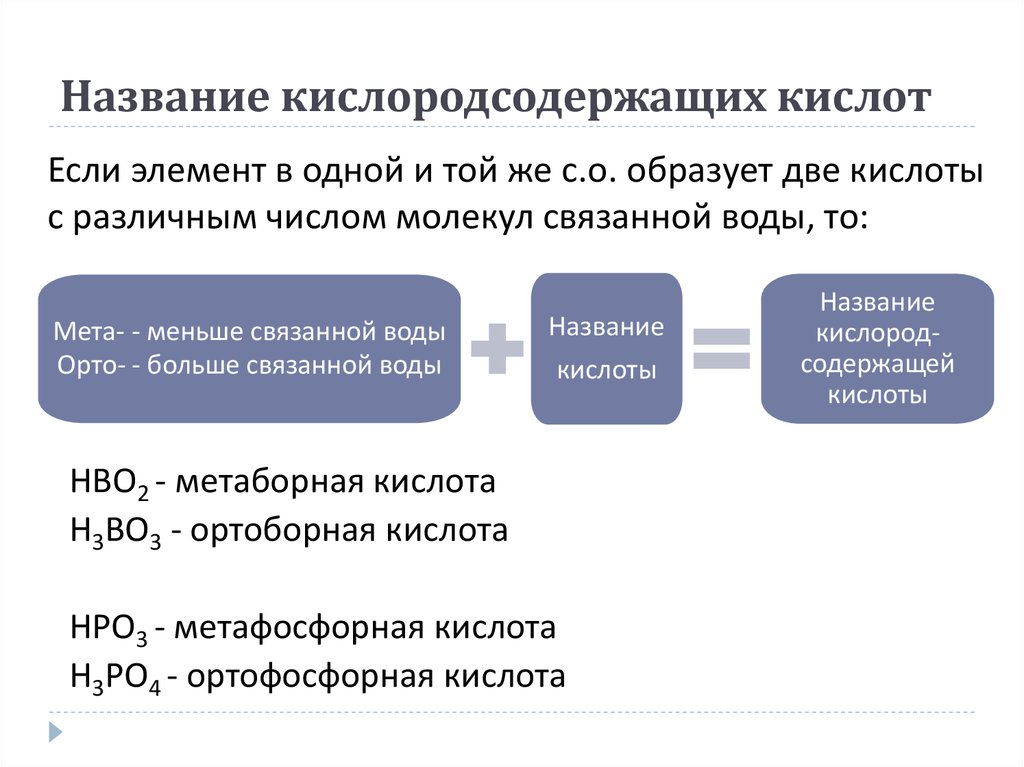
18. Название кислородсодержащих кислот
Если элемент в одной и той же с.о. образует две кислотыс различным числом молекул связанной воды, то:
Мета- - меньше связанной воды
Орто- - больше связанной воды
Название
кислоты
HBO2 - метаборная кислота
H3BO3 - ортоборная кислота
HPO3 - метафосфорная кислота
H3PO4 - ортофосфорная кислота
Название
кислородсодержащей
кислоты
19. Методика образования кислоты из оксида
Записать формулу оксидаК оксиду алгебраически прибавить одну молекулу воды
Сократить коэффициенты, если это возможно
Если нужно образовать ортокислоту, то к метакислоте надо
добавить еще одну молекулу воды
1)
2)
3)
4)
+5
+
-2
P2O5
H2 O
H2P2O6 = HPO3
HPO
3
+
H2 O
H3PO4
20. Названия кислотных остатков
Латинскийкорень названия
элемента-
-ат – для высшей с.о.
-ит – для средней с.о.
-ид – для низшей с.о.
Название
кислотного
остатка
NO3- - нитрат
NO2- - нитрит
Если элемент проявляет более двух положительных с.о., то:
Пер- - для высшей с.о.
Гипо- - для низких с.о.
ClO4- - перхлорат
ClO3- - хлорат
ClO2- - хлорит
ClO- - гипохлорит
Cl- - хлорид
Латинский
корень названия
элемента-
-ат
-ит
-ид
Название
кислотного
остатка
21. Соли
1) Как продукты замены протонов в кислотах илигидроксогрупп в основаниях:
Средние – KBr, CaSO4
Основные – (CuOH)2CO3, ZnOHCl
Кислые – K2HPO4, KH2PO4
2) По числу присутствующих в структуре катионов и
анионов:
Простые – NaCl, AgI
Двойные – KAl(SO4)2, CaMg(CO3)2
Смешанные - Ca(ClO)Cl, MgClBr
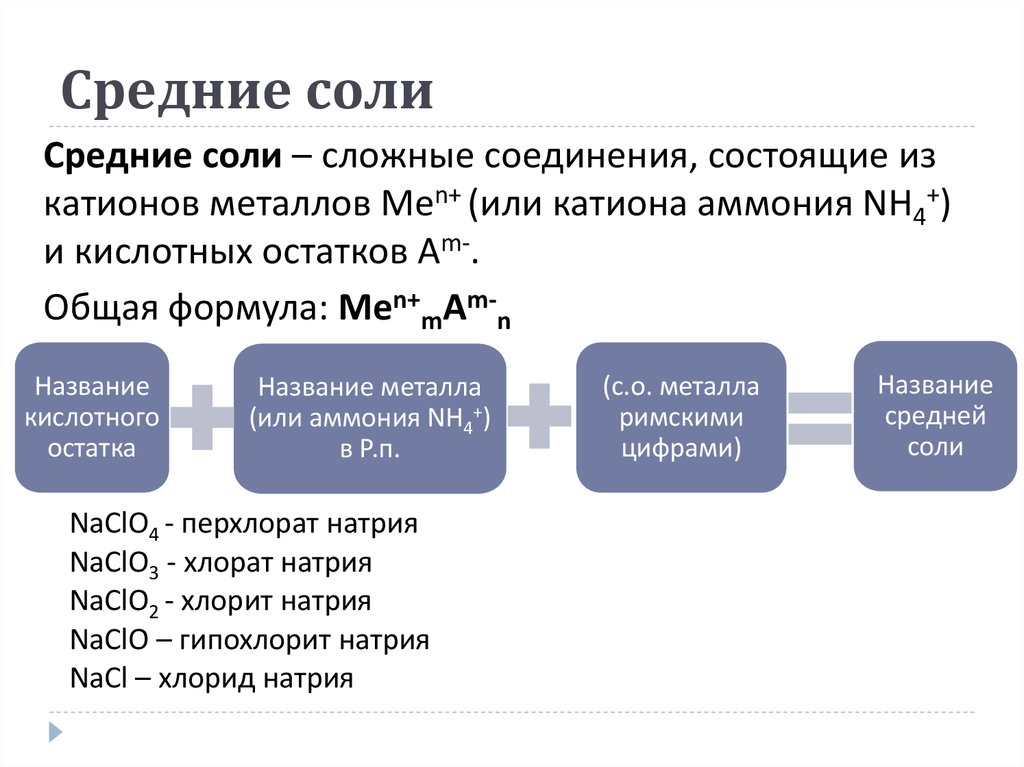
22. Средние соли
Средние соли – сложные соединения, состоящие изкатионов металлов Men+ (или катиона аммония NH4+)
и кислотных остатков Аm-.
Общая формула: Men+mАm-n
Название
кислотного
остатка
Название металла
(или аммония NH4+)
в Р.п.
NaClO4 - перхлорат натрия
NaClO3 - хлорат натрия
NaClO2 - хлорит натрия
NaClO – гипохлорит натрия
NaCl – хлорид натрия
(с.о. металла
римскими
цифрами)
Название
средней
соли
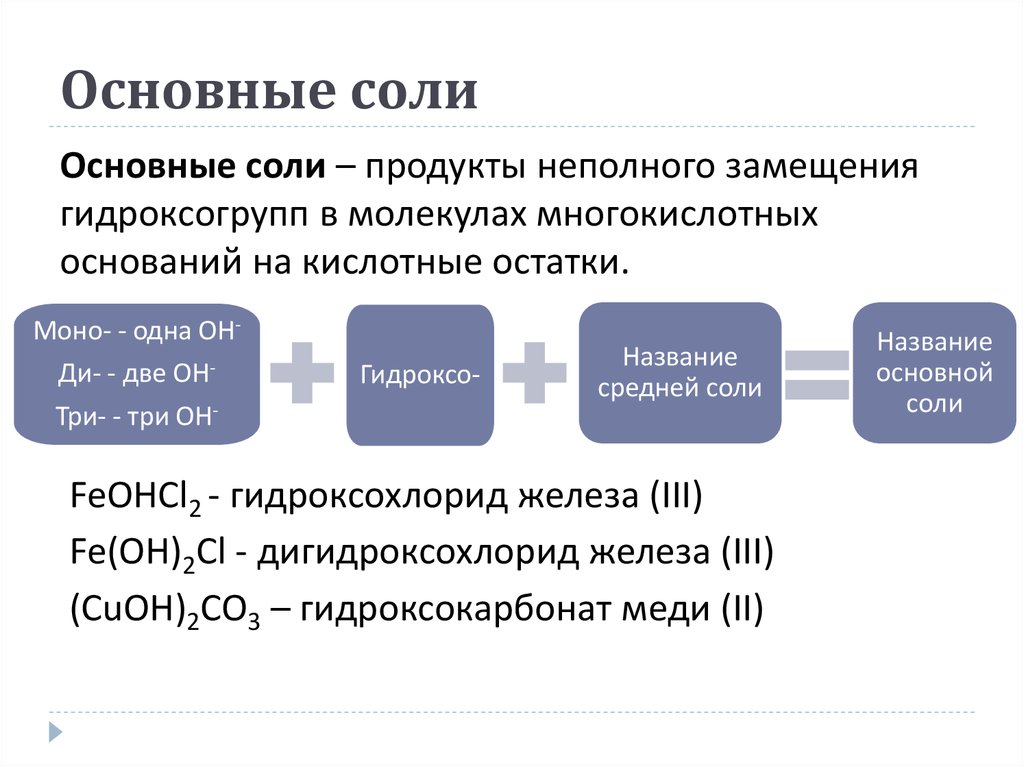
23. Основные соли
Основные соли – продукты неполного замещениягидроксогрупп в молекулах многокислотных
оснований на кислотные остатки.
Моно- - одна OHДи- - две OHТри- - три OH-
Гидроксо-
Название
средней соли
FeOHCl2 - гидроксохлорид железа (ІІІ)
Fe(OH)2Cl - дигидроксохлорид железа (ІІІ)
(CuOH)2CO3 – гидроксокарбонат меди (ІІ)
Название
основной
соли
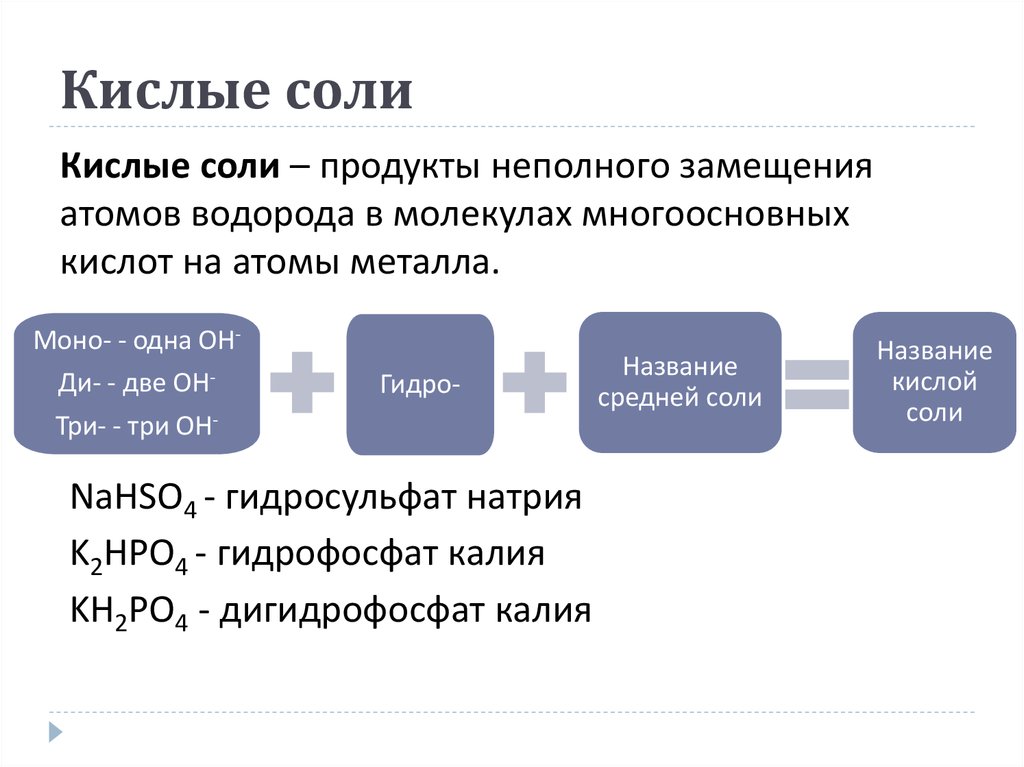
24. Кислые соли
Кислые соли – продукты неполного замещенияатомов водорода в молекулах многоосновных
кислот на атомы металла.
Моно- - одна OHДи- - две OHТри- - три OH-
Гидро-
NaHSO4 - гидросульфат натрия
K2HPO4 - гидрофосфат калия
KH2PO4 - дигидрофосфат калия
Название
средней соли
Название
кислой
соли
25. По числу присутствующих в структуре катионов и анионов
Простые соли – соли, состоящие из одного видакатионов и одного вида анионов.
K2SO4 – сульфат калия
Двойные соли – соли, содержащие два типа
катионов.
KAl(SO4)2 – сульфат алюминия-калия
Смешанные соли – соли, содержащие два типа
кислотных остатков.
Ca(OCl)Cl – гипохлорит-хлорид кальция
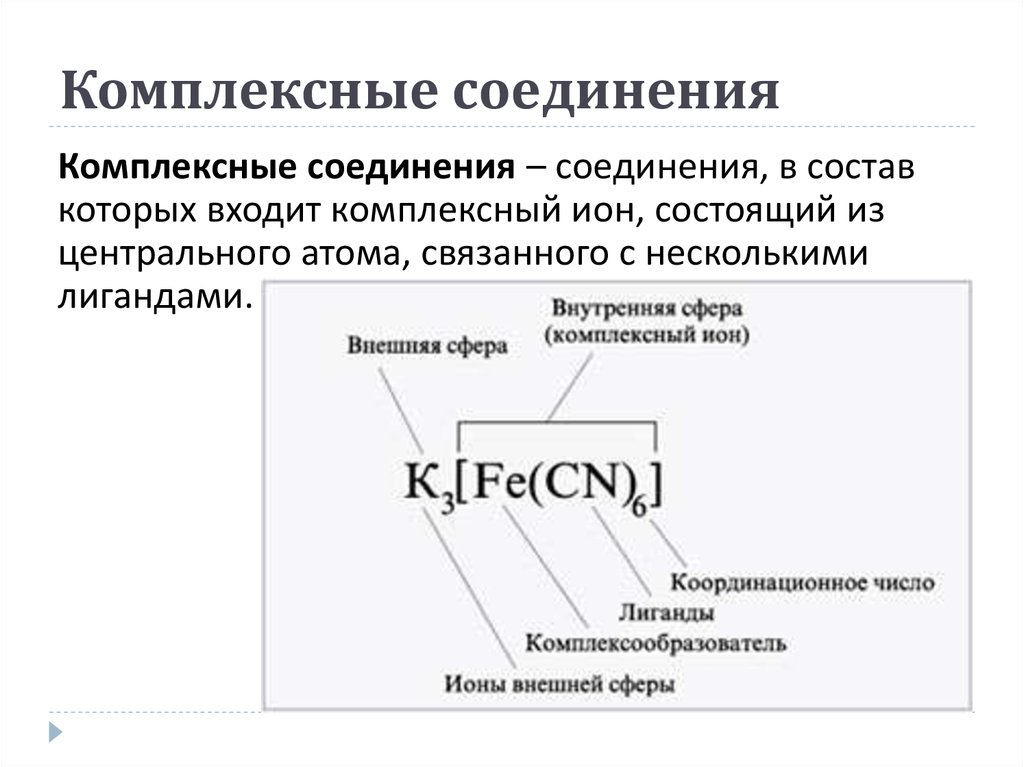
26. Комплексные соединения
Комплексные соединения – соединения, в составкоторых входит комплексный ион, состоящий из
центрального атома, связанного с несколькими
лигандами.
27.
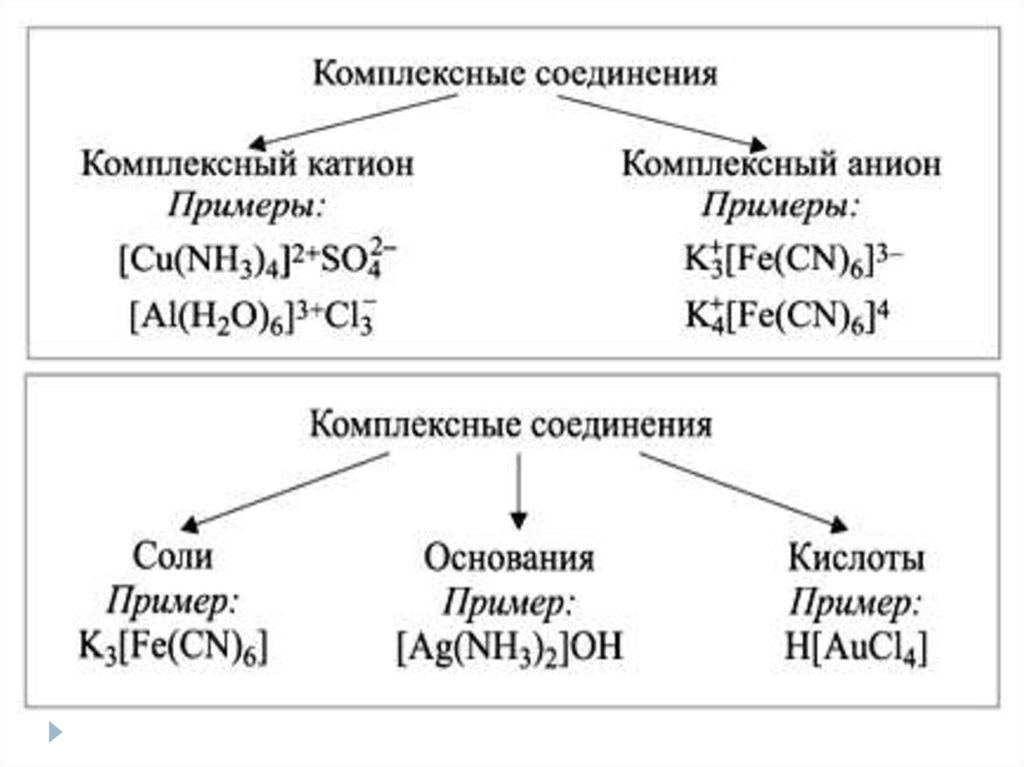
28. Номенклатура комплексных соединений
Если комплексный – анион:1) Число лигандов (греческие числительные)
2) Латинское название лиганда
3) Соединительная «о», если название
лиганда оканчивается на согласную букву
4) Латинское название комплексообразователя на –ат с указание с.о.
5) Название катиона внешней сферы в Р.п.
1 моно 6
гекса
2 ди
7
гепта
3 три
8
окта
4 тетра 9
нано
5 пента 10 дека
H2O
аква
NH3
аммин
CO
карбонил
OH-
гидроксо
K3[Fe(CN)6] – гексацианоферрат (ІІІ) калия
Na[Al(OH)4(H2O)2] - диакватетрагидроксоалюминат натрия
29. Номенклатура комплексных соединений
Если комплексный – катион:1) Число анионов внешней сферы
2) Латинское название анионов
3) Число лигандов (греческие числительные)
4) Название лигандов
5) Русское название комплексообразователя в Р.п. с указанием с.о.
6) Если внутренняя сфера комплекса нейтральна, то название
комплексообразователя в И.п.
[Zn(NH3)4]Cl2 – (ди)хлорид тетрааммин цинка
[Cr(NH3)3(H2O)3]Cl3 - (три)хлорид триакватриаммин хрома (ІІІ)
[Cr(H2O)3Cl3]·6H2O – гексагидрат трихлоротриаквахром (ІІІ)
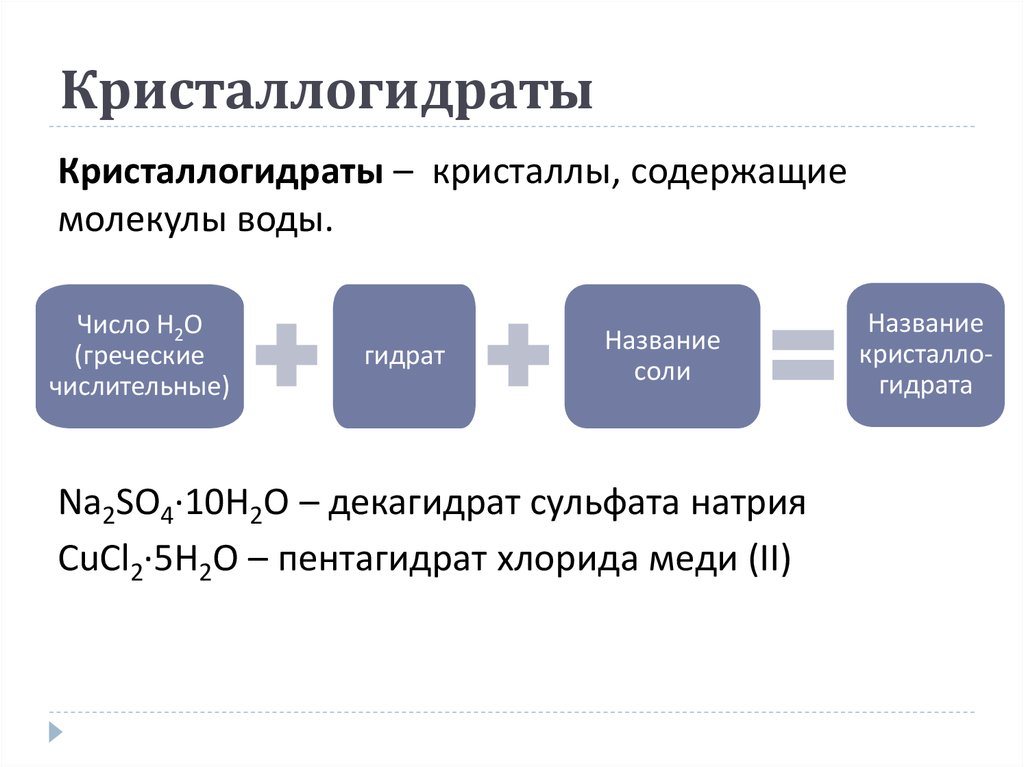
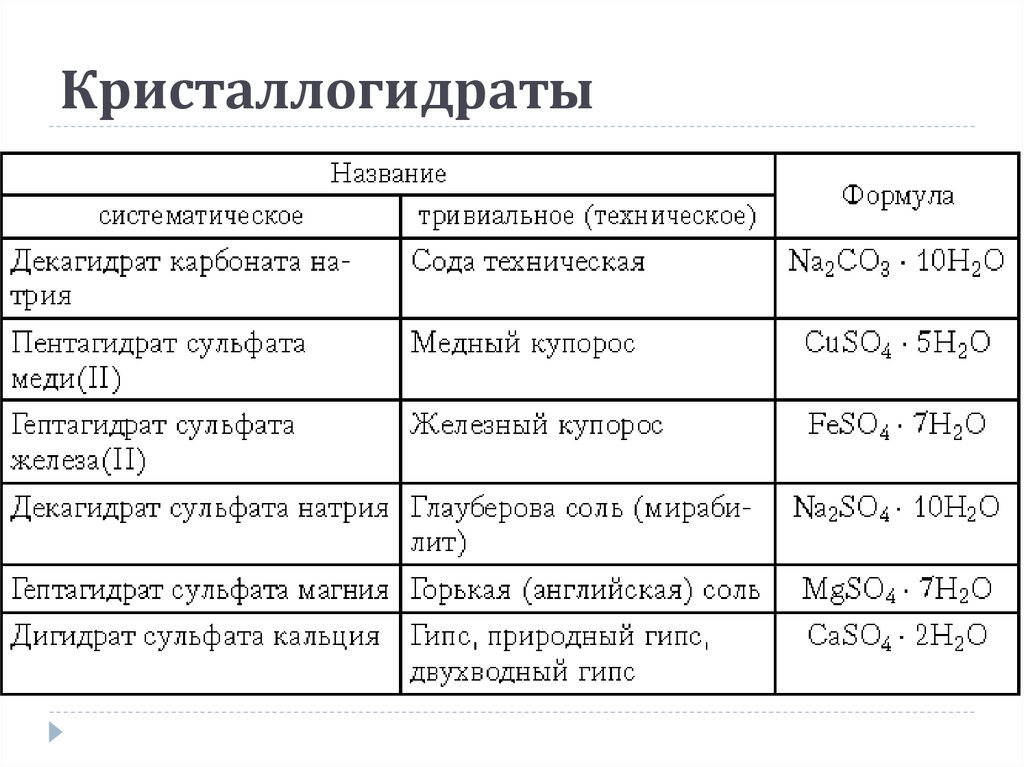
30. Кристаллогидраты
Кристаллогидраты – кристаллы, содержащиемолекулы воды.
Число H2O
(греческие
числительные)
гидрат
Название
соли
Na2SO4·10H2O – декагидрат сульфата натрия
CuCl2·5H2O – пентагидрат хлорида меди (ІІ)
Название
кристаллогидрата















 Химия
Химия








