Похожие презентации:
Оксиды: получение, свойства, применение
1.
2.
3.
Оксиды – это сложные соединения, состоящие изатомов двух элементов, одним из которых
является кислород, с валентностью равной двум.
Состав оксидов выражается общей формулой:
ЭхОу
где х – число атомов элемента, у – число атомов кислорода.
Примеры оксидов: СаО,
Fe2O3, ZnO,
BeO, NO2 , P2O5
4.
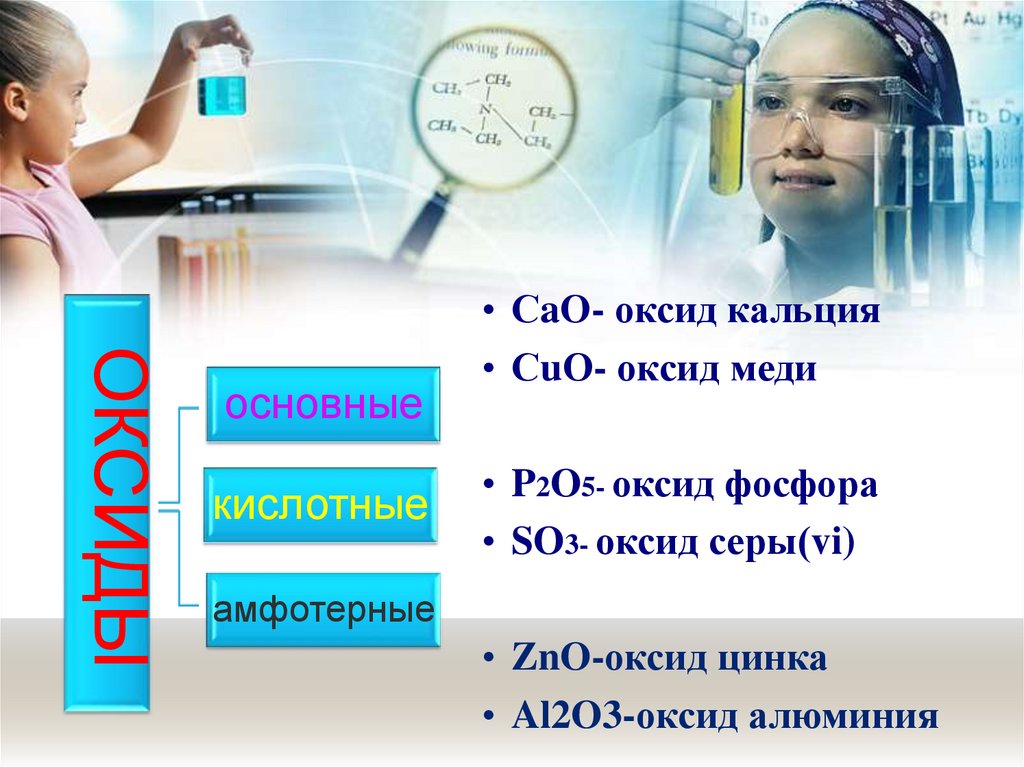
ОКСИДЫосновные
кислотные
• СaО- оксид кальция
• СuО- оксид меди
• P2O5- оксид фосфора
• SO3- оксид серы(vi)
амфотерные
• ZnO-оксид цинка
• Al2O3-оксид алюминия
5.
Получение оксидов1. Горение
а) Простых веществ:
S + O2 = SO2
2H2 + O2 = 2H2O
2N2 + 5O2 = 2N2O5
б) Сложных веществ:
2H2S + 3O2 = 2H2O + 2SO2
CH4 + 2O2 = CO2 + 2H2O
2.Разложение
а) кислот: H2CO3 = H2O + CO2
H2SO3 = H2O + SO2
б) оснований (не растворимых):
Cu(OH)2 = CuO + H2O
2Fe (OH)3 = Fe2O3 + 3H2O
в) солей : CaCO3 = CaO + CO2
6.
7.
8.
9.
10.
11.
• 1. Глава 5, §30 упр.1-2 с92• 2. Закончите уравнения химических реакций,
дайте название веществам:
• а) P + O2 →
• б) Al + O2 →
• в) H2SO4 + Fe2O3 →
• г) BaO + HCl →
• д) C2H4 + O2 →










 Химия
Химия








