Похожие презентации:
Решение задач на «массовую долю выхода»
1. Решение задач на «массовую долю выхода»
2.
По условию задачи дается «практическая»масса или «практический» объём, а по
уравнению реакции рассчитывается
« теоретическая» масса или «теоретический»
объем.
m(практ)
W (вых) =
х 100%
m (теор.)
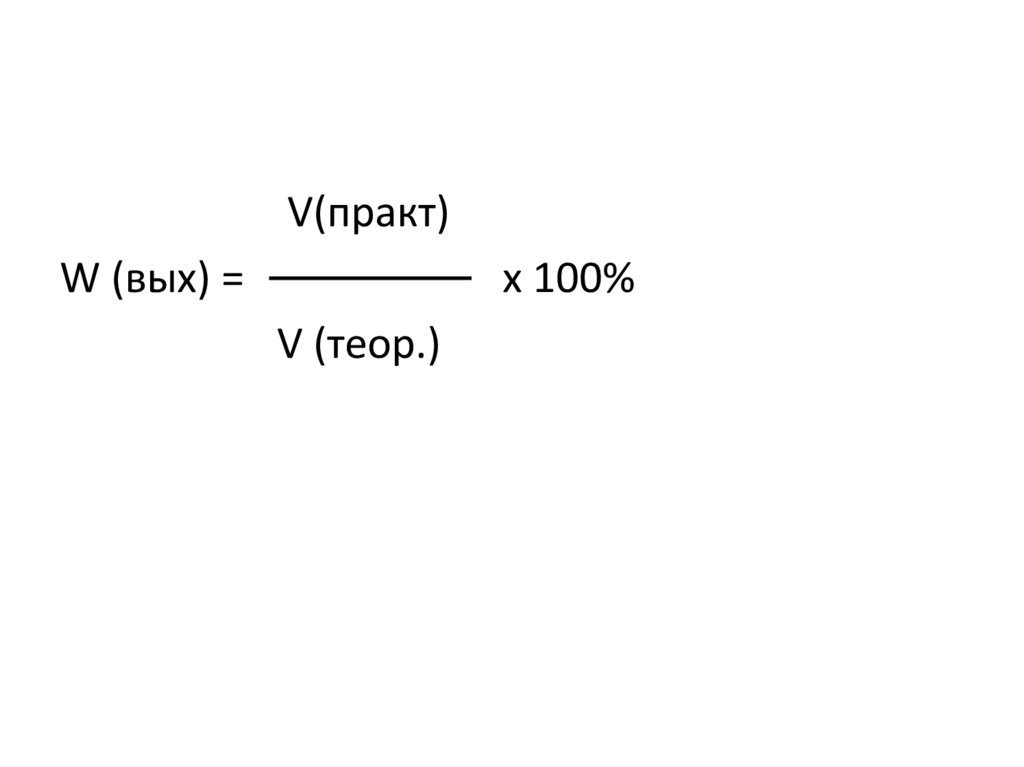
3.
V(практ)W (вых) =
х 100%
V (теор.)
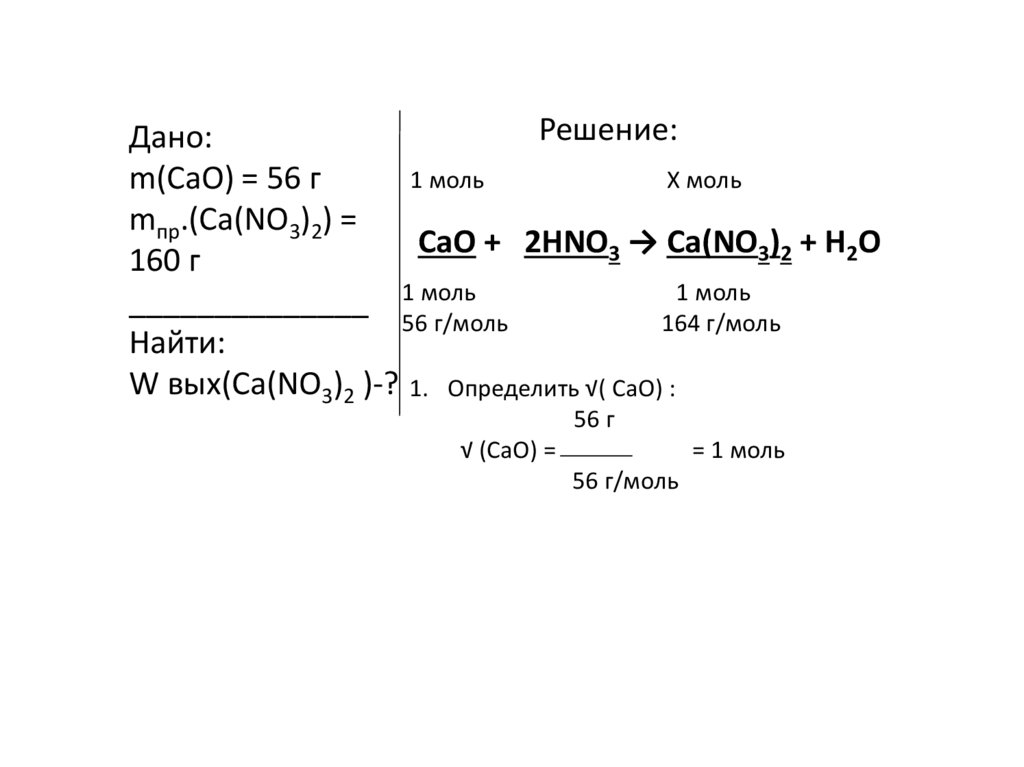
4. Задача 1.
При добавлении к 56 г оксида кальцияазотной кислоты получили 160 г нитрата
кальция. Определить массовую долю
выхода образовавшейся соли.
5.
Решение:Дано:
1 моль
Х моль
m(CaO) = 56 г
mпр.(Ca(NO3)2) =
CaO + 2HNO3 → Ca(NO3)2 + H2O
160 г
1 моль
______________ 1 моль
56 г/моль
164 г/моль
Найти:
W вых(Ca(NO3)2 )-? 1. Определить √( CaO) :
56 г
√ (СaO) =
= 1 моль
56 г/моль
6.
2.Определить √( Ca(NO3)2)теор. иm (Ca(NO3)2) теор.( по уравнению) :
√( Ca(NO3)2) теор. = 1 моль
m (Ca(NO3)2) теор. = 164 г.
7.
3. Определить W (выхода)m(практ)
W (вых) =
х 100%
m (теор.)
160 г
W (вых) =
х 100% = 97,6%
164
Ответ: 97,6%.
8. РЕШИТЬ ЗАДАЧИ.
1. Какая масса нитрата магния получится привзаимодействии 20 г оксида магния и
азотной кислоты, если массовая доля
выхода соли равна 80%.
2. Определить массу меди, образующейся
при взаимодействии сульфата меди (II) и
12 г железных опилок. Выход меди 70%.
3. Определить объем водорода, полученного
при взаимодействии 28 г железа и соляной
кислоты. Выход водорода 30%.
9. РЕШИТЬ ЗАДАЧИ
4. Определить массу оксида меди (II),полученную при взаимодействии 32 г меди
с кислородом, если массовая доля выхода
оксида составляет 95%.







 Химия
Химия








