Похожие презентации:
Элементы VI А группы
1. ЭЛЕМЕНТЫ VI А ГРУППЫ
Халькогены от лат«рождающие руды» Кислород – O
Сера – S
Селен – Se
Теллур – Te
Полоний – Po
Ливермоний – Lv
2. План изучения
1. Положение серы в ПСВозможные степени окисления.
2. История открытия элементов
3.Нахождение в природе
4.Физические свойства.
Аллотропия
5.Химические свойства
6. Получение и применен
3.
4. Степени окисления
-20
+2
+4
+6
! Кроме кислорода и полония, и
ливермония
5. Кислород
Постоянные степениокисления.: 0, -2 (F),
+1 (H2O2)
Не свойственные
Ст. окисления: -1; +2
- +2
-1
ОF2, H2O2
6.
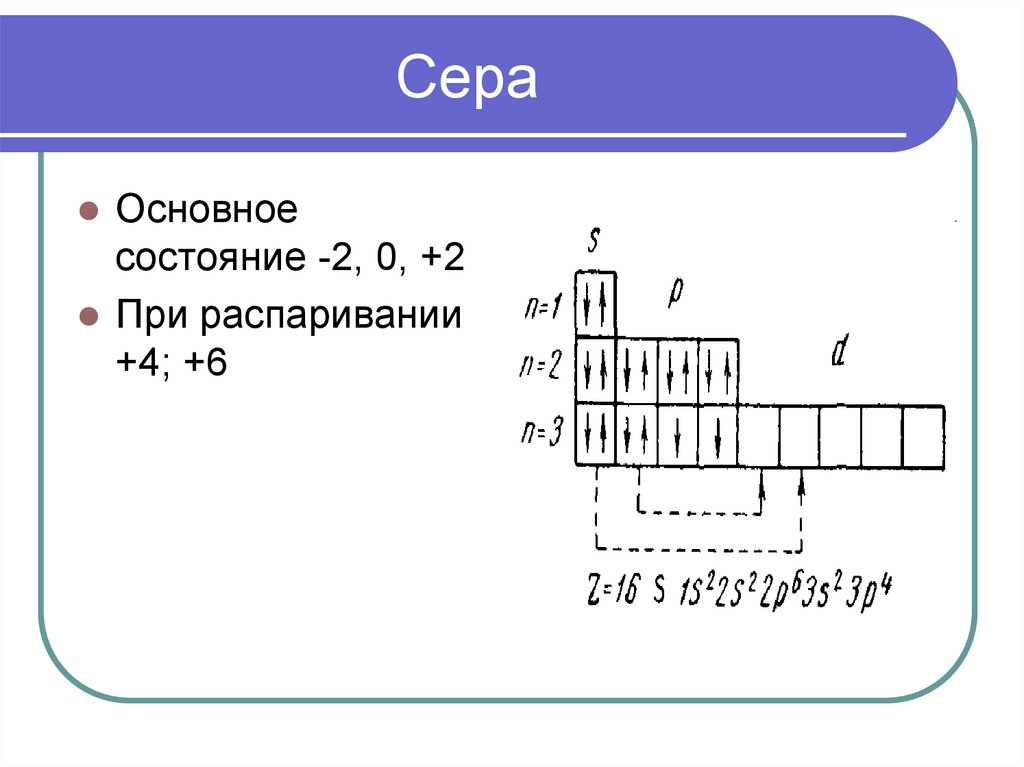
7. Сера
Основноесостояние -2, 0, +2
При распаривании
+4; +6
8. 2.История открытия элементов
Кислород былодновременно получен
шведским ученым К. Шееле
в 1773 г. и английским химиком
Дж. Пристли в 1774 г. В 1777 г.
А. Лавузье объяснил
процессы дыхания и горения
и дал название кислороду
oxygenium – рождающий
кислоты
9. Открытие кислорода
В 1777 году А. Лавуазье сделал выводы, чтоэтот газ является одним из составляющих
элементом атмосферы. Теория о флогистоне
была, наконец, то разрушена. В дальнейшем А.
Лавуазье посвятил не один год на изучение
кислорода, в 1779 году дав ему название –
охуgenium, в переводе означающий –
рождающий кислоту
10. СЕРА
С серой человек познакомился ещедоисторических временах. Она считалась
произведением сверхчеловеческих существ из
Мира духов или подземных богов. Очень давно сера
стала применяться в составе различных горючих
смесей для военных целей.
Элементарную природу
серы установил Лавуазье в
своих опытах по сжиганию. С
введением пороха в Европе
Началось развитие добычи
природной серы, а также
разработка способа
получения её из пиритов;
11. СЕЛЕН
Был открыт шведскимхимиком и минералогом
Я. Берцелиусом в 1817 году.
В то время он вместе
с другим учёным Юхан
Готлиб Ган (получившего Mn и
изучившим его свойства)
проводил исследования
метода производства серной
кислоты. В ходе опытов были
найдены осадки красного с
примесью светло-коричневого
оттенка вещества.
12. СЕЛЕН
Берлинский учёный Мартин Клапротутверждал, что наличие характерного запаха говорит
о наличии теллура. Исследования показали, что
новый, ранее неизвестный элемент имеет схожие
свойства с теллуром, но таковым не является
Берцелиус считал, что этот элемент был родственен
теллуру, открытому в 1798 г. и названному в честь
Земли (Tellus — латинское название планеты Земля).
Новый элемент он назвал селеном в честь Луны
(Selene - богиня Луны в античной Греции
13. ТЕЛЛУР
В 1782 г. горный инспектор ФранцИозеф Мюллер исследовал
золотоносную руду, Мюллер
выделил новый металл, но полной
уверенности в том, что он
действительно новый , не было.
Элемент, открытый
Мюллером, пытались изучать и
другие ученые, однако лишь
, через 16 лет после его открытия Мартин Генрих Клапрот —
один из крупнейших химиков того времени —
неопровержимо доказал, что этот элемент на самом деле
новый, и предложил для него название «теллур»
14.
ПОЛОНИЙ был открыт в 1898 годусупругами Пьером Кюри и Марией СклодовскойКюри. Открытие было сделано
совершенно случайно. Мария
изучала урановую руду и
практически «наткнулась»
на новый радиоактивный
металл. До этого научный
мир знал лишь 2 летучих
радиоактивных элемента:
уран и торий. Название
новому металлу она
дала созвучно своей родине
— Польше.
15. ЛИВЕРМОНИЙ Lv
Открыт путём синтеза изотопов в 2000 г вОбъединённом институте ядерных исследований
(Дубна, Россия) в сотрудничестве
с Ливерморской национальной
лабораторией (США),
Научно-исследовательским
институтом атомных реакторов
(Димитровград, Россия) и
«Электрохимприбором» (Лесной,
Россия). Его свойства мало
изучены
16. Lv
История открытия: заявление об открытииэлементов 116 и 118 в 1999
году в Беркли (США)[11] оказалось ошибочным и
даже фальсифицированным. Синтез по
объявленной методике не был подтверждён в
российском, немецком и японском центрах ядерных
исследований, а затем и в самих США. Статья с
сообщением об открытии была отозвана.
19 июля 2000 г. впервые наблюдался альфараспад ядра 116-го элемента, полученного в
результате бомбардировки мишени
из кюрия ионами кальция.
17. 3. РАСПРОСТРАНЕНИЕ В ПРИРОДЕ
КИСЛОРОД:Самый распространенный элемент земной коры - на
долю кислорода приходится приблизительно половина
всей массы земной коры(47,2%).
В воздухе кислорода содержится 20,95% по объему или
23,15% по массе
В свободном состоянии он находится в атмосферном
воздухе.
В связанном виде входит в состав воды (89 % массы
мирового океана, минералов (свыше 1400), горных
пород и всех веществ, из которых построены организмы
растений и животных.
18. Кислород
В живойприроде
В неживой
природе
Входит в состав
многих
органических
веществ
65% массы и
25% по
количеству
атомов в живых
клетках
47% земной
коры (по массе)
85% морских и
пресных вод (по
массе)
20% по массе и
23% по объёму
атмосферы
(александрит)
19. Минералы
магнетита Fe3O4, гематит Fe2O3,Be3Al2[Si6O18]
(изумруд)
20. Сера
В живой природеВ неживой природе
Серные бактерии могут
окислять сероводород от
гниющих органических
остатков до серы и
накапливать её
Жизненно важный
элемент для высших
организмов, составная
часть многих белков,
концентрируется в
волосах
16 по распространённости
в земной коре, 6 по
распространённости в
воде
Большие скопления
самородной серы (с
содержанием > 25 %)
редки
Серная руда
разрабатывается в
месторождениях
самородной серы,
добывается из
сульфидных руд и
промышленных газов
21.
пиритЦинковая обманка ZnS
Свинцовый блеск PbS
22. Минералы серы
23.
Сера вприроде
Сера входит в состав
белков. Особенно
много серы в
белках волос,
рогов, шерсти.
Кроме этого сера
является составной
частью
биологически
активных веществ:
витаминов и
гормонов. При
недостатке серы в
организме
наблюдается
хрупкость и
ломкость костей,
выпадение волос.
24. Серой богаты бобовые растения (горох, чечевица), овсяные хлопья, яйца
25. Селен
В живой природеВ неживой природе
Входит в состав активных центров
некоторых белков в форме
селеноцистеина. Является
необходимым для жизни
микроэлементом, хотя
большинство соединений
достаточно токсичны
В организме человека содержится
10—14 мг селена, бо́льшая его
часть сконцентрирована в печени,
почках, селезенке, сердце
В земной коре 500мг/т
В морской воде 0,4
мкг/л
26. ТЕЛЛУР И ПОЛОНИЙ
Те – рассеянный редкий элемент, содержание вземной коре 10-7%. Содержится во многих
минералах с золотом, серебром, платиной, медью,
железом, свинцом, висмутом, в сульфидных
минералах.
Ро Изотопы 216Ро (t1/2 = 0,15 с) и 212Ро (t1/2 = 3 ·
10–7 с). Очень малое время жизни изотопов
означает, что в природе они практически
отсутствуют.
27. Теллур
В живой природеВ неживой природе
Микроколичества
теллура всегда
содержатся в живых
организмах, его
биологическая роль
не выяснена
Теллур и его летучие
соединения
токсичны. Попадание
в организм вызывает
тошноту, бронхиты,
пневмонию
Содержание в земной
коре 1⋅10−6% по
массе
Встречается
самородный теллур и
вместе с селеном и
серой (японская
теллуристая сера
содержит 0,17 % Те и
0,06 % Se)
28. Полоний
В живой природеВ неживой природе
В организме человека
полоний ведет себя
подобно своим
химическим гомологам,
селену и теллуру,
концентрируется в
печени, почках,
селезёнке и костном
мозге
Полоний-210 в
небольших количествах
находится в природе и
накапливается табаком
Поэтому полоний
всегда присутствует в
урановых и ториевых
минералах.
Равновесное
содержание полония в
земной коре — около
2⋅10−14% по массе
29. Ливерморий
В природене
встречается
30.
31. АЛЛОТРОПИЯ-
АЛЛОТРОПИЯ явление, при котором один и тот жеэлемент образует несколько простых
веществ.
Эти вещества являются аллотропными
модификациями
32.
33.
34.
35.
Аллотропныемодификации
серы
Ромбическая
Моноклинная
Пластическая
36.
37. Ромбическая сера
38. Моноклинная сера
Моноклинная(β –сера)- S8,
темно-желтые
иглы,
t°пл. = 119°C;
устойчивая при
температуре более
96°С; при обычных
условиях
превращается в
ромбическую
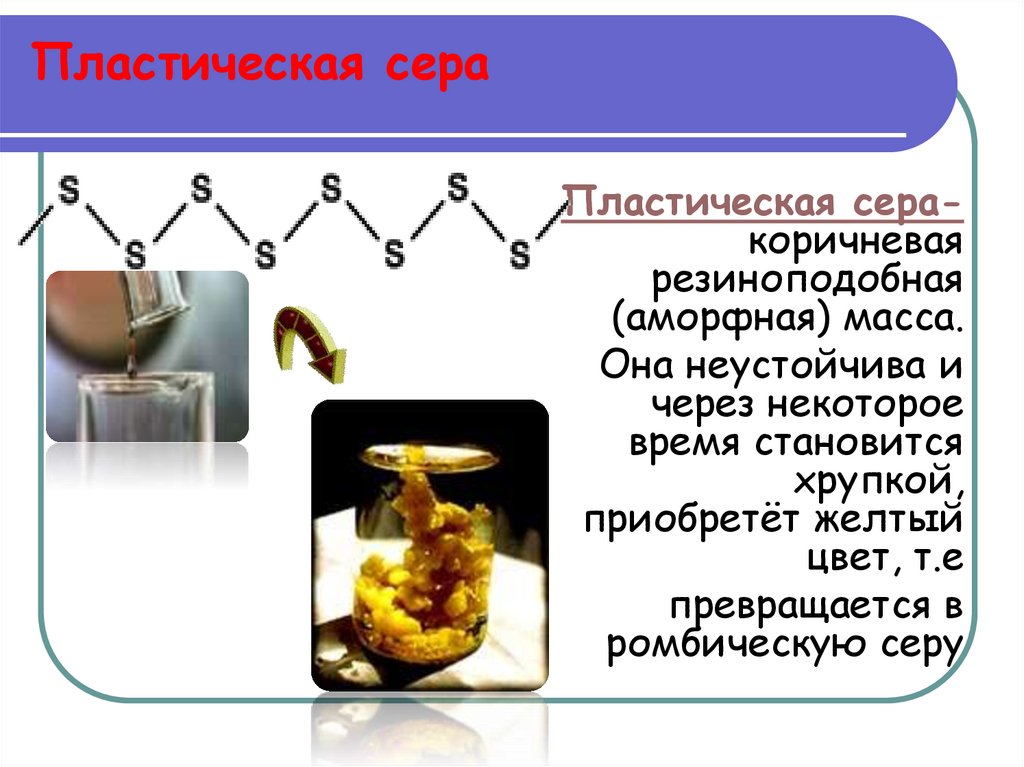
39. Пластическая сера
Пластическая серакоричневаярезиноподобная
(аморфная) масса.
Она неустойчива и
через некоторое
время становится
хрупкой,
приобретёт желтый
цвет, т.е
превращается в
ромбическую серу
40.
41. Черная и красная модификация селена
42. Химические свойства серы
43.
44.
45.
46.
47.
48.
49.
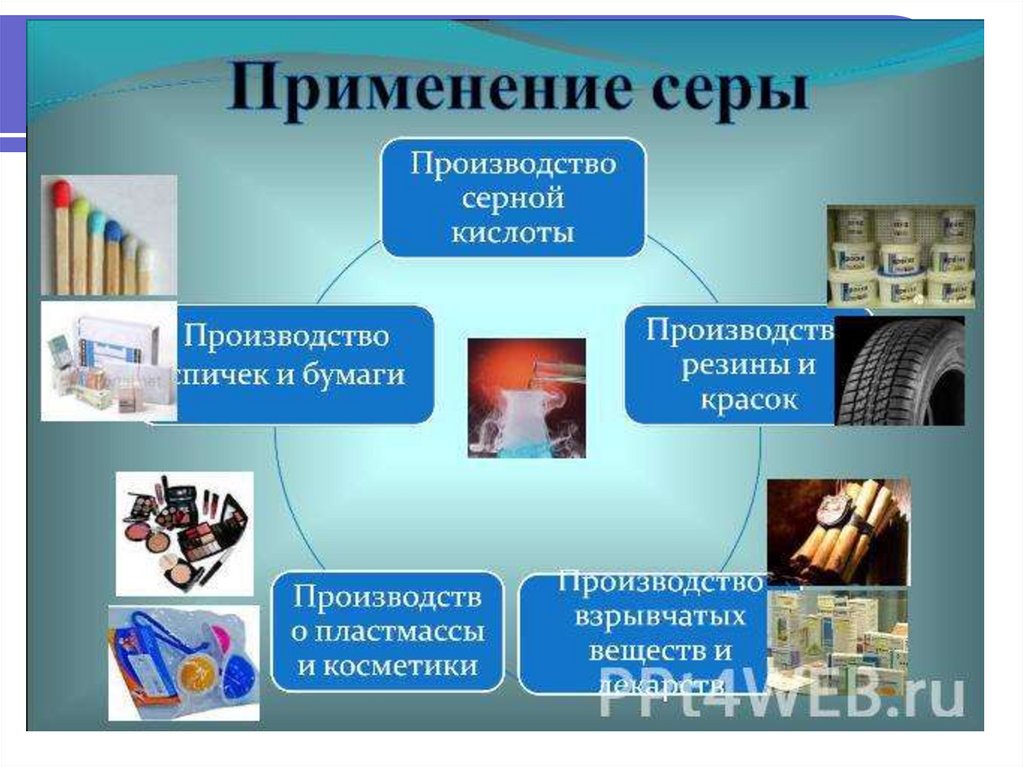
50. Применение серы
Производство спичекМедицина
Производство резины
Сельское хозяйство
Производство
серной
кислоты
Производство взрывчатых
веществ
Красители
51. Биологическая роль СЕЛЕНА
Входит в состав белковв форме аминокислоты
селеноцистеина.
Является необходимым
для жизни
микроэлементом, но
большинство соединений
достаточно токсичны
(селеноводород, селеновая и селенистая кислота)
даже в средних концентрациях.
52.
53. Домашняя работа
Записать и выучить способы получениясеры, ее химические свойства.
Написать ОВР получения серы.
Знать основные области применения
халькогенидов и их биологическую
роль для человека


















































 Химия
Химия








