Похожие презентации:
Решение экспериментальных задач по получению углеводородов
1.
Проблема урока:2.
3.
Тема урока:Решение экспериментальных
задач по получению
углеводородов
4.
Эпиграф урока:«
Химиком никоим образом стать невозможно,
не видав самой практики
и не принимаясь за химические операции»
М.В. Ломоносов
5.
Цель урока:• Сегодня на уроке с помощью эксперимента и
решения задач обобщим знания по теме
Получение углеводородов
• Для этого повторим правила техники
безопасности.
6.
Правила техники безопасности:1)Выполнять все указания учителя
2)Соблюдать осторожность при обращении с
оборудованием и химическими реактивами
3)Осторожно обращаться с органическими
веществами
4)Использовать средства индивидуальной защиты
(халат, перчатки, очки)
5)Поддерживать чистоту рабочего места
7.
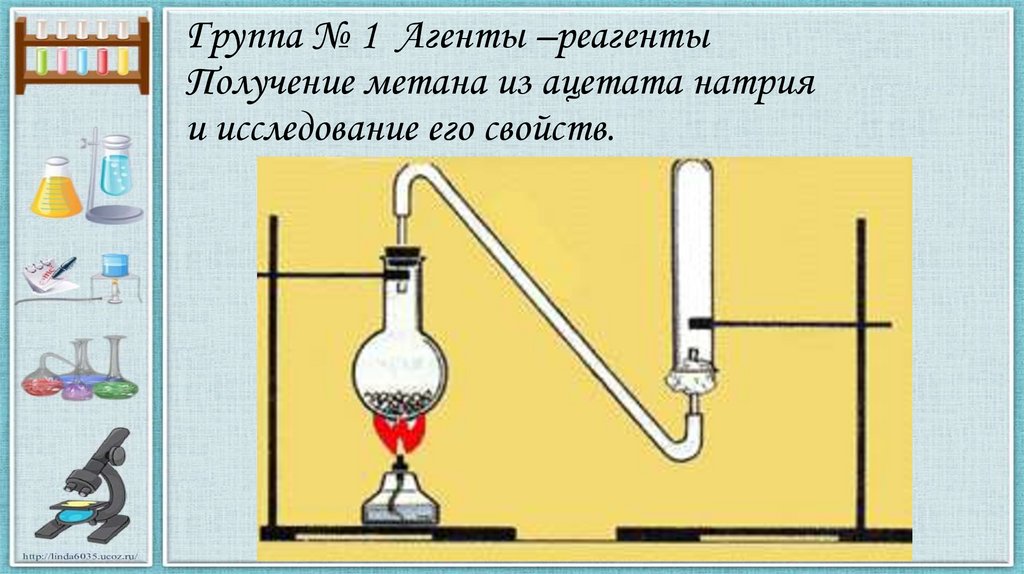
Группа № 1 Агенты –реагентыПолучение метана из ацетата натрия
и исследование его свойств.
8.
Группа № 1 Агенты – реагентыПолучение метана из ацетата натрия
и исследование его свойств
• В лабораторных условиях метан получают при
нагревании ацетата натрия с натронной
известью.
CH3COONa + NaOH →CH4 + Na2CO3
• Какие еще способы получения алканов предложит
группа?
9.
Группа № 1 Агенты - реагентыЗадачи:
Уровень 1.
• Ацетат натрия массой 41 г сплавили с избытком
гидроксида натрия. Объем газа, выделившегося в
результате реакции, составил…
Уровень 2.
• Ацетат натрия массой 2,46 г сплавили с гидроксидом
натрия массой 2,0 г. Твердый остаток растворили в 50 г
воды. Определите массовые доли веществ в полученном
растворе.
10.
Итог работы группы:• Представление работы группы
• Проверим ответы :
Уровень 1
V (CH4) = 11,2 л
Уровень 2
w (Na2CO3) = 5,89 %
w (NaOH) = 1,48 %
• Оценивание работы группой № 2
11.
Группа №2Алкексы
• Получение этилена в лаборатории способом деполимеризации
полиэтилена
12.
Группа № 2 Алкексы• Деполимеризация полиэтилена
n(- CH2 – CH2 –) → CH2 = CH2
• Качественные реакции на обнаружение этилена :
а) взаимодействие с йодной водой
б) с раствором перманганата натрия.
• Предложите другие способы получения углеводородов
этиленового ряда.
13.
Группа № 2 АлкексыЗадачи:
Уровень 1.
• Объем этилена (н.у.), который можно получить при
взаимодействии 43,6 г бромэтана со спиртовым раствором
щелочи, равен…… л (округлите число с точностью до
сотых)
Уровень 2.
• Алкен массой 2,24 г может обесцветить 200 г бромной
воды, массовая доля брома в которой равна 3,2 %.
Установите молекулярную формулу алкена.
14.
Итог работы группы № 2• Представление работы группы № 2
• Проверим правильные ли ответы
Уровень 1.
V (C2H4) = 8,96 л
Уровень 2.
М (С4Н8) = 56 г/моль
• Оценивание работы групп
15.
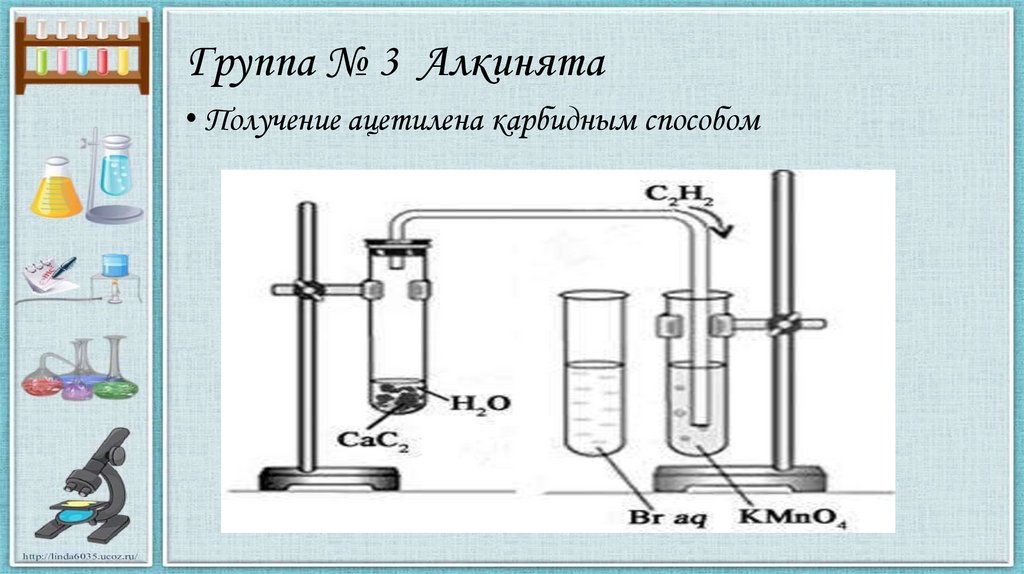
Группа № 3 Алкинята• Получение ацетилена карбидным способом
16.
Группа № 3 Алкинята• Получение ацетилена карбидным способом:
CaC2 + H2O → C2H2 + Ca(OH)2
• Качественные реакции на алкины
а) пропускание ацетилена через водный раствор
перманганата калия
б) через раствор йодной воды
в) через аммиачный раствор хлорида меди (I)
• Другие способы получения ацетилена
17.
Группа № 3 АлкинятаУровень 1.
• 3 г карбида кальция обработали водой, в результате реакции
выделился газ, объемом …. Выход продукта реакции составил 75
%. Определите объем полученного газа.
Уровень 2.
• Для реакции взяли карбид магния (Mg2N3) и обработали его
водой. В результате реакции образовался газ. Его сожгли, при
этом получилось 6,72 л СО2 и 7,2 г Н2О. Плотность газа по
аргону равна 1. Определите, какой газ получился и какие
качественные реакции можете предложить для распознавания
этого газа.
18.
Группа № 3• Представление результатов работы группы
• Проверим правильность ответов
Уровень 1.
Vтеор (С2Н2) = 1,05 л; V практ (С2Н2) = 0,775 л
Уровень 2.
М (С3Н4) = 40 г/моль
• Оценивание деятельности детей
19.
Выводы• С помощью эксперимента получили
предельные и непредельные углеводороды,
которые используют не только как топливо
• Отработали решение задач разных типов по
теме Углеводороды
20.
Само- и взаимооценкаЗаполните, пожалуйста, лист
само- и взаимооценки, ответив на вопросы:
• Что было важным?
• Что удивило?
• Что получилось и не получилось?
• Чем довольны?
• Что вызвало вопрос?
21.
Рефлексия:Оцените себя и свою работу на уроке
Вам было познавательно, не интересно,
сложно, понятно.
Прикрепите свой знак к мишени, как
выстрел!
22.
Рефлексия23.
Спасибо за внимание!24.
Проблема урока:2018 год – год экологии в России. На нашей
планете нет ничего вечного, природные
ресурсы исчерпаемы, особенно это относится
к углеводородному сырью.
Химия – наука, которая способна решить
некоторые проблемы, связанные с
использованием углеводородов.
Сама она и источник проблем, и источник их
решения.
25.
Проблема• Мы изучили большую тему Углеводороды. Углеводороды –
ресурсы, в виде природного газа, нефти, каменного угля. По
одним прогнозам этих ресурсов хватит на 25 лет, по другим
на 50. В настоящее время ученые разных стран ищут
альтернативные источники получения энергии и сырья для
химической промышленности.






















 Химия
Химия








