Похожие презентации:
Фосфор и его соединения. Урок по химии для 9 класса
1. Фосфор и его соединения.
Урок по химии для 9 класса.Учитель МКОУ Куликовской ООШ Скуба З.М.
2.
История открытия фосфораХенниг Бранд в 1669 г.
открыл фосфор
Антуан Лоран Лавуазье
в начале 70-х годов XVIII в
доказал, что фосфор простое тело.
Р. Бойeль в 1680 г. получил
фосфор независимо от
Бранда
А.А.Мусин-Пушкин
в 1797 г.
получил фиолетовый
(красный) фосфор
3.
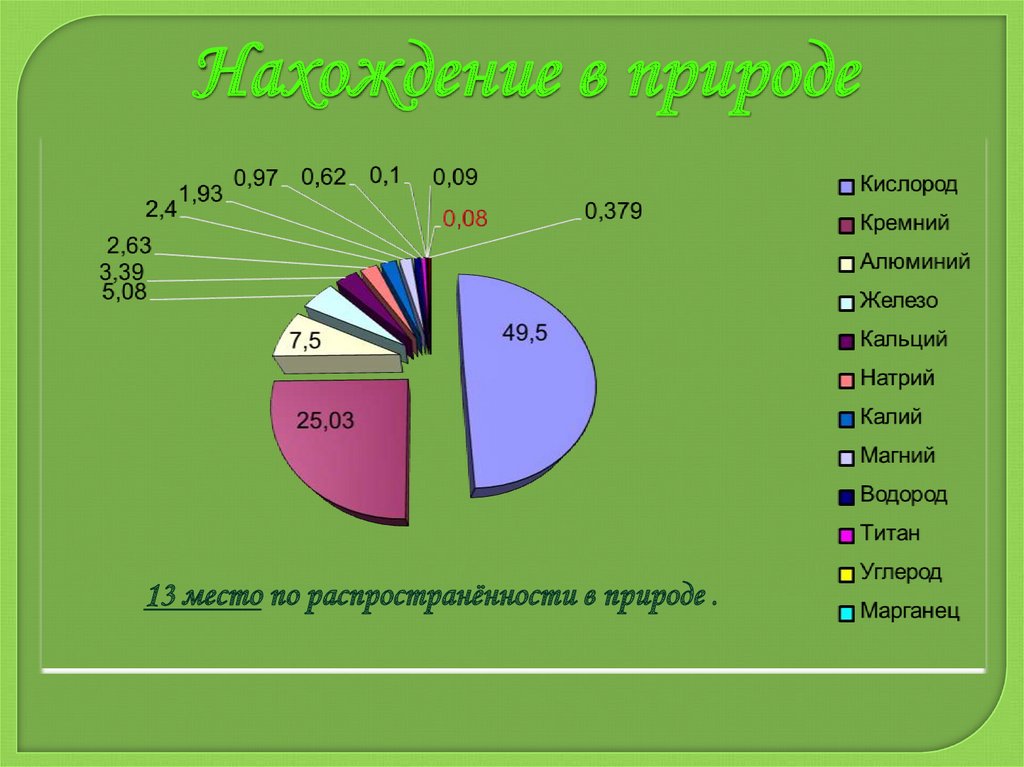
Нахождение в природе13 место по распространённости в природе .
4.
Природные соединения фосфорамонацит
гидроксилапатит
фосфорит
Фосфор в свободном виде не
встречается – только в виде
соединений. Важнейшими
природными соединениями фосфора
являются минералы фосфориты и
апатиты.
торбернит
апатит
фторапатит
вивианит
амблигонит
5.
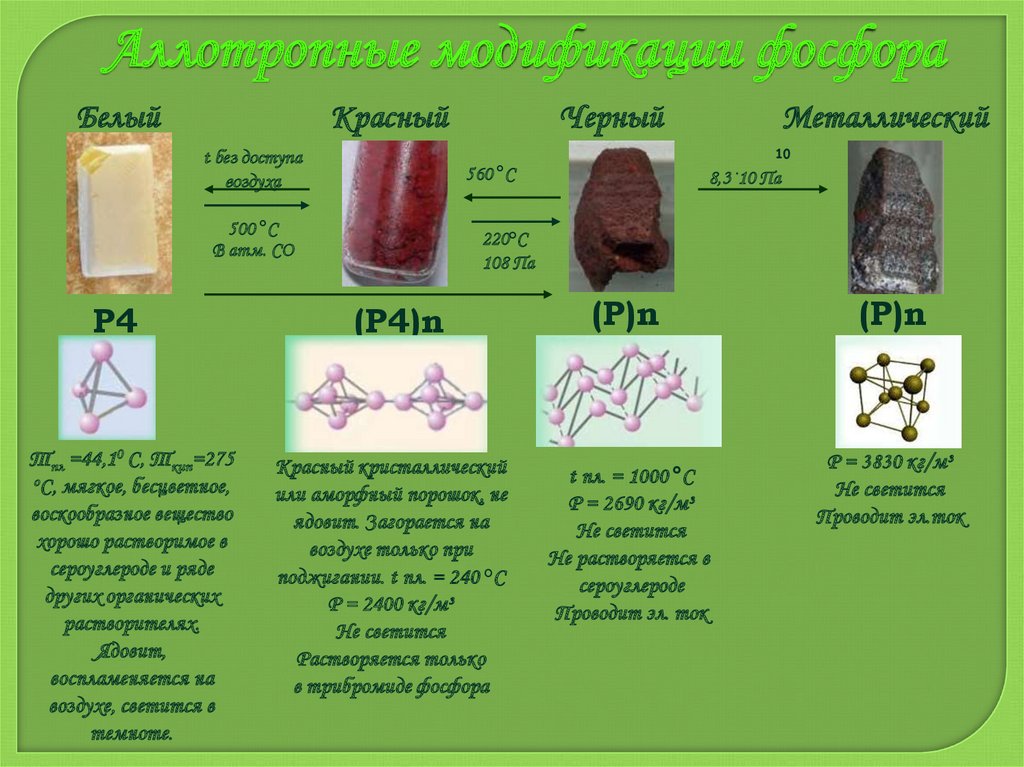
Аллотропные модификации фосфораБелый
Красный
t без доступа
воздуха
Тпл =44,10 С, Ткип=275
оС, мягкое, бесцветное,
воскообразное вещество
хорошо растворимое в
сероуглероде и ряде
других органических
растворителях.
Ядовит,
воспламеняется на
воздухе, светится в
темноте.
Металлический
10
560 °C
500 °C
В атм. СО
P4
Черный
8,3·10 Па
220°С
108 Па
(P4)n
Красный кристаллический
или аморфный порошок, не
ядовит. Загорается на
воздухе только при
поджигании. t пл. = 240 °С
Ρ = 2400 кг/м³
Не светится
Растворяется только
в трибромиде фосфора
(P)n
t пл. = 1000 °С
Ρ = 2690 кг/м³
Не светится
Не растворяется в
сероуглероде
Проводит эл. ток
(P)n
Ρ = 3830 кг/м³
Не светится
Проводит эл.ток
6.
Получение фосфораФосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и
кремнезёмом при температуре 1600 °С:
2Ca3(PO4)2+10C+6SiO2→P4+10CO+6CaSiO3.
Образующиеся пары белого фосфора конденсируются в приёмнике под водой. Вместо фосфоритов
восстановлению можно подвергнуть и другие соединения, например, метафосфорную кислоту:
4HPO3 + 12C → 4P + 2H2 + 12CO.
7.
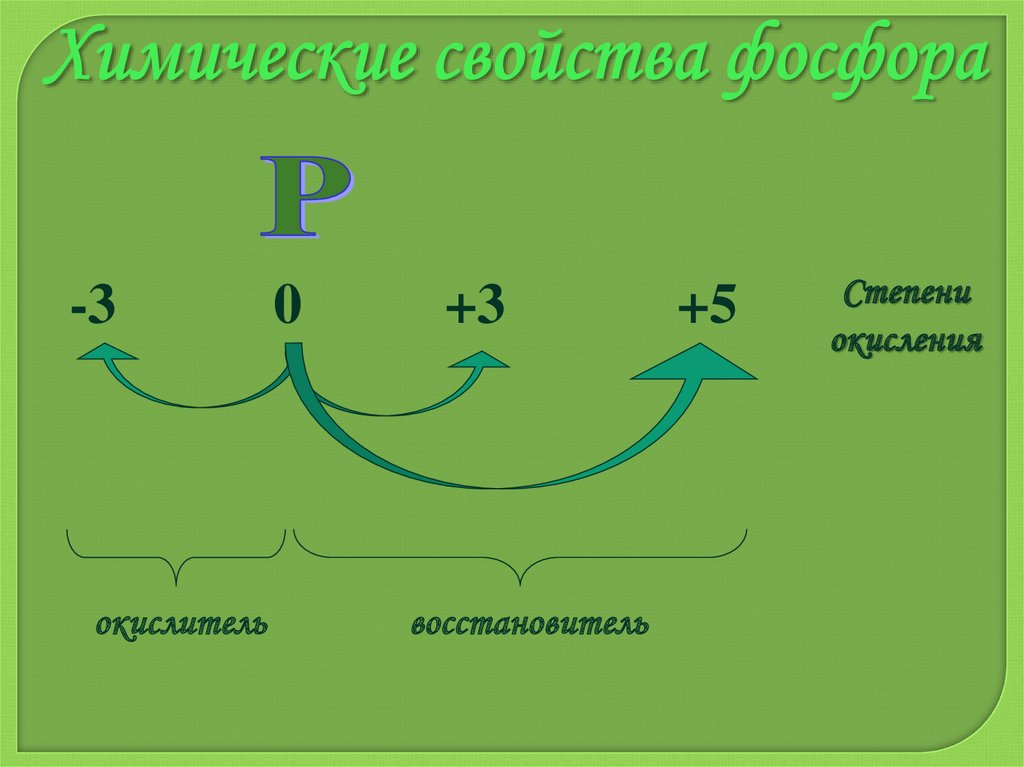
-3окислитель
0
+3
восстановитель
+5
Степени
окисления
8.
1. Восстановительные:А) Взаимодействие с кислородом.
4Р+502 =t 2Р2O (избыток О2)
4Р+ ЗО2 = 2Р2O3 (недостаток О2)
Б) Взаимодействие с неметаллами.
2Р+ЗСl2 = 2РС13
Г) С азотной кислотой.
ЗР+ 5HNO3 + 2Н2О = ЗН3РO4 + 5NO
2. Окислительные:
А) С металлами.
2P+3Mg = Mg3P2
В) С водородом.
2P+3Р2= РН3
9.
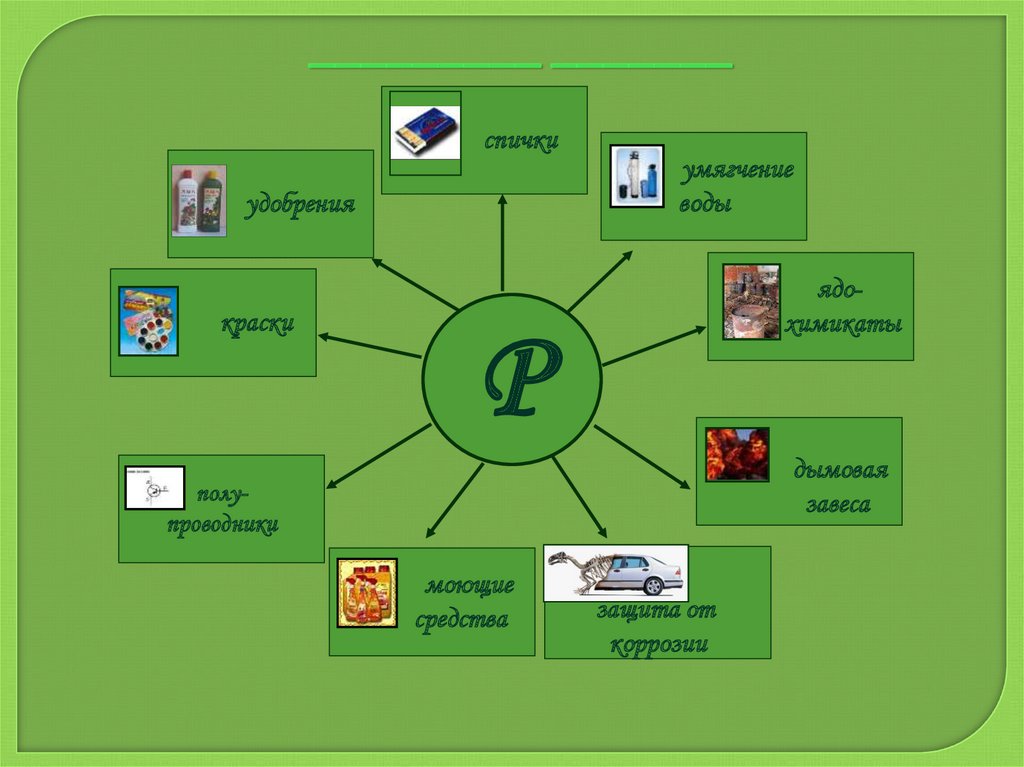
_________ _______спички
удобрения
краски
умягчение
воды
ядохимикаты
Р
дымовая
завеса
полупроводники
моющие
средства
защита от
коррозии
10.
Оксид фосфора (V)Белые кристаллы, t пл.= 5700оС, t кип.= 6000оC, ρ= 2,7 г/см3. Имеет
несколько модификаций. В парах состоит из молекул P4H10, очень
гигроскопичен (используется как осушитель газов и жидкостей).
Получение:
4P + 5O2 = 2P2O5
Химические свойства
Все химические свойства кислотных оксидов: реагирует с водой,
основными оксидами и щелочами
1) P2O5 + H2O = 2HPO3 (метафосфорная кислота)
P2O5 + 2H2O = H4P2O7 (пирофосфорная кислота)
P2O5 + 3H2O = 2H3PO4 (ортофосфорная кислота)
2) P2O5 + 3BaO =Ba3(PO4)2
3) Р2О5 + 6 Nа ОН = 2 Nа3РО4 + 3 Н2О
Благодаря исключительной гигроскопичности оксид фосфора (V)
используется в лабораторной и промышленной технике в качестве
осушающего и дегидратирующего средства. По своему осушающему
действию он превосходит все остальные вещества.
11. Ортофосфорная кислота.
Получение ортофосфорной кислотыВ лаборатории
окисление фосфора
30%-ной азотной
кислотой:
3P + 5NO3 + 2H2O
= 3H3PO4 + 5NO
В промышленности
Экстракционный метод
Термический метод
обработка измельченных
природных фосфатов серной
кислотой:
2P + 5H2SO4 = 2H3PO4 +
5SO2 + 2H2O
Ортофосфорная кислота
затем отфильтровывается
и концентрируется
упариванием.
Термический метод состоит
в восстановлении природных
фосфатов до свободного
фосфора с последующим его
сжиганием до Р4О10 и
растворением последнего в
воде. Производимая по
данному методу
ортофосфорная кислота
характеризуется более
высокой чистотой и
повышенной концентрацией
(до 80%).
12.
_________________
_________
_______
общие с другими кислотами
специфические
1. Изменяет окраску индикаторов.
Диссоциация происходит ступенчато:
Н3РО4——>Н++Н2РО4Н2РО-4——> Н++НРО42НРО42- ——> Н++РО432. Реагирует с металлами, расположенными
в ряду активности до водорода:
6Nа+2Н3РО4 ——>2Nа3РО4+ЗН2
3. Реагирует с основными оксидами:
ЗСаО+2Н3РО4 ——>Са3(РО4)2+ЗН2О
4. Реагирует с основаниями и аммиаком:
Н3РО4+3NaОН ——>Nа3РО4+ЗН2О
Н3РО4+2NН3——>(NН4)2НРО4
Н3РО4+NаОН ——>NаН2РО4+Н2О
5. Реагирует с солями слабых кислот:
2Н3РО4+ЗNа2СО3 —>2Nа3РО4+ЗСО2+ЗН2О
1.При нагревании постепенно превращается в
метафосфорную кислоту:
2Н3Р04 ——>Н4Р207+Н20
Н4Р2О7 ——>2НРО3+Н2О
2. При действии раствора нитрата серебра
(I) появляется желтый осадок:
Н3РО4+ЗАgNО3——> Ag3P04+3HN03
3. Ортофосфорная кислота играет большую
роль в жизнедеятельности животных и
растений. Ее остатки входят в состав
аденозинтрифосфорной кислоты АТФ.








 Химия
Химия








