Похожие презентации:
Скорость химической реакции. Урок №20
1.
Урок №20Скорость химической
реакции
2.
Скорость химической реакции- изменение количества вещества в
единице объёма в единицу времени.
n2 - n1
ΔC
v = ± V·(τ - τ ) = ± Δτ
2
1
С = n/V
v - скорость реакции, моль
л·с
V - объём, л
n - количество вещества, моль
τ (тау) - время, с
С - молярная концентрация, моль/л
3.
Для гетерогенных реакцийn2 - n1
Δn
v = ± S· (τ - τ ) = ± S·Δτ
2
1
S - площадь соприкосновения частиц, м2
Химическая кинетика - раздел
физической химии, изучающий
закономерности протекания
химических реакций во времени.
4.
1. Зависимость скорости химической реакции отприроды реагирующих веществ.
2K + 2H2O = 2KOH + H2
Ca + 2H2O = Ca(OH)2 + H2
очень быстро
медленнее
очень медленно
4Fe + 2nH2O + 3O2 → 2Fe2O3·nH2O
Ag + H2O =
практически не реагирует
5.
2. Зависимость скорости химической реакции отконцентрации реагирующих веществ.
Закон действующих масс
аА + bВ → cC + dD
v = k·CAa ·CBb
k - константа скорости химической реакции
Скорость химической реакции при постоянной
температуре прямо пропорциональна
произведению молярных концентраций
реагирующих веществ, возведённых в
определённые степени (порядки).
6.
3. Зависимость скорости химической реакциитемпературы.
Правило Вант-Гоффа
t2-t1
γ 10
Δt
γ 10
v2
=
v1 =
γ - температурный коэффициент [2 - 4]
t - температура
При повышении температуры на
каждые 100 скорость реакции
увеличивается в 2 - 4 раза.
7.
Уравнение Аррениусаk = А·e
-Ea
R·T
А = z·P
k - константа скорости реакции
e - основание натурального логарифма (2,718)
Ea - энергия активации
R - универсальная газовая постоянная
Т - абсолютная температура
А - предэкпоненциальный множитель
z - пропорционально числу столкновений
Р - показывает вероятность благоприятных
столкновений
8.
4. Зависимость скорости химической реакции отналичия катализатора.
Катализатор - вещество, изменяющее скорость
(механизм) химической реакции, при этом не
расходующееся.
Катализ
Гомогенный
Гетерогенный
9.
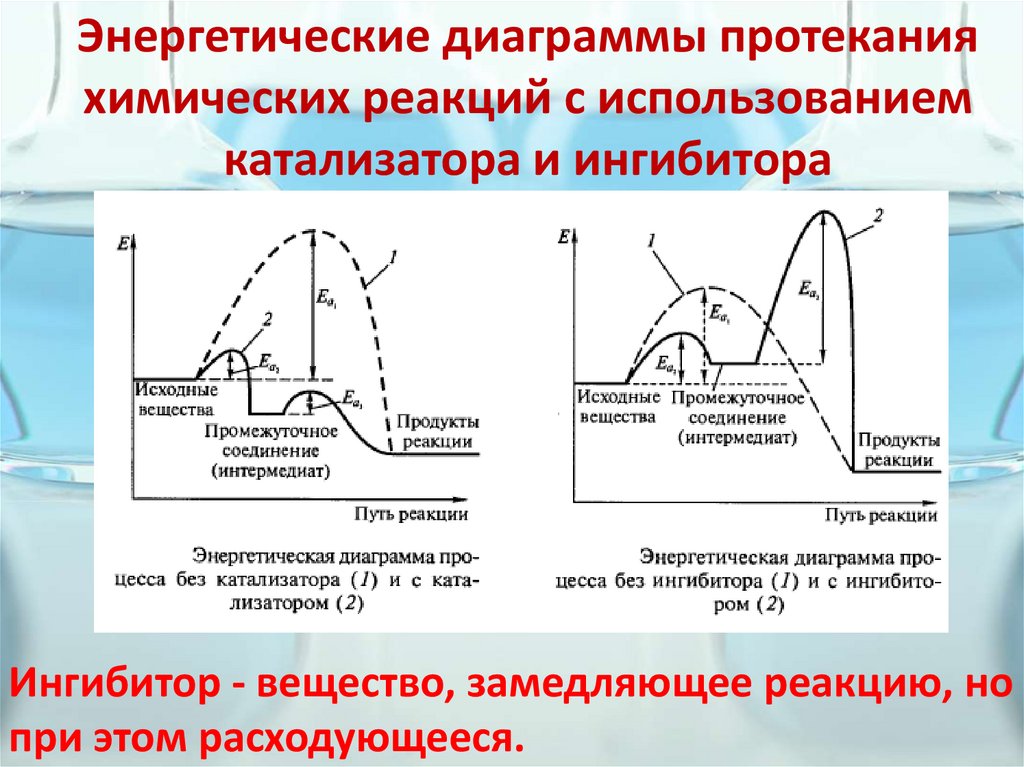
Энергетические диаграммы протеканияхимических реакций с использованием
катализатора и ингибитора
Ингибитор - вещество, замедляющее реакцию, но
при этом расходующееся.
10.
5. Зависимость скорости химической реакции отплощади (для гетерогенных реакций).
Чем больше площадь соприкосновения
реагирующих веществ, тем быстрее будет
протекать реакция между ними.
Следовательно, чем лучше измельчены вещества,
тем быстрее они реагируют.
Сахар на воздухе не горит
Сахарная пыль в воздухе взрывается при
поджигании
11.
6. Зависимость скорости химической реакции отдавления (для реакций с участием газов).
аА(газ) + bВ(тв.) → cC
v = k·рAa
Чем больше давление, тем молекулы газов
становятся ближе друг к другу и их концентрация
увеличивается, поэтому и скорость реакции
возрастает пропорционально повышению давления.
Объёмом твёрдых или жидких веществ, по
сравнению с объёмом газов, можно пренебречь.
12.
Решите задачи1. Как изменится скорость реакции, протекающей
в газовой фазе, при повышении температуры на
60°С, если температурный коэффициент скорости
данной реакции 2?
2. Окисление серы и ее диоксида протекает по
уравнениям:
а) S (тв.) + O2 (г.) = SO2 (г);
б) 2SO2 (г) + O2 (г.) = 2SO3 (г).
Как изменится скорость этих реакций, если
объемы каждой из систем уменьшить в четыре
раза?
13.
Домашнее задание• §15, отвечать на вопросы 1-12
стр. 136












 Химия
Химия








