Похожие презентации:
Графический диктант
1.
2.
Графический диктант ( ∩ да, − нет)1 вариант –NH3
2 вариант – HNO3
1.Хорошо растворяется в воде. 2. Легкий газ с
резким запахом. 3. Бесцветная жидкость с резким
удушливым запахом. 4. Восстановитель. 5.
Реагирует с металлами специфически. 6. Является
сильным окислителем. 7.Изменяет окраску ф/ф в
малиновый цвет. 8. При вдыхании этого вещества
происходит рефлекторное возбуждение или
торможение дыхательного центра. 9. Соли этого
вещества являются азотными удобрениями. 10. В
середине 17 века Глаубер предложил получать это
вещество из селитры действием на
нее H2SO4 (конц). Этот метод описан Жюль
Верном в «Таинственном острове».
3.
Ответы к графическому диктанту• I вариант
∩∩_∩_ _ _∩_∩
• II вариант
∩_∩ _ ∩∩_ _ ∩∩
Критерии оценивания:
«0» ошибок – 5
«1-3» ошибки – 4
«4-5» ошибок – 3
Более 5 ошибок - 2
4.
Соотнесите понятия и определения понятий1. Окислитель
А. Простые вещества, образованные атомами
одного химического элемента и имеющими разную
кристаллическую решетку
2. Восстановитель
Б. Максимальное количество электронов, которое
может принять атом химического элемента для
завершения внешнего валентного уровня
3. Аллотропные
модификации
В. Атом химического элемента, принимающего
электрон и понижающий свою степень окисления
4. Неметалл
Г. Атом элемента, на последнем уровне которого от
4 до 7 электронов и имеющий относительно
малый радиус атома
5. Высшая степень Д. Атом химического элемента, отдающего
окисления
электрон и повышающий свою степень окисления
6. Низшая степень
окисления
Е. Максимальное количество электронов, которое
может отдать атом элемента с валентного уровня
5.
Ответы:1. В
2. Д
3. А
4. Г
5. Е
6. Б
6.
Тема урока «Фосфор»7.
Цели урока:• Дать характеристику химическому
элементу фосфор;
• Изучить свойства фосфора как простого
вещества;
• повторить зависимость свойств вещества от
его состава и строения;
8.
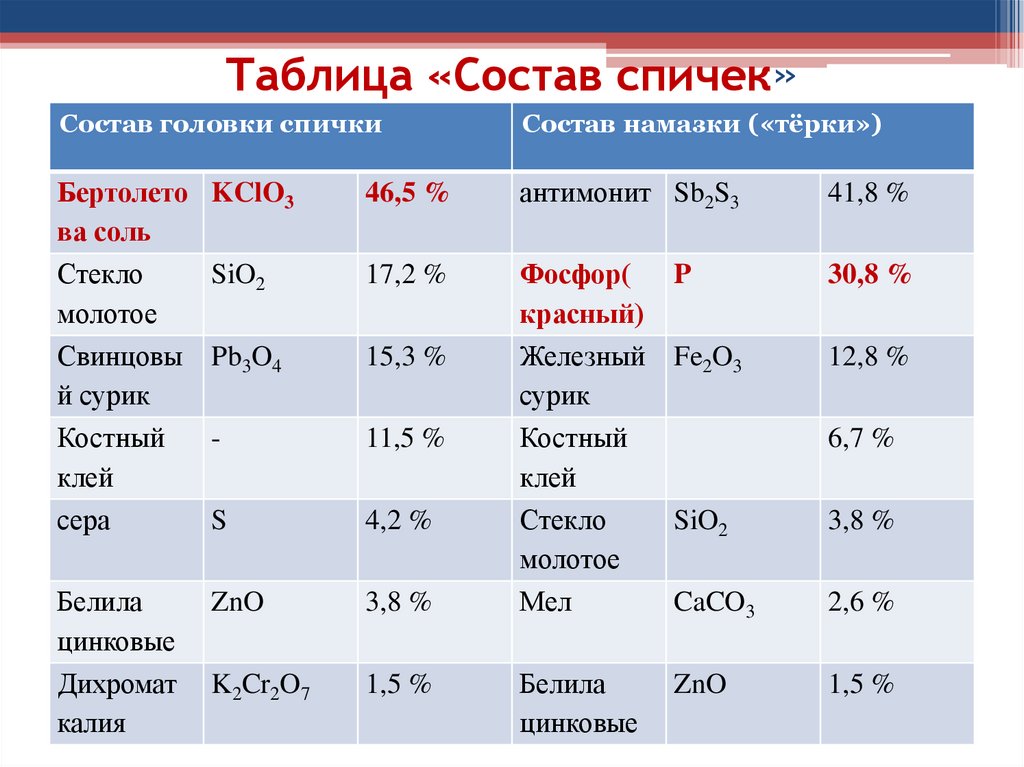
Таблица «Состав спичек»Состав головки спички
Состав намазки («тёрки»)
Бертолето
ва соль
Стекло
молотое
Свинцовы
й сурик
Костный
клей
сера
KClO3
46,5 %
антимонит Sb2S3
41,8 %
SiO2
17,2 %
P
30,8 %
Pb3O4
15,3 %
Fe2O3
12,8 %
-
11,5 %
S
4,2 %
Белила
цинковые
Дихромат
калия
ZnO
3,8 %
Фосфор(
красный)
Железный
сурик
Костный
клей
Стекло
молотое
Мел
K2Cr2O7
1,5 %
Белила
цинковые
6,7 %
SiO2
3,8 %
CaCO3
2,6 %
ZnO
1,5 %
9.
Тема:«История
возникновения
спички»
10.
Спичка• Чем же спичка
является сегодня?
Спичка — палочка
(черенок, соломка)
из горючего
материала,
снабжённая на конце
зажигательной
головкой, служащая
для получения
открытого огня.
11.
История• в Древней Греции добывали огонь фокусируя
солнечные лучи при помощи линзы или
вогнутого зеркала
• 1823 год – немецкий химик Иоганн Вольфганг
Деберейнер (1780 - 1849) изобрел первое
"химическое огниво".
• середина XIX века 1831 год – были изобретены
фосфорные спички. Изобретателем спичек
был девятнадцатилетний экспериментатор
Шарль Сориа.
12.
Иоганн ВольфгангДеберейнер
Шарль Сориа
13.
ИсторияНа смену фосфорным
пришли "маленькие спички",
изобретенные французским
химиком Гюставом
Шанселем (1822-1890).
Подобное приспособление
называлось "берлинская
зажигалка".
14.
Шведские спички• В 1855 году шведский
химик Йохан Лундстрем нанёс
красный фосфор на
поверхность наждачной
бумаги и заменил им же белый
фосфор в составе головки
спички. Такие спички уже не
приносили вреда здоровью,
легко зажигались о заранее
приготовленную поверхность
и практически не
самовоспламенялись. Йохан
Лундстрем патентует
первую «шведскую спичку»,
дошедшую практически до
наших дней. Позднее фосфор
был полностью выведен из
состава головок спичек и
оставался только в составе
намазки (тёрки).
15.
В 1867 г. от ожогов скончалась итальянская эрцгерцогиняМатильда, которая случайно наступила на спичку, – ее платье
было мгновенно охвачено пламенем. В те времена спички были
весьма опасны, так как зажигались они очень легко, а порой и
неожиданно, и в них содержался сильно ядовитый белый
фосфор.
16.
• Сесквисульфидные спички были изобретены в 1898году французскими химиками Савеном и Каеном.
Они производятся в основном в англоязычных
странах, главным образом для армейских нужд.
Основой довольно сложной композиции головки
являются неядовитый сесквисульфид фосфора
(P4S3) и бертолетова соль.
17.
Рекламные спички• Рекламные спички с
фирменной
символикой являются
сегодня необходимым
атрибутом для
ресторанов и т.д., а
также при
проведении выставок,
презентаций и других
торжественных
мероприятий.
18.
Сувенирные спички• сувенирные спички в
этом случае,
выполняют двоякую
роль, являясь
сувениром "на вынос"
с одной стороны, и в
то же время несут на
себе рекламную
информацию о вашей
компании, которая
находится постоянно
перед глазами
человека.
19.
Открытие фосфораГамбургский
алхимик
Хеннинг Бранд
1669 год
«Фосфор» от греческого
«светоносный»
20.
ФосфорЕсть фосфор белый, черный,
красный – три аллотропных
формы есть.
Вот белый: это яд опасный.
Слегка нагреешь – вспыхнет
весь.
Элемент был назван
«светоносным»
За то, что в полной темноте
Свет испускает белый фосфор,
В воздушной находясь среде.
Известен людям фосфор
красный,
Ведь спички зажигают все.
В составе смеси безопасной
Он есть на каждом коробке.
Запомним: в спичечной
головке
Смесь серы с солью Бертолле.
Мы чиркнем спичкой о
коробку,
И вмиг окажемся в тепле:
6P + 5KCLO3 = 3P2O5 + 5KCl.
В природе мы в свободном
виде,
Конечно, фосфор не найдем.
Можно извлечь из фосфорита
(Ca3(PO4)2)
Его химическим путем.
Фосфат и уголь измельчают,
Добавив кварцевый песок.
В печах смесь сильно
нагревают,
Используя электроток:
Ca3(PO4)2 + 5С + 3SiO2 =
3CaSiO3 + 2P + 5CO2
21.
Проект « Фосфор – неметалл»22.
Аллотропные модификации фосфораБелый
Красный
t без доступа
воздуха
Тпл =44,10 С, Ткип=275
оС, мягкое, бесцветное,
воскообразное вещество
хорошо растворимое в
сероуглероде и ряде
других органических
растворителях.
Ядовит,
воспламеняется на
воздухе, светится в
темноте.
Металлический
10
560 °C
500 °C
В атм. СО
P4
Черный
8,3·10 Па
220°С
108 Па
(P4)n
Красный кристаллический
или аморфный порошок, не
ядовит. Загорается на
воздухе только при
поджигании. t пл. = 240 °С
Ρ = 2400 кг/м³
Не светится
Растворяется только
в трибромиде фосфора
(P)n
t пл. = 1000 °С
Ρ = 2690 кг/м³
Не светится
Не растворяется в
сероуглероде
Проводит эл. ток
(P)n
Ρ = 3830 кг/м³
Не светится
Проводит эл.ток
23.
• “...Да! Это была собака, огромная, черная,как смоль... Ни в чьем воспаленном мозгу
не могло возникнуть видение более
страшное, более омерзительное, чем это
адское существо, выскочившее на нас из
тумана... Страшный пес, величиной с
молодую львицу. Его огромная пасть все
еще светилась голубоватым пламенем,
глубоко сидящие дикие глаза были
обведены огненными кругами. Я
дотронулся до этой светящейся головы и,
отняв руку, увидел, что мои пальцы тоже
засветились в темноте. Фосфор, – сказал я”.
24.
Из какого произведения этот отрывок? Вот в какойнеприятной истории оказался замешан элемент №15.
Но могло ли быть такое в действительности, имеет ли
фосфор такие свойства, прав ли был А.Конан-Дойл?
25.
Войска СШАиспользовали
фосфорные
Бомбы
в Ираке,
2004 г.
26.
Использование фосфорных бомб27.
Физиологическое действиебелого фосфора
Появление лягушек с
уродствами -результат
применения фосфорных
удобрений, которые
смываются в реки и пруды,
Фосфорный некроз
– поражение
челюстей
Результат применения
чрезмерного количества
фосфора
28.
Выполните тест• Уровень В
1.Фосфор проявляет низшую
степень окисления в
соединениях:
а) P2O5; б) Ca3P2; в)
Na3PO4.
2. Какой вид фосфора
отвечает формуле P4
а) белый, б) красный, в)
чёрный.
3. В реакции 4P+5O2=
2P2O5 восстановителем
является:
а) P2O5; б) O2; в) P.
5.Восстановительные
свойства сильнее выражены
у:
а) Cl; б) P; в) N.
• Уровень А
• 1.Определите степень
окисления фосфора в
соединении Mg3P2
• 2. У фосфора…..
аллотропных модификаций
• а)две б)три в) четыре г) пять
• 3. У фосфора…..
аллотропных модификаций
• а)две б)три в) четыре г) пять
• 4. Причина свечения белого
фосфора….
• а)изменение агрегатного
состояния вещества
• б) химическое явление в)
физическое явление
• 5. В состав спичек входит:
а)Р красный б) Р белый в) Р
черный
29.
Домашнее заданиеУровень А.
1) § 27, упр. №
Уровень В
1) § 27
2) составить характеристику химического
элемента ФОСФОРА
3) Рассмотреть реакцию 6P + 5KCLO3 = 3P2O5
+ 5KCl. с точки зрения ОВР
30.
РЕФЛЕКСИЯ1.Какое значение для тебя имеют знания и
умения, полученные на уроке: □.Важны ;О. Очень
важны; ∆.Не важны.
2.Как ты оцениваешь знания, полученные
сегодня ? Δ.Неосознанные; □.Осознанные; О Глубокие
3. С каким настроением ты изучал этот материал?
∆. Неинтересно; □.Не очень; О. Интересно.
4. Как оцениваешь свою деятельность?
Δ.Удовлетворит.; □. Хорошо; О. Отлично.
5. Как оцениваешь деятельность партнера, группы? ∆.
Удовлетворит.; □.Хорошо; О. Отлично





























 Химия
Химия








