Похожие презентации:
Генетика микроорганизмов. Строение генома бактерий
1. Генетика микроорганизмов
ФГБОУ ВО Тюменский государственный медицинскийуниверситет
Кафедра микробиологии
Генетика микроорганизмов
Лекция № 7
2. План
1. Строение генома бактерий2. Подвижные генетические элементы
3. Виды изменчивости бактерий
4. Генная инженерия
5. Практическое применение генетики
микроорганизмов
6. Генетические основы микробной
резистентности
3. Строение генома бактерий
Генетический аппарат бактерий представленодной двухцепочечной молекулой ДНК,
которая отождествляется одной замкнутой
кольцевой хромосоме.
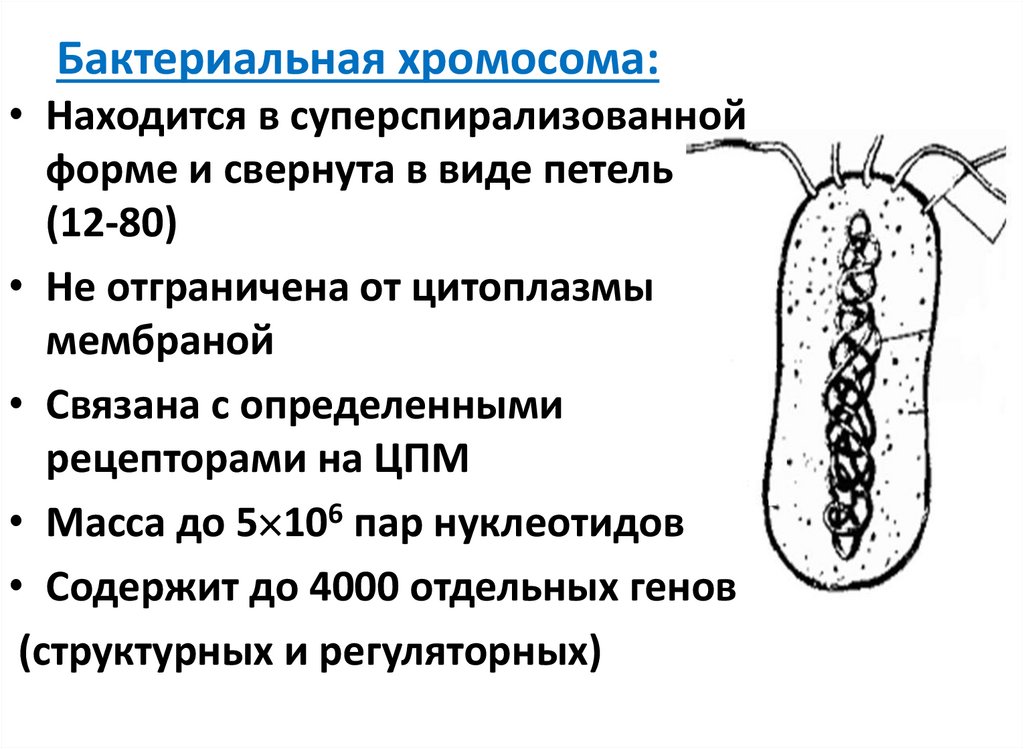
4. Бактериальная хромосома:
• Находится в суперспирализованнойформе и свернута в виде петель
(12-80)
• Не отграничена от цитоплазмы
мембраной
• Связана с определенными
рецепторами на ЦПМ
• Масса до 5 106 пар нуклеотидов
• Cодержит до 4000 отдельных генов
(структурных и регуляторных)
5.
Ген – фрагмент молекулы ДНК, контролирующийсинтез одного белка или пептида
Генотип - cовокупность всех генов, присущих
данному организму: структурных (цистронов) и
регуляторных
Фенотип - совокупность реализованных у
организма генетически детерминированных
признаков
6.
• Воспроизведение генетическогоматериала бактерий осуществляется в
процессе репликации, которая протекает
у них по полуконсервативному
механизму:
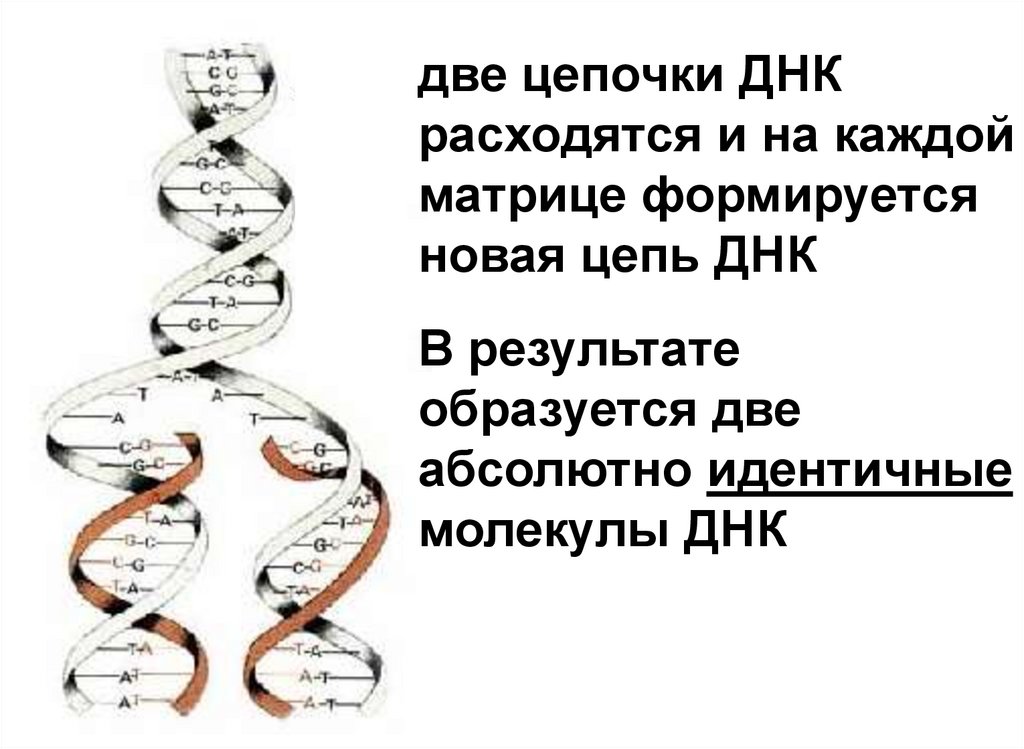
7.
две цепочки ДНКрасходятся и на каждой
матрице формируется
новая цепь ДНК
В результате
образуется две
абсолютно идентичные
молекулы ДНК
8. Транскрипция генетического материала
• Хромосома бактерий состоит из особых функциональныхединиц – оперонов. Оперон – это единица транскрипции.
1 оперон кодирует синтез 1 молекулы иРНК. Состоит из
промотора, оператора, структурных генов и терминатора.
• Промотор определяет начало транскрипции (участок
инициации). С промотором соединяется фермент РНКполимераза, осуществляющий синтез мРНК.
• Далее располагается оператор (О). С ним может
связываться регуляторный белок-репрессор. Репрессор
блокирует промотор и тем самым предотвращает
транскрипцию гена.
• За оператором следуют структурные гены для синтеза
ферментов. Заканчивается оперон терминатором,
прекращающим продвижение РНК-полимеразы и
транскрипцию оперона.
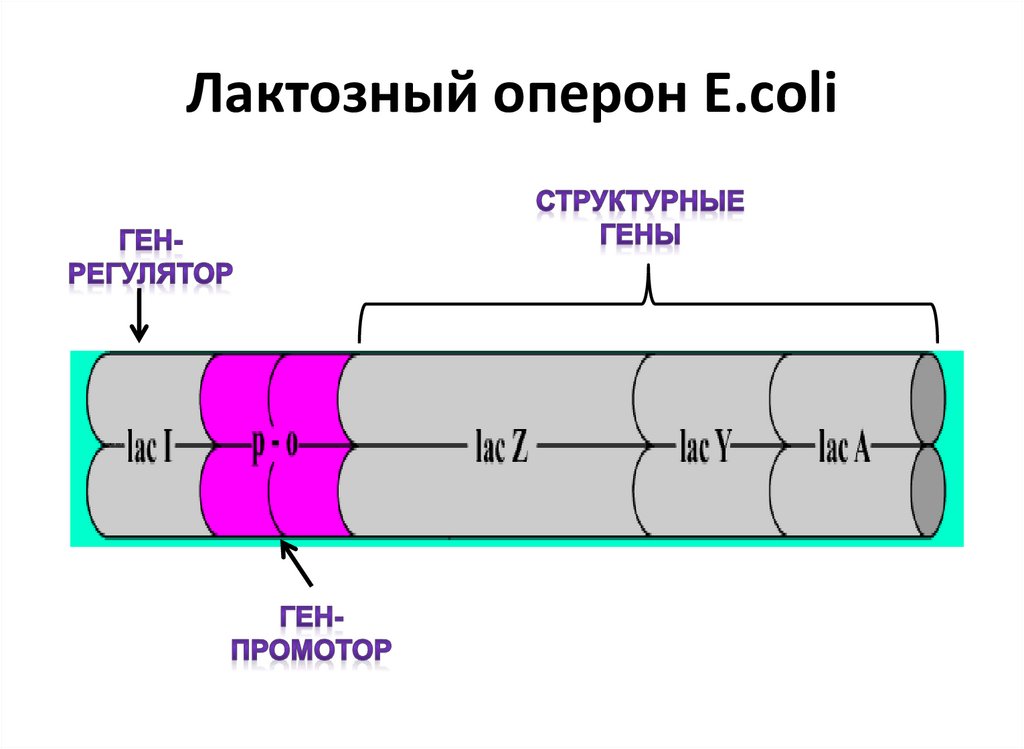
9. Лактозный оперон Е.сoli
10. Регуляция выражения генетической информации у бактерий
• Опероны, кодирующие синтез индуцибельных ирепрессируемых ферментов, функционируют не
постоянно, а в соответствии с потребностями клетки
• Опероны, отвечающие за синтез конститутивных
ферментов, работают регулярно (не содержат
активно действующего оператора)
11.
В отсутствие лактозы белок-репрессор связывается соператорным участком и препятствует продвижению по ДНК
РНК-полимеразы: не синтезируется мРНК, не синтезируются и
ферменты. После добавления в среду лактозы белокрепрессор связывается с нею быстрее, чем с операторным
участком. В результате последний остается свободным и не
препятствует
продвижению
РНК-полимеразы.
Идет
транскрипция и трансляция. Синтезирующиеся ферменты
осуществляют транспорт в клетку и расщепление лактозы.
После того как вся лактоза будет израсходована, нечем станет
связывать белок-репрессор и он снова свяжется с оператором,
прекратив транскрипцию оперона. Таким образом, индукция
оперона вызывается тем, что регуляторный белок не
прикрепляется к оператору. Такой тип индукции называется
негативным.
12.
• Параллельно наблюдается и другой тип регуляции —позитивная регуляция. При глюкозном голодании в клетке
из АТФ образуется сигнальное вещество цАМФ, которое
связывается с белком-активатором (САР), после чего
последний приобретает способность связывать ДНК в
промоторной области и усиливать транскрипцию
лактозного оперона. Таким образом, когда не хватает
глюкозы, стимулируется всасывание и катаболизм лактозы.
При одновременном присутствии глюкозы и лактозы
последняя не метаболизируется, пока существенно не
упадёт концентрация глюкозы.
13.
есть глюкоза и нет лактозынет глюкозы и нет лактозы
есть глюкоза и есть лактоза
нет глюкозы и есть лактоза
14.
Если в клетке концентрация глюкозы достаточна дляподдержания метаболизма, активация лактозного оперона не
происходит. Промоторная последовательность лактозного
оперона «слабая», поэтому даже при отсутствии белкарепрессора на операторном участке транскрипция практически
не инициируется. Когда концентрация глюкозы в клетке
снижается, происходит активация фермента аденилатциклазы,
которая катализирует превращение АТФ в циклическую форму —
цАМФ (в данном случае его называют «сигналом клеточного
голода»). цАМФ соединяется с белком, активирующим
катаболизм (САР, catabolism activating protein), при этом
образуется комплекс, который взаимодействует с промотором
лактозного оперона, изменяет его конформацию и приводит к
повышению сродства РНК-полимеразы к данному участку. В
присутствии лактозы происходит экспрессия генов оперона.
Белок CAP оказывает положительный контроль на лактозный
оперон.
15.
Ферменты для усвоения лактозы синтезируются в клеткекишечной палочки при двух условиях: 1) наличие лактозы; 2)
отсутствие глюкозы. Регуляция работы лактозного оперона в
зависимости от концентрации лактозы происходит по
принципу отрицательной обратной связи: чем больше
лактозы — тем больше ферментов для её катаболизма
(положительная прямая связь); чем больше ферментов — тем
меньше лактозы, чем меньше лактозы — тем меньше
производится ферментов (двойная отрицательная обратная
связь).
Биологический смысл
Благодаря описанному механизму регуляции транскрипции
генов, входящих в состав лактозного оперона, бактерии
оптимизируют энергетические затраты, синтезируя ферменты
метаболизма лактозы не постоянно, а лишь тогда, когда клетке
это необходимо. Сходный механизм регуляции имеется у
большинства бактерий.
16. Подвижные генетические элементы
• Транспозоныпенициллиназы
• IS-элементы
17. Характеристика транспозонов и IS-элементов
• Входят в состав генома бактерий• Функционируют только вместе с хромосомой
• Способны перемещаться в различные
участки хромосомы, переходить из
хромосомы в плазмиду и обратно
• Генетическая информация, содержащаяся в
них, не обязательна для жизнедеятельности
бактерии
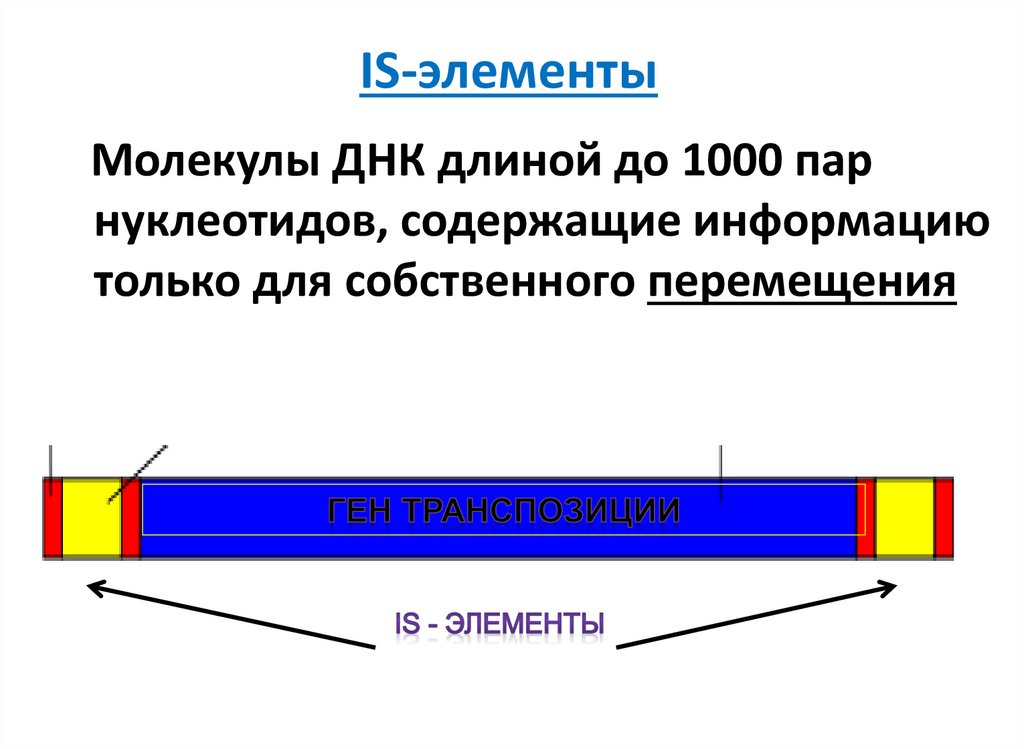
18. IS-элементы
Молекулы ДНК длиной до 1000 парнуклеотидов, содержащие информацию
только для собственного перемещения
19. Функции IS-элементов:
1. Координация взаимодействиятранспозонов, бактериофагов, плазмид
между собой и с бактериальной
хромосомой
2. Инициация транскрипции или
«выключение» генов, в которые
произошло встраивание этого элемента
3. Индукция мутаций
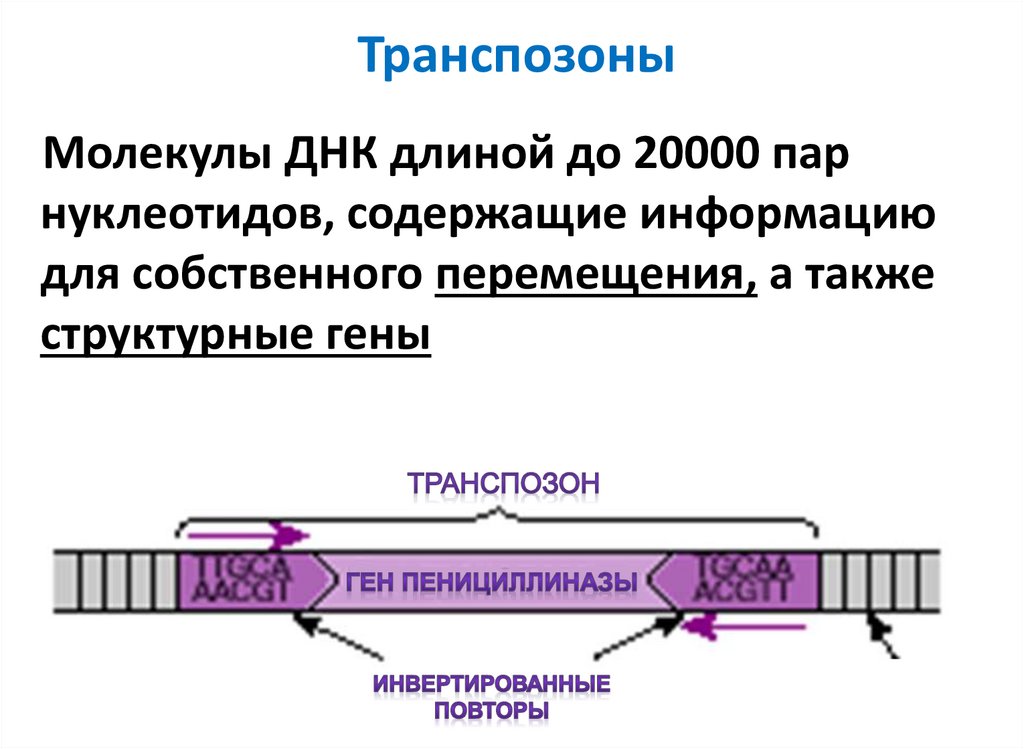
20. Транспозоны
Молекулы ДНК длиной до 20000 парнуклеотидов, содержащие информацию
для собственного перемещения, а также
структурные гены
21. Транспозоны кодируют:
1. Синтез токсинов2. Синтез ферментов, расщепляющих
углеводы
3. Синтез ферментов, разрушающих
антибиотики, что приводит к
формированию госпитальных
штаммов микробов в условиях
стационаров.
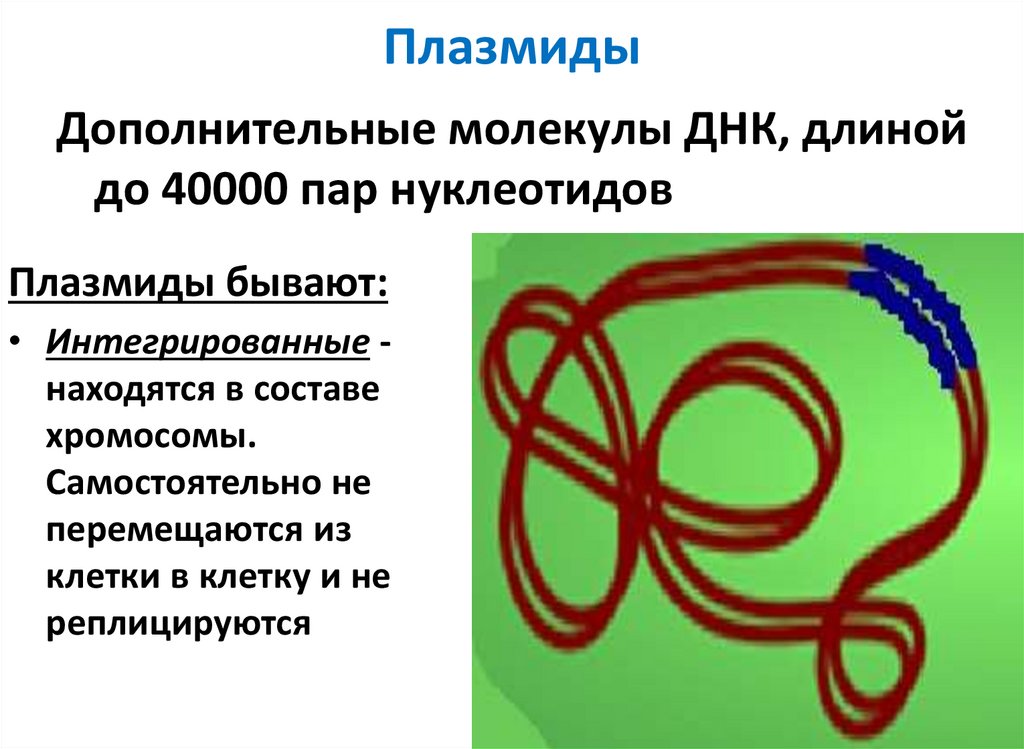
22. Плазмиды
Дополнительные молекулы ДНК, длинойдо 40000 пар нуклеотидов
Плазмиды бывают:
• Интегрированные находятся в составе
хромосомы.
Самостоятельно не
перемещаются из
клетки в клетку и не
реплицируются
23.
• Конъюгативные (трансмиссивные)находятся отдельно от хромосомы.
Способны к автономной репликации и к
перемещению из одной клетки в другую
24. Плазмида при электронной микроскопии
25.
Плазмиды распространяются средибактерий двумя способами:
1. По вертикали – от материнской к
дочерней в процессе клеточного деления
2. По горизонтали – между взрослыми
особями при трансформации, трансдукции
и конъюгации
26. Функции плазмид
1. Регуляторная – компенсацияметаболических дефектов бактерии
2. Кодирующая – внесение в бактерию
информации о новых признаках
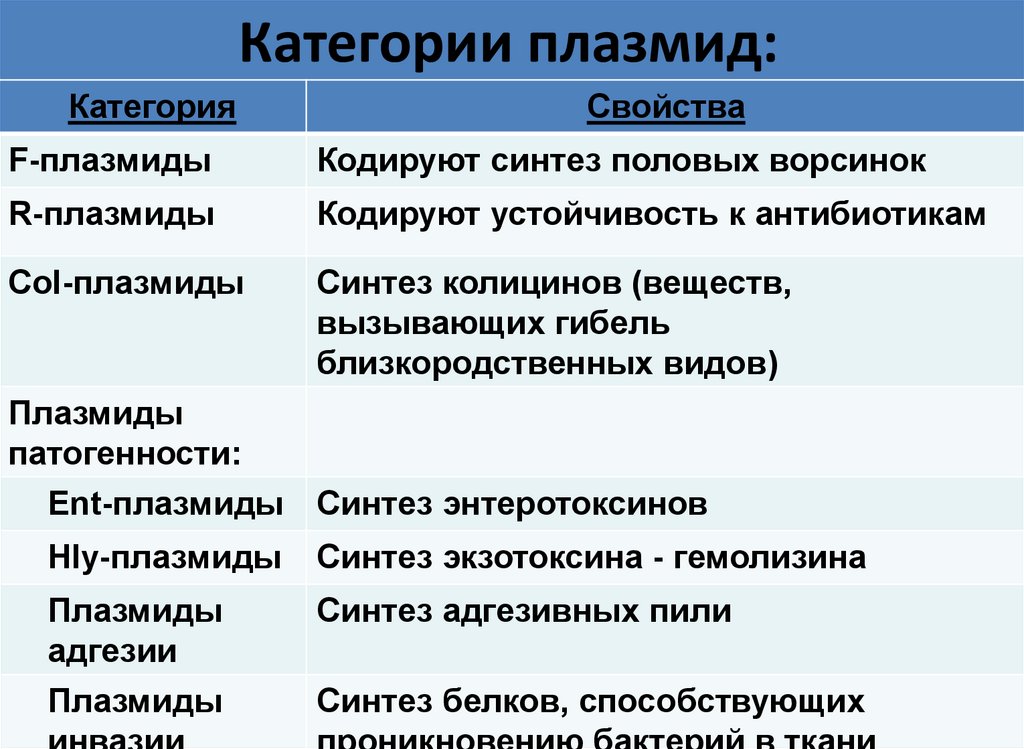
27. Категории плазмид:
КатегорияСвойства
F-плазмиды
Кодируют синтез половых ворсинок
R-плазмиды
Кодируют устойчивость к антибиотикам
Col-плазмиды
Синтез колицинов (веществ,
вызывающих гибель
близкородственных видов)
Плазмиды
патогенности:
Ent-плазмиды Синтез энтеротоксинов
Hly-плазмиды
Синтез экзотоксина - гемолизина
Плазмиды
адгезии
Синтез адгезивных пили
Плазмиды
Синтез белков, способствующих
28.
Совокупность плазмид, входящихв состав 1 бактериальной клетки,
называется плазмотипом
29. Островки патогенности - это
разновидность генетических островков, содержащих отодного до нескольких десятков генов, кодирующих факторы
патогенности,
и
способных
к
одновременной
горизонтальной внутривидовой и межвидовой передаче.
Островки патогенности присутствуют только у вирулентных
микроорганизмов в составе плазмид или бактериальной
хромосомы, и отсутствуют у непатогенных штаммов того же
или близкородственных видов;
в состав входят мобильные элементы (IS элементы,
транспозоны, фаги), а на концах находятся прямые повторы.
Прямые повторы распознаются ферментами, вырезающими
островки патогенности;
содержат гены «подвижности» (интегразу, транспозазу,
участки инициации считывания);
30.
имеют мозаичное строение: их участки приобретены вразное время и от разных хозяев;
непостоянны и могут быть утеряны. Например,
кодирующий продукцию токсина токсического шока (TSST-1)
островок патогенности у золотистого стафилококка с
большой частотой вырезается бактериофагами;
ОП могут содержать гены, детерминирующие признаки
устойчивости к антибиотикам, адгезины, экзо- и
эндотоксины, суперантигены, сидерофоры, секреторные
системы;
играют роль в эволюции бактериальных патогенов.
31. Виды изменчивости бактерий
32.
Фенотипическая изменчивость (модификации) –временные, наследственно не закрепленные
изменения, возникающие в ответ на изменение
условий окружающей среды
Пример:
при
неблагоприятных
условиях
(применение
антибиотиков)
м/о
способны
переходить в L-формы, устойчивые к антибиотикам,
в результате - рецидив болезни.
33. Характеристика фенотипической изменчивости
• Возникает на уровне фенотипа, не затрагиваяклеточный генотип
• Проявляется в изменении морфологических,
биохимических и культуральных свойств
• Сохраняется временно и исчезает после
устранения
фактора,
вызвавшего
её
образование
34.
Генотипическая изменчивость бактерийвозникает на уровне генотипа и
передается из поколения в поколение
Мутации скачкообразные
изменения
в
генетическом
материале клетки, приводящие к
появлению новых признаков
35.
КЛАССИФИКАЦИЯ МУТАЦИЙ:• Спонтанные, т.е. возникающие самопроизвольно, без какого-либо воздействия.
• Индуцированные,
возникающие
под
действием мутагенов.
36.
Мутагены:• физические (УФ-лучи, ионизирующая
радиация);
• химические (антисептики,
дезинфектанты);
• биологические (транспозоны, ISэлементы, плазмиды).
37.
• Точковые мутации• Хромосомные мутации: (делеции, инверсии,
дупликации)
• Прямые (потеря или изменение признака)
• Обратные (восстановление признака)
38.
Проявления спонтанных мутаций:• ошибки репликации ДНК
• неправильное формирование
комплементарных пар оснований
• структурные искажения ДНК
39. Диссоциации
• Своеобразной формой мутационной изменчивостиявляется R-S диссоциация бактерий. Она возникает
спонтанно вследствие образования двух форм
бактериальных клеток, которые отличаются друг от
друга по характеру образуемых ими колоний на
твердой питательной среде.
• Мутации, которые приводят к S-R-диссоциации,
относятся к инсертационным, поскольку они
возникают после встраивания в ДНК внехромосомных
факторов наследственности - умеренных фагов, либо
утери неконъюгативных крупных плазмид.
40. Диссоциации
• Биологическоезначение
S-R-диссоциации
приобретение бактериями определенных селективных
преимуществ,
обеспечивающих
их
существование в организме человека или во внешней
среде. К ним относится более высокая устойчивость Sформ к фагоцитозу макрофагами, бактерицидному
действию сыворотки крови. R-формы обладают
большей устойчивостью к факторам окружающей
среды. Они более длительное время сохраняются в
воде, молоке.
• Практическое значение. S-R-диссоциация усложняет
бактериологическую диагностику ряда инфекционных заболеваний, например, дизентерии Зонне,
эшерихиоза, вызванного E. coli О124 и др.
41.
Генетические рекомбинации этонаследственная
изменчивость,
возникающая в результате переноса
части генетического материла из клетки
донора в клетку реципиента по
горизонтали.
В результате возникает неполная
зигота – мерозигота (имеет генотип
реципиента, приобретая отдельные
свойства клетки-донора)
42.
Генетические рекомбинации:1. Трансформация
2. Трансдукция
3. Конъюгация
43. При генетических рекомбинациях передается:
• Способность к синтезу токсинов,капсульных полисахаридов,
аминокислот
• Антибиотикорезистентность
• Способность ферментировать
различные углеводы и белки
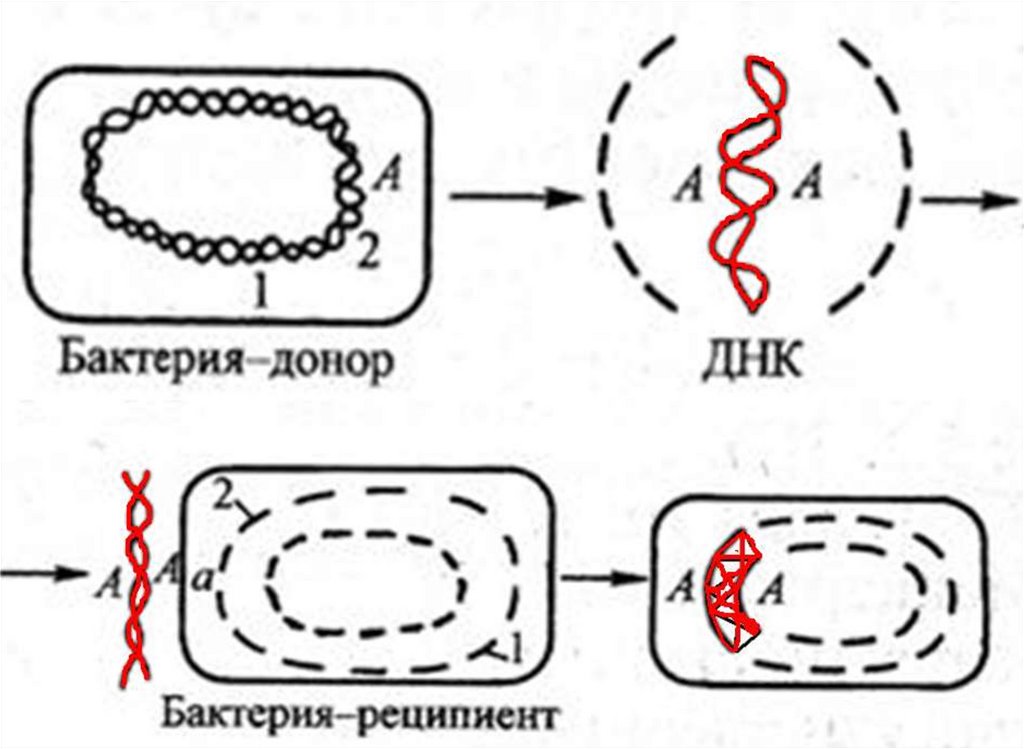
44. Трансформация
Перенос части генома донора в клеткуреципиента без их непосредственного
контакта.
Источником ДНК может быть любая убитая
культура м/о, но включаться в геном способна
только гомологичная ДНК, поэтому чаще
встречается внутривидовая трансформация.
45.
Этапы трансформации:1. Адсорбция ДНК-донора на клеткереципиенте.
2. Ферментативное расщепление ДНК донора на
мелкие фрагменты.
3. Проникновение в клетку фрагмента ДНК.
4. Встраивание фрагмента в геном реципиента.
5. Экспрессия – интенсивное размножение
трансформированных клеток.
46.
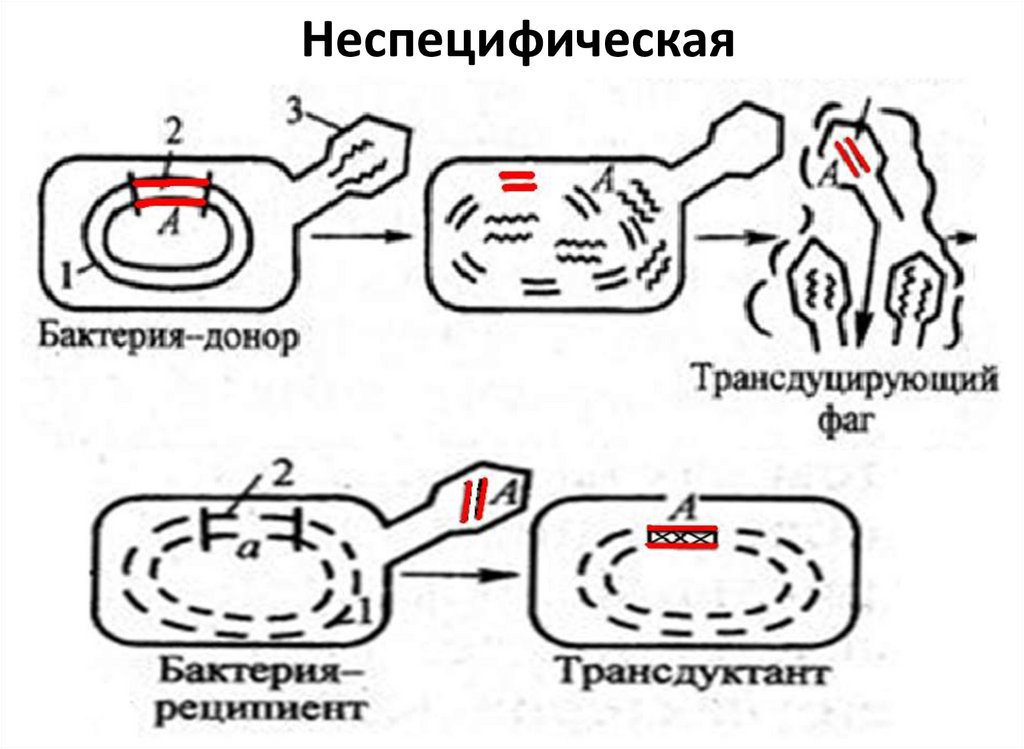
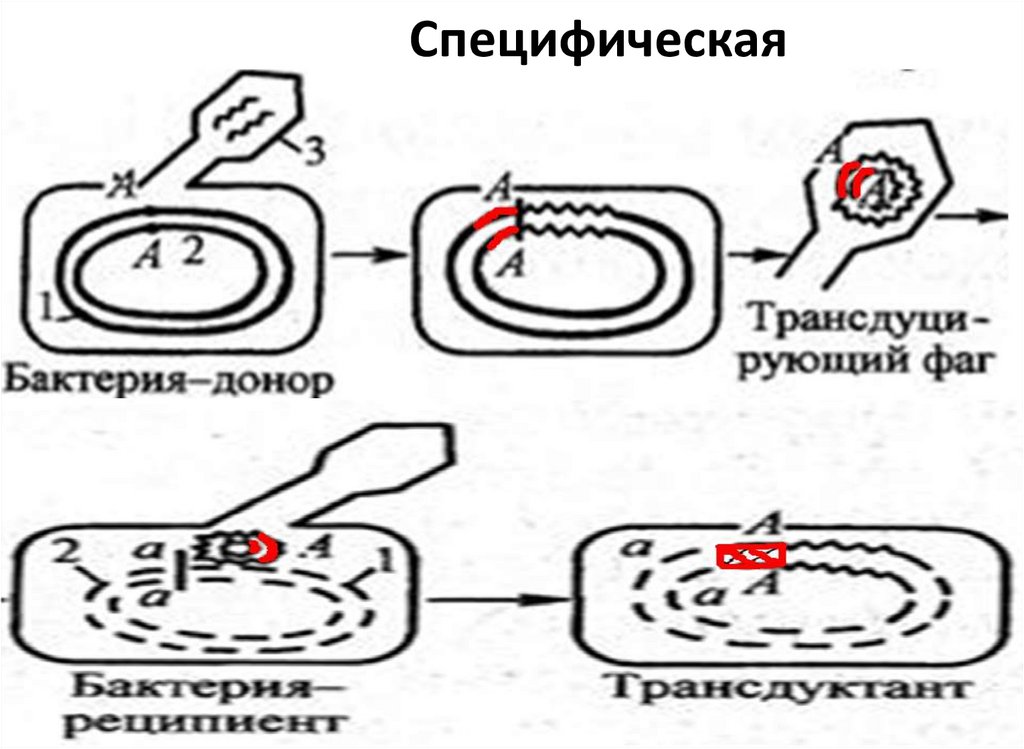
47. Трансдукция
Передача участка бактериальнойпосредством бактериофага.
ДНК
В процессе репликации фага внутри
бактерий фрагмент бактериальной ДНК
проникает в фаговую частицу и переносится
вместе с ней в бактерию-реципиент.
48. Неспецифическая
49. Специфическая
50. 3 типа трансдукции:
• Общая (неспецифическая) трансдукция - переносвирулентным фагом фрагмента любой части
бактериальной хромосомы. Б/ф только переносчик
генетического материала.
• Специфическая трансдукция - перенос умеренным
фагом фрагмента хромосомы, находящегося рядом с
ним. Б/ф также встраивается в ДНК донора, и клетка
становится лизогенной, т.е. не чувствительной к
гомологичному вирулентному б/ф.
• Абортивная трансдукция - внесенный фрагмент ДНК
донора не встраивается в хромосому реципиента, а
остается в цитоплазме и там самостоятельно
функционирует, в конечном счете утрачивается в
потомстве.
51. Конъюгация
Перенос части генетического материала путемпрямого контакта между двумя клетками.
Необходимым условием конъюгации является
наличие в клетке-доноре трансмиссивной
плазмиды (F-плазмиды). Трансмиссивные
плазмиды
кодируют
половые
пили,
образующие конъюгационный мостик между
клеткой-донором и клеткой-реципиентом.
52. Этапы конъюгации:
• прикрепление конца половой ворсинки креципиентной клетке;
• образование между клетками
цитоплазматического мостика;
• передача плазмид, находящихся в
автономном состоянии (F-, R-, Col-, Tox- и
других).
53.
Если F-плазмида находится в клетке винтегрированном
состоянии,
то
при
конъюгации она не передается, но
определяет точку разрыва хромосомы и тот
её
участок,
который
переходит
в
реципиентную клетку.
54. Конъюгация при свободной F-плазмиде
55. Конъюгация при интегрированной F-плазмиде
56. Особенности генетики вирусов
Особенность строения вирусного генома заключается втом, что наследственная информация может быть
записана как на ДНК, так и на РНК в зависимости от типа
вируса.
Мутации у вирусов могут возникать спонтанно в
процессе репликации нуклеиновой кислоты вируса, а
также под влиянием тех же внешних факторов и
мутагенов, что и у бактерий.
Фенотипически мутации вирусного генома проявляются
изменениями антигенной структуры, неспособностью
вызывать продуктивную инфекцию в чувствительной
клетке, чувствительностью продуктивного цикла к
температуре, а также изменением формы и размера
бляшек, которые образуют вирусы в культуре клеток.
57.
Свойства вирусов могут изменяться при одновременномзаражении несколькими вирусами чувствительной
клетки, причем изменения свойств при таких условиях
могут происходить в результате как обмена между
материалами нуклеиновых кислот, принадлежащих
разным вирусам (генетическая рекомбинация и
генетическая реактивация), так и процессов, не
сопровождающихся обменом генетического материала
(комплементация и фенотипическое смешивание).
58.
Генетическая рекомбинация встречается чаще у ДНКсодержащих вирусов. Среди РНК-содержащих вирусовона наблюдается у тех из них, которые обладают
фрагментированным геномом, например у вируса
гриппа. При рекомбинации происходит обмен между
гомологичными участками генома.
Генетическая реактивация наблюдается между
геномами родственных вирусов, имеющих мутации в
разных генах. В результате перераспределения
генетического материала формируется полноценный
дочерний геном.
59.
Комплементация встречается в том случае, когдаодин из двух вирусов, инфицирующих клетку, в
результате мутации синтезирует нефункциональный
белок. Немутантный вирус, синтезируя полноценный
белок, восполняет его отсутствие у мутантного вируса.
Фенотипическое смешивание наблюдается в том
случае,
если
при
смешанном
заражении
чувствительной клетки двумя вирусами часть
потомства приобретает фенотипические признаки,
присущие
двум
вирусам,
при
сохранении
неизменности генотипа.
60. Генная инженерия (основы и практическое применение)
Биотехнологический процесс, цель которогополучение живых организмов с заранее
известными наследственными свойствами, не
характерными ранее для
этих организмов
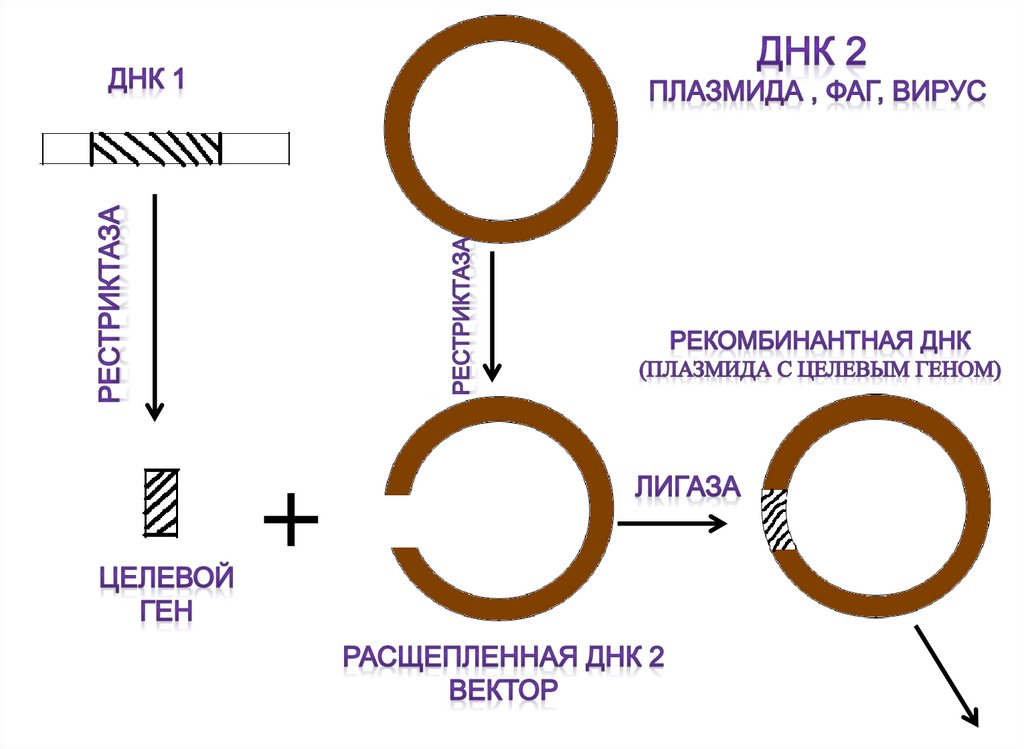
61. Получение рекомбинантных штаммов методом генной инженерии:
1. Выделениеучастка ДНК из
разных
организмов с
помощью
фермента
рестриктазы
62.
2. Получение рекомбинантных молекул ДНК спомощью вектора и ферментов (лигазы)
63.
3. Введение рекомбинантной молекулы вреципиентные клетки
В качестве реципиентов
используются:
• кишечные палочки
• бациллы
• псевдомонады
• дрожжи
• вирусы
64.
4. Создание условийдля размножения
рекомбинантных
штаммов и секреции
продуктов, кодируемых
встроенными генами
65. Вектор – молекула ДНК, способная переносить в клетку любую чужеродную ДНК и обеспечивать её умножение
Характеристика вектора:• способность к автономной
репликации;
• наличие 1 или 2 участков (сайтов) для
различных рестриктаз;
• наличие 1 или нескольких маркерных
генов, за счет чего у клеткиреципиента появляются новые
признаки.
66.
В качестве вектораиспользуются:
• плазмиды
• бактериофаги
• вирусы
• космиды (гибрид
бактериофага и плазмиды)
67.
68. В результате мы получаем клетку с рекомбинантной ДНК и с заранее известными наследственными свойствами
69. Препараты, полученные методом генной инженерии
Рекомбинантныештаммы
E. coli
Дрожжи
Препараты
α-интерферон (из 1 л - 100-150 доз)
Соматотропин (из 1 л – 100 мг гормона)
Инсулин
Интерлейкины 1,2,3
Ds-кумы (антигены ВИЧ)
Фактор роста фибробластов
Фактор некроза опухолей
Фактор свертывания крови ( VII и IX)
Фактор роста В- лимфоцитов
Вакцина против гепатита В (Энджерикс В)
Ds-кумы (антигены ВИЧ)
Псевдомонады α - интерферон
70.
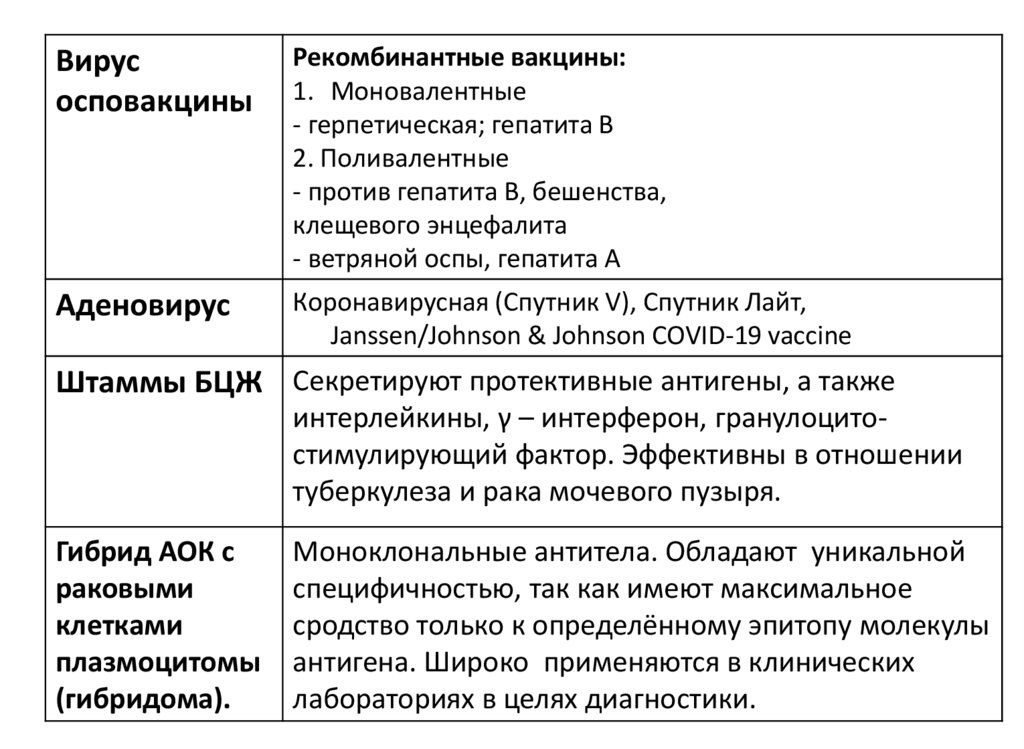
Вирусосповакцины
Рекомбинантные вакцины:
1. Моновалентные
- герпетическая; гепатита В
2. Поливалентные
- против гепатита В, бешенства,
клещевого энцефалита
- ветряной оспы, гепатита А
Аденовирус
Коронавирусная (Спутник V), Спутник Лайт,
Janssen/Johnson & Johnson COVID-19 vaccine
Штаммы БЦЖ Секретируют протективные антигены, а также
интерлейкины, γ – интерферон, гранулоцитостимулирующий фактор. Эффективны в отношении
туберкулеза и рака мочевого пузыря.
Гибрид АОК с
раковыми
клетками
плазмоцитомы
(гибридома).
Моноклональные антитела. Обладают уникальной
специфичностью, так как имеют максимальное
сродство только к определённому эпитопу молекулы
антигена. Широко применяются в клинических
лабораториях в целях диагностики.
71.
Линия миеломных клеток, которую объединяли с В-лимфоцитом, врезультате чего получали гибридому. От В-лимфоцита гибридома получила
способность к синтезу антител определённой специфичности, от опухолевой
клетки-способность длительно размножаться. Таким образом гибридома
является постоянным источником антител.
На основе моноклональных антител создаются терапевтические препараты.
Например, МКА достаточно часто применяют для лечения опухолевых,
аутоиммунных и сердечно-сосудистых заболеваний.
МКА объединяют с токсином или радиоактивным веществом, которые
доставляются в опухолевые образования и метастазы. Это позволяет
обнаружить локализацию узелков опухоли. В медицине были разработаны
два вида препаратов моноклональных антител противоопухолевого
назначения. Неконъюгированные антитела ориентированы на определённый
рецептор на поверхности злокачественной клетки. Так, они активируют
процесс апоптоза. Конъюгированные антитела связаны с цитотоксическими
или
радиотоксическими
веществами,
что
позволяет
прицельно
воздействовать разрушающим агентом на злокачественные клетки. Таким
образом, МКА вызывают замедление опухолевого роста и регресс опухоли,
также антитела используются для профилактики рецидивов.
72.
Антицитокиновая терапия таких аутоиммунных заболеваний,как, например, ревматоидный артрит и псориаз, с
использованием препаратов на основе моноклональных
антител, избавляет человека от аутоагрессии некоторых
компонентов иммунной системы, сохраняя её активность. В то
же время, применение классической терапии при аутоиммунных
заболеваниях подавляет весь сложный механизм работы
иммунной системы. В результате организм человека не
способен противостоять бактериальным инфекциям, вирусам.
Антитела активно используются при лечении и
профилактике реакции «трансплантат против хозяина» при
аллогенной трансплантации клеток, органов и тканей. Они
блокируют рецептор, препятствуя связыванию интерлейкина-2
со специфическим рецептором, тем самым тормозят иммунный
ответ, направленный на отторжение трансплантата.
73.
Начиная с 2021 в практике лечения коронавируснойинфекции, вызванной вирусом COVID-19, использовали
препараты на основе МКА. Известно, что при
коронавирусной инфекции увеличивается образование
провоспалительных
цитокинов,
интерлейкина-6,
что
обуславливает избыточный воспалительный ответ и
выражается в полиорганной недостаточности. Препараты на
основе МКА выступают в качестве супрессивных
иммуномодуляторов и прицельно блокируют интерлейкин-6.
Терапевтическая ценность таких препаратов была доказана
на ранних стадиях заболевания. Использование МКА
позволило снизить количество летальных исходов, а также
уменьшить риск передачи инфекции.
74. Методы молекулярной биологии в диагностике заболеваний
Практическое применение генетическихметодов
75. Методы, используемые для внутривидовой идентификации бактерий
Рестрикционный анализ.Основан на применении
ферментов, носящих название рестриктаз. Рестриктазы
представляют собой эндонуклеазы, которые расщепляют
молекулы ДНК, разрывая фосфатные связи не в произвольных
местах, а в определенных последовательностях нуклеотидов.
В настоящее время из различных бактерий выделено и
очищено более 175 различных рестриктаз, для которых
известны сайты (участки) узнавания (рестрикции) - более 80
различных типов сайтов ДНК. В геноме конкретной
таксономической единицы находится строго определенное
(генетически
задетерминированное)
число
участков
узнавания для определенной рестриктазы.
76.
Если выделенную из конкретного микроба ДНК обработатьопределенной рестриктазой, то это приведет к образованию
строго
определенного
количества
фрагментов
ДНК
фиксированного размера. Размер каждого типа фрагментов
можно узнать с помощью электрофореза в агарозном геле:
мелкие фрагменты перемещаются в геле быстрее, чем более
крупные, и длина их пробега больше. Гель окрашивают
бромистым этидием и фотографируют в УФ-излучении. Таким
способом
можно
получить
рестрикционную
карту
определенного вида микробов.
Сопоставляя карты рестрикции ДНК, выделенных из различных
штаммов, можно определить их генетическое родство,
выявить принадлежность к определенному виду или роду, а
также обнаружить участки, подвергнутые мутациям. Этот метод
используется также как начальный этап метода определения
последовательности нуклеотидных пар (секвенирования) и
метода молекулярной гибридизации.
77.
Определение плазмидного профиля бактерий.Плазмидный
профиль
позволяет
произвести
внутривидовую идентификацию бактерий. Для
этого
из
бактериальной
клетки
выделяют
плазмидную
ДНК,
которую
разделяют
электрофорезом в агарозном геле для определения
количества и размеров плазмид.
78.
Риботипирование.Последовательность
нуклеотидных
оснований в оперонах, кодирующих рРНК, характеризуется
наличием как консервативных участков, которые подверглись
малым изменениям в процессе эволюции и имеют сходное
строения у различных бактерий, так и вариабельных
последовательностей, которые родо- и видо-специфичны и
являются маркерами при генетической идентификации. Эти
опероны представлены на бактериальной хромосоме в
нескольких копиях. Фрагменты ДНК, полученные после
обработки ее рестриктазами, содержат последовательности
генов рРНК, которые могут быть обнаружены методом
молекулярной
гибридизации
с
меченой
рРНК
соответствующего вида бактерий.
79.
Количество и локализация копий оперонов рРНК ирестрикционный состав сайтов как внутри рРНК-оперона,
так и по его флангам варьируют у различных видов
бактерий. На основе этого свойства построен метод
риботипирования, который позволяет производить
мониторинг выделенных штаммов и определение их
вида. В настоящее время риботипирование проводится в
автоматическом режиме в специальных приборах.
80. Методы, используемые для обнаружения микроба без выделения его в чистой культуре
Метод молекулярной гибридизации. позволяет выявитьстепень сходства различных ДНК. Применяется при
идентификации микробов для определения их точного
таксономического положения, а также для обнаружения
микроба в исследуемом материале без его выделения в
чистую культуру. Метод основан на способности
двухцепочечной ДНК при повышенной температуре (90 °С) в
щелочной среде денатурировать, т.е. расплетаться на две
нити, а при понижении температуры на 10 °С вновь
восстанавливать исходную двухцепочечную структуру. Метод
требует наличия молекулярного зонда.
• Зондом называется одноцепочечная молекула нуклеиновой
кислоты,
меченная
радиоактивными
нуклидами,
ферментом, флюорохромным красителем, с которой
сравнивают исследуемую ДНК.
81.
Для проведения молекулярной гибридизации исследуемуюДНК расплетают указанным выше способом, одну нить
фиксируют на специальном фильтре, который затем
помещают в раствор, содержащий зонд. Создаются условия,
благоприятные для образования двойных спиралей. При
наличии комплементарности между зондом и исследуемой
ДНК они образуют между собой двойную спираль, наличие
которой фиксируют методами в зависимости от типа метки
зонда: подсчетом радиоактивности, иммуноферментным
анализом (ИФА) или денситометрией.
82.
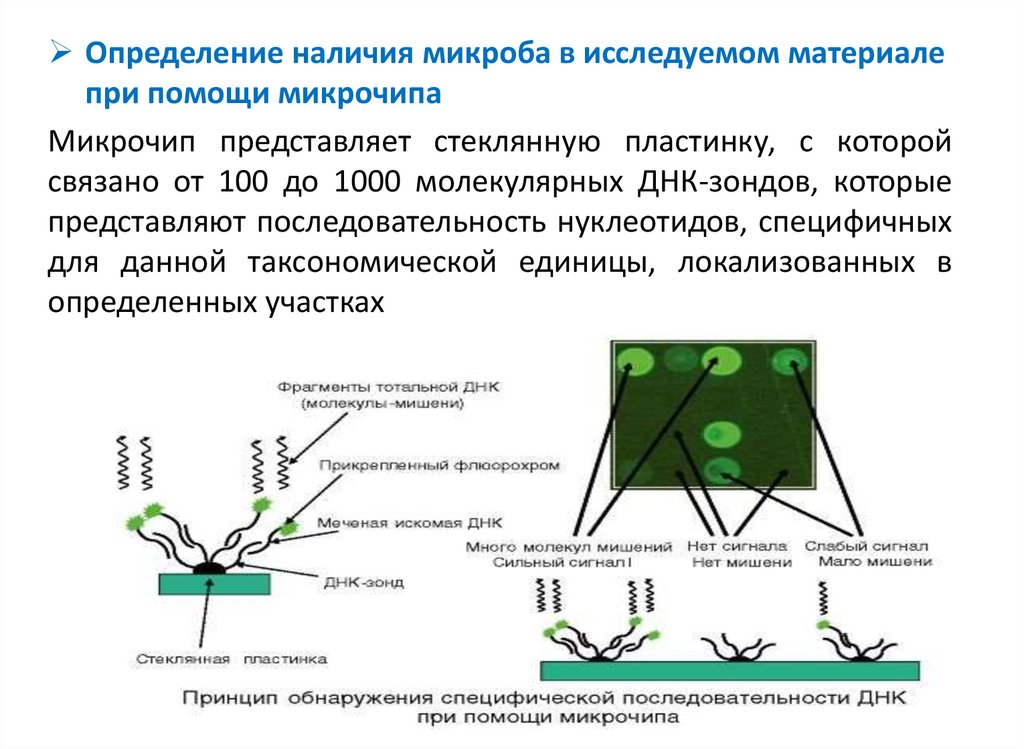
Определение наличия микроба в исследуемом материалепри помощи микрочипа
Микрочип представляет стеклянную пластинку, с которой
связано от 100 до 1000 молекулярных ДНК-зондов, которые
представляют последовательность нуклеотидов, специфичных
для данной таксономической единицы, локализованных в
определенных участках
83.
Из исследуемого образца выделяют общую ДНК,которую можно амплифицировать по стабильной
последовательности - 16S РНКгену. Выделенную ДНК
метят
флуорохромом
или
ферментом
и
обрабатывают ею микрочип, создавая условия для
гибридизации. Отмывают несвязавшуюся ДНК,
определяют локализацию молекулярных гибридов
постановкой ИФА или денситометрией.
84.
Полимеразная цепная реакция позволяет обнаружитьмикроб в исследуемом материале (воде, продуктах,
материале от больного) по наличию в нем ДНК микроба без
выделения последнего в чистую культуру. ПЦР применяют для
диагностики вирусных и бактериальных инфекций.
В ходе исследования пробирку с биоматериалом помещают в
особые условия, под воздействием которых молекулы
нуклеиновой кислоты (двухнитевая ДНК, присутствующая в
пробе или синтезированная из однонитевой РНК),
многократно копируются. Если в исследуемом образце было
хотя бы небольшое количество патогенных частиц, то через
несколько часов их число увеличится до десятков и даже
сотен миллионов. Это позволяет легко обнаружить
возбудителя инфекции или генетическую «поломку» при
очень низких рисках ложноотрицательного результата.
85.
Что нужно для ПЦР?• Для проведения полимеразной цепной реакции используется
специальный прибор —амплификатор. Он поддерживает
необходимую для каждого этапа температуру и проводит
циклы копирования ДНК —амплификацию. Когда молекул
становится достаточно для распознавания, оборудование
анализирует их, а затем выдает качественный или
количественный результат.
Пробирки с биоматериалом, подготовленным для ПЦР, в амплификаторе
86.
Компоненты для ПЦР:Целевая ДНК — частица ДНК искомого патогена. Она состоит из уникальной
последовательности нуклеотидов. Например, при ПЦР-анализе на герпес
целью служит та часть ДНК, которая отличает вирус герпеса от других вирусов.
Целевую ДНК также называют ДНК-матрицей.
Нити ДНК и РНК состоят из маленьких звеньев — нуклеотидов. Их
последовательность образует генетический код, несущий наследственную
информацию.
Два праймера — короткие нити из нуклеотидов, которые подходят к искомым
нитям ДНК, как детали пазла. На основе праймеров в ходе ПЦР создаются
новые ДНК-молекулы. Если праймеры не подошли, значит, целевого ДНК в
биоматериале нет.
ДНК-полимераза — фермент, который достраивает нить ДНК в ходе ПЦР.
Дезоксинуклеотидтрифосфаты (дНТФ) — смесь нуклеотидов, строительный
материал для копий ДНК-молекул.
Ионы магния (Mg2+) — поддерживают активность ДНК-полимеразы.
Буферный раствор — смесь, которая создаёт оптимальные условия для
биохимической реакции.
87. Этапы полимеразной цепной реакции
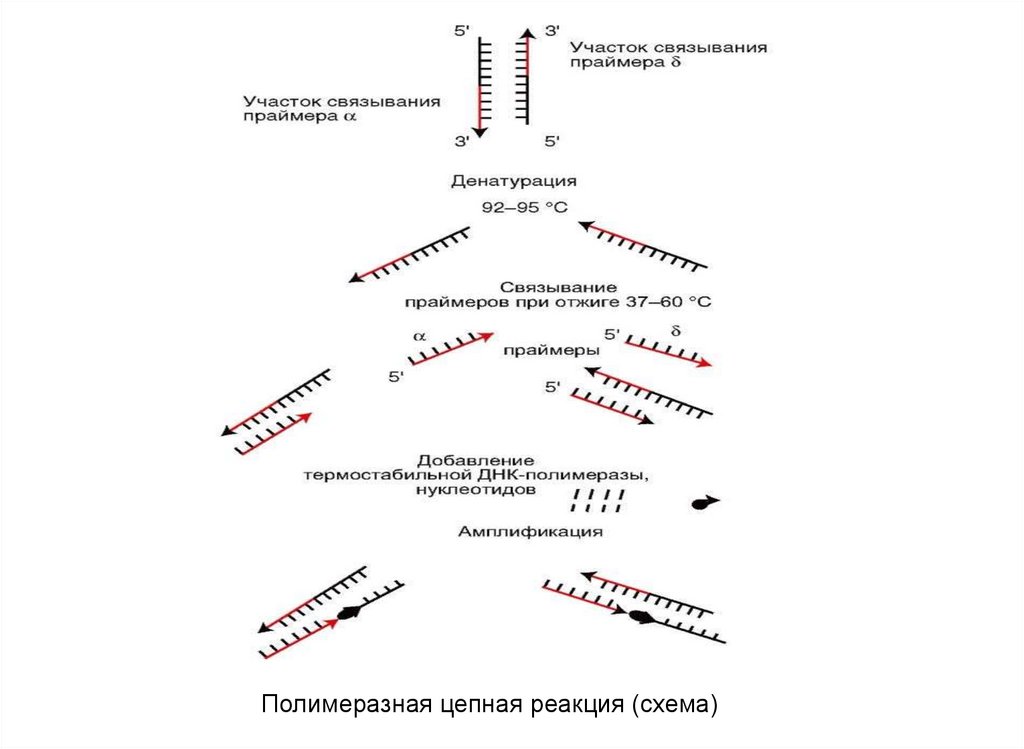
При проведении ПЦР выполняется 20—35 циклов копирования(амплификации), каждый из которых состоит из трёх стадий:
1. Сначала пробу нагревают до 94—96 °C, и все ДНК-молекулы,
которые есть в биоматериале, распадаются на две нити. Этот
процесс называется денатурацией.
Если генетический материал патогена — РНК, а не ДНК, то перед
денатурацией проводят ПЦР с обратной транскрипцией. Этот метод
позволяет превратить РНК в ДНК-молекулу.
2. Затем температуру снижают до 60-72 °C. Если в пробе есть целевая
ДНК, праймеры присоединяются к концам двух её нитей — так
происходит отжиг.
3. После отжига фермент ДНК-полимераза активируется и начинает
достраивать вторую нить ДНК, начиная от праймера. Для
восстановления цепи ДНК полимераза использует дНТФ.
Заключительный этап называют элонгацией.
88.
В соответствии с этим принципом ПЦР клинического образцавключает в себя три основных этапа:
пробоподготовка (выделение ДНК из клинического
материала),
циклы амплификации (умножения фрагментов ДНК). В
каждом цикле число копий амплифицируемого участка
удваивается, за 30-40 циклов происходит накопление
коротких специфических фрагментов в количестве,
достаточном для их дальнейшего распознавания.
Детекция продуктов амплификации осуществляется поразному: с помощью электрофореза в агарозном геле, или
путем гибридизации со специфическим олигонуклеотидным
зондом, или с использованием метода масс-спектрометрии и
т. д.
89.
ПЦР в реальном времени представляет ускоренныйметод ПЦР, при котором амплификацию и определение
продукта амплификации проводят одновременно. Для этой
цели в амплификационную пробирку вводят молекулярный
зонд, который в случае связывания с амплифицированной
цепью генерирует флюоресцентный сигнал определенной
длины волны. Реакцию проводят в автоматическом режиме.
90.
Полимеразная цепная реакция (схема)91. Молекулярно-генетические методы для диагностики при заболеваниях паро- и периодонта
• Лечение и реабилитация пациентов с воспалительнымизаболеваниями пародонта являются одной из наиболее
сложных
проблем
в
стоматологии,
что
находит
подтверждение в огромном количестве предложенных для
этих целей средств и методов, которые далеко не всегда
оказываются эффективными, и необходимости использования
лекарственных антимикробных препаратов избирательного
действия.
• Для
определения
вида
возбудителя,
назначения
эффективного
лечения
и
его
оценки
необходим
микробиологический анализ патологического материала.
Кроме того, с помощью микробиологической диагностики
врач сможет конкретизировать диагноз и составить прогноз
развития болезни.
92.
• Наиболееважными
показаниями
к
проведению
микробиологической диагностики являются такие заболевания
как:
острый язвенно-некротический гингивит
хронический пародонтит с частым рецидивированием и
абсцедированием
болезни паро- и периодонта, устойчивые к лечению
агрессивные формы болезней пародонта (препубертатный,
ювенильный
пародонтит,
быстропрогрессирующий
у
взрослых)
тяжелые формы патологии пародонта на фоне системных
заболеваний
комплексное лечение заболеваний пародонта с проведением
системной антимикробной терапии, в случаях сложного
протезирования или внутрикостной имплантации зубов,
связанных с большими финансовыми затратами.
93.
Длямикробиологической
диагностики
используют различные методы, которые имеют
преимущества и недостатки. Главное для врачастоматолога выбрать тот метод, который будет
отвечать его целям, экономическим и техническим
возможностям.
94.
95.
ПЦР очень широко используется для обнаружения иидентификации микробных возбудителей, в том числе и
пародонтопатогенных микроорганизмов, при этом метод
позволяет обнаружить возбудитель в биологическом
материале даже тогда, когда другие методы оказываются
неэффективными. Диагностическая эффективность ПЦР в этом
случае значительно возрастает при ее сочетании с
культуральным методом диагностики.
Помимо микроорганизмов, методом ПЦР можно
определять экспрессию генов, регулирующих образование
рецепторов или секреторных продуктов в клетке. В последнем
случае примером может служить обнаружение в остеокластах
альвеолярных отростков генов, регулирующих нарушенный
синтез коллагена I типа с образованием телопептидов, при
этом детекция соответствующих генов после амплификации
осуществляется путем ДНК-гибридизации.
96.
Для ПЦР сбор мягкого зубного налета производятметодом смыва из пародонтального кармана (в случае
патологии) или из десневой бороздки (в случае нормы) с
помощью стерильных бумажных эндодонтических штифтов.
Сбор твёрдого зубного налета производят следующим
образом. После предварительного полоскания ротовой
полости водой проводят обработку ватным тампоном зуба с
целью полного удаления мягкого налета и соскабливают
поддесневой твердый налет.
Исследуемый материал помещают в пробирки с
транспортной средой, предварительная обработка материала
не требуется. Современные ДНК/РНК тесты способны
идентифицировать от 3 до 11 периодонтопатогенов.
97.
Преимущества:– высокая специфичность;
– высокая чувствительность;
– возможность анализа до 96 образцов за один запуск
(использование при скрининговых исследованиях большого
числа пациентов);
– не требует специальных транспортных сред (для
проведения анализа необязательно присутствие живых
микроорганизмов);
– быстрый результат (весь процесс с момента передачи в
лабораторию занимает не более одного рабочего дня);
– за счет автоматической интерпретации полученных
результатов отсутствует субъективная оценка.
98.
Недостатки:– дороговизна;
– ограничение оценки лекарственной устойчивости (данные о
конкретных генетических механизмах резистентности могут
отсутствовать, резистентность к препаратам часто связана с
различными механизмами и мутациями в различных генах,
которые независимо влияют на фенотип);
– возможность ложноположительного ответа в результате
загрязнения исследуемого материала и ложноотрицательного
ответа в результате ингибирования реакции компонентами
биологических образцов.
99.
Разнообразие приемов ПЦР, опробованных в стоматологии,можно продемонстрировать еще одним примером.
Пародонтогенные микроорганизмы могут инициировать
выработку провоспалительных цитокинов и ферментных
систем при взаимодействии с клетками, осуществляющими
врожденный иммунитет, через Toll-подобные рецепторы (TLR).
Уровень экспрессии мРНК генов TLR обычно определяют
методом ПЦР в режиме «реального времени», совмещенной с
обратной транскрипцией с использованием специфических
праймеров. При этом мРНК служит матрицей для образования
с помощью обратной транскриптазы комплементарной ДНК
(кДНК), а последняя подвергается амплификации с помощью
соответствующих праймеров.
100.
Определенные перспективы имеет еще одно направлениеиспользования ПЦР - установление полиморфизма ряда генов,
сопряженных с высокой вероятностью тяжелого течения
хронического пародонтита. Например, аллельные варианты
гена ИЛ-1 - IL-1α +4845 и IL-1β +3954, в соответствии с
которыми человека можно отнести либо к «благоприятному»,
либо к «неблагоприятному» генотипу по возможности
развития хронического пародонтита и тяжести его течения.
101.
Помимо ПЦР, к методам молекулярной биологии, перспективным длястоматологической
клинической
практики,
относится
массспектрометрия - физический метод исследования вещества путем
определения отношения массы заряженных частиц вещества к их
заряду (качество) и количества заряженных частиц, образующихся в
процессе воздействия на вещество. С помощью метода массспектрометрии различных биологических субстратов можно решать
одну из важнейших задач медицины - определение маркеров болезней
путем выявления белков, измененный уровень экспрессии которых
может послужить средством ранней, доклинической диагностики
заболеваний. В стоматологии имеется пример проведения протеомных
исследований методом масс-спектрометрии для исследования состава
биопленок полости рта. Этим методом было определено большинство
биомаркеров инфекционно-воспалительных заболеваний пародонта,
относящихся к продуктам распада соединительной и костной ткани.
В последние годы изучение протеома слюны как основы
общеклинических лабораторных исследований стало занимать
значительное место, наряду с исследованиями крови/плазмы, ликвора,
мочи.
102.
Для определения молекулярных продуктов деградациисоединительной
ткани,
резорбции
костной
ткани,
провоспалительных цитокинов широко используют методы
иммуноанализа, основанные на применении меченых
моноклональных антител. Моноклональные антитела высокоспецифичные антитела, реагирующие, как правило, на
одну антигенную детерминанту и получаемые с использованием
гибридомных технологий, т.е. путем скрещивания иммуноцитов с
клетками плазмоцитомы. Полученные таким образом клетки
гибридомы обладают способностью к неограниченной
пролиферации и синтезу антител только одной узкой
специфичности, соответствующей клональной специфичности
исходного иммуноцита. Для использования в методах
иммуноанализа моноклональные антитела подвергают мечению,
сшивая их с молекулами флюорохрома, радиоактивной меткой,
магнитными частицами или ферментом (используются в
иммуноферментном анализе).
103.
Иммуноферментный метод нашел широкое применениепрактически во всех областях медицины, в том числе для
определения биомаркеров заболеваний полости рта
инфекционно-воспалительной природы. В частности, при
заболеваниях периодонта методом ИФА определяют
содержание в гингивальной жидкости таких биомаркеров, как
цитокины, протеогликаны, пептидные продукты тканевой
деструкции. Этот принцип используется в стоматологии и в
качестве экспресс-метода диагностирования ВИЧ-инфекции с
использованием проб из десневого содержимого.
104.
Помимо ферментного принципа мечения антител в медицинешироко
используется
флюоресцентный
принцип.
Моноклональные антитела, меченные флюорохромами, широко
используются для обнаружения микроорганизмов и биомаркеров
различных
заболеваний.
Меченные
флюорохромами
моноклональные антитела к маркерам клеток иммунной системы
позволяют определять количественный состав последних в
различных биологических образцах, в том числе и из ротовой
полости. Индуктором флюоресценции чаще всего служат
лазерные лучи с различной длиной волны, а метод такой
детекции получил название проточной цитофлюориметрии.
Проточная цитофлюориметрия как способ количественной
характеристики клеточного состава иммунограмм биологических
жидкостей, а также факторов бактерицидной активности в
ротовой полости применяется в различных разделах
стоматологии, поскольку позволяет работать как с кровью
больных, так и со слюной и гингивальной жидкостью.
105.
Таким образом, развитие технологий, положенных воснову современных лабораторных методов, переводит
диагностику стоматологических заболеваний на новый
методический уровень. Создавая основу для разработки
биомаркеров заболеваний полости рта, современные
лабораторные технологии не только открывают широкий
простор для выявления признаков патологического процесса,
но и позволяют прогнозировать его течение, осложнения,
исходы на базе количественного мониторинга.
106. Генетические основы микробной резистентности и пути ее преодоления
Микробная резистентность (устойчивость) –это способность м/о переносить значительно
бо′льшие концентрации препарата, чем другие м/о
данного вида, или развиваться при таких
концентрациях,
которые
возникают
в
макроорганизме после введения антибиотиков,
сульфаниламидов
или
нитрофуранов
в
терапевтических дозах.
107.
Бактериальная устойчивость может бытьприродной или приобретенной.
108.
Природная устойчивость является видовымпризнаком. Такое нормальное поведение
микробов в присутствии антибиотика
называется
диким
фенотипом
и
обусловлено
генами
бактериальной
хромосомы.
109.
Приобретенная устойчивость возникает в двухслучаях:
1. В результате мутаций в хромосоме под влиянием
антибиотиков. В этом случае устойчивость
является стабильной и передается из поколения в
поколение.
2. В результате приобретения бактериями
R-плазмид и транспозонов, несущих гены
резистентности
(внехромосомная
резистентность).
В этом случае устойчивость тоже передается
потомкам, но может утрачиваться, если в среде
будут отсутствовать те антибиотики, устойчивость
к которым несет данная R-плазмида или
транспозон.
110.
Этот тип устойчивости передается не тольковертикально, но и горизонтально (при конъюгации и
трансдукции) между бактериями одного вида, рода и
даже разных видов и родов, что с эпидемиологической точки зрения наиболее опасно.
R-плазмидная
передача
устойчивости
при
конъюгации является наиболее важным механизмом
возникновения резистентности в бактериальной
популяции. При этом в донорской клетке (R+)
происходит репликация плазмидной ДНК, 1 цепь
которой проникает в реципиентную клетку, где
образует новую плазмиду. В 1 клетке могут находится
десятки копий плазмид, что способствует быстрому
распространению внехромосомной резистентности.
111.
Механизмы устойчивости бактерий кантимикробным препаратам
112.
1. Перестройка мишеней(клеточная стенка, рибосомы)
Обусловлен: а) хромосомными мутациями;
б) плазмидами;
в) является природным
Формируется к бета-лактамам, гликопептидам,
аминогликозидам, макролидам
113.
β-лактамПСБ с высокой аффинностью
Пептидогликан
Периплазматическое пространство
Цитоплазматическая мембрана
Инактивированные ПСБ
Подавление синтеза пептидогликанов
Разрушение клеточной
стенки и смерть клетки
114.
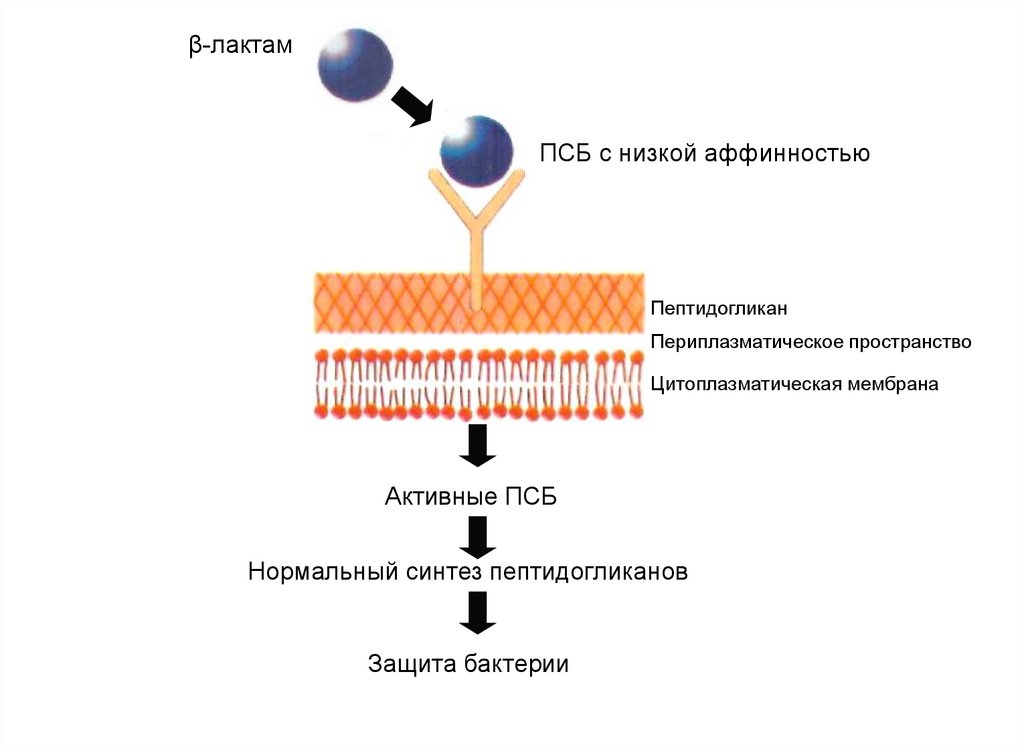
β-лактамПСБ с низкой аффинностью
Пептидогликан
Периплазматическое пространство
Цитоплазматическая мембрана
Активные ПСБ
Нормальный синтез пептидогликанов
Защита бактерии
115. 2. Нарушение проникновения антибиотика через мембрану в результате утраты белков-поринов
Обусловлен: а) хромосомными мутациями;б) является природным
Формируется к тетрациклинам, хинолонам, имипенемам, беталактамам
Мембрана
Белок-порин
116.
3. Инактивация антибиотиков бактериальнымиферментами
Обусловлен: а) плазмидами;
б) хромосомными мутациями;
в) является природным
Формируется к пенициллинам, цефалоспоринам,
монобактамам, карбапенемам, аминогликозидам,
эритромицину, левомицетину
117.
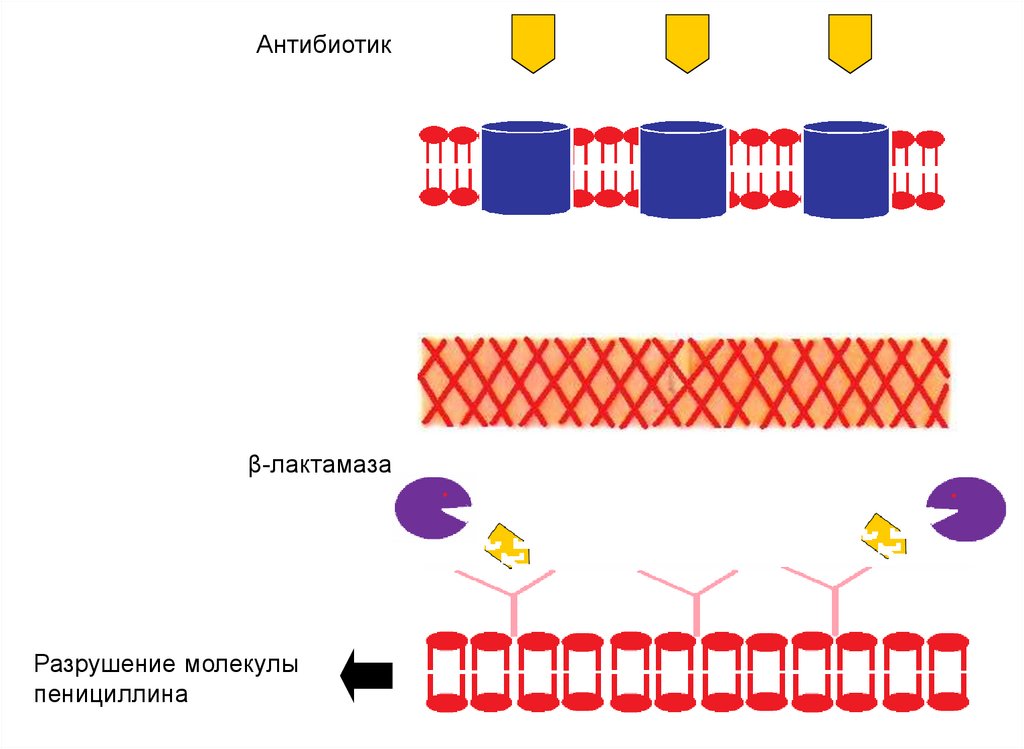
Антибиотикβ-лактамаза
Разрушение молекулы
пенициллина
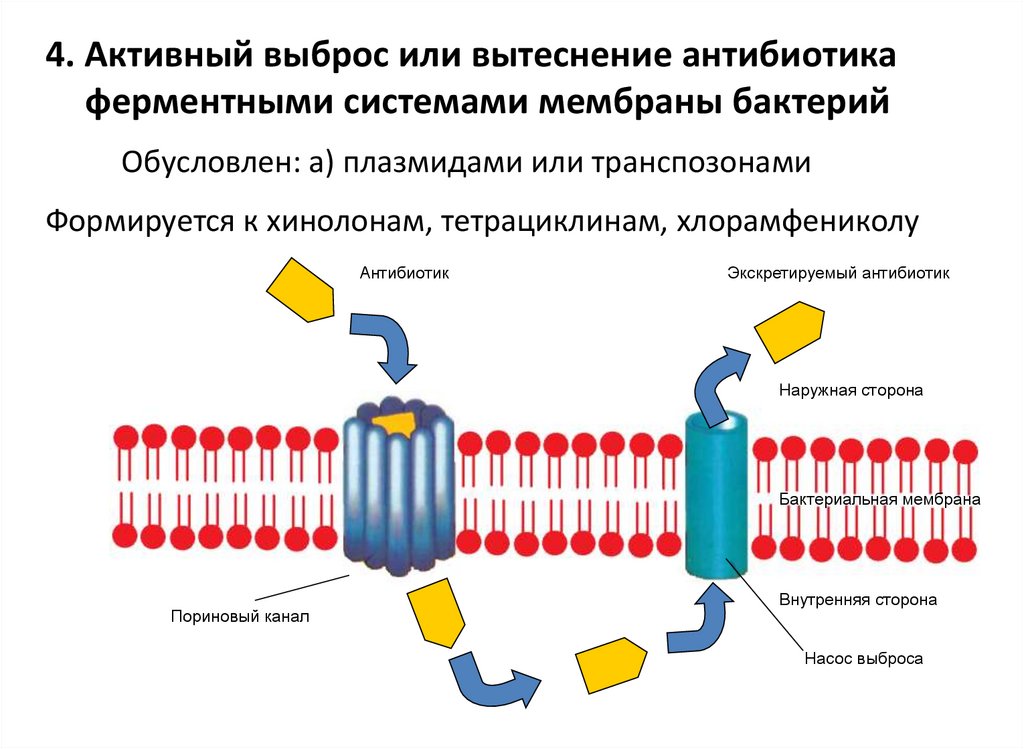
118. 4. Активный выброс или вытеснение антибиотика ферментными системами мембраны бактерий
Обусловлен: а) плазмидами или транспозонамиФормируется к хинолонам, тетрациклинам, хлорамфениколу
Антибиотик
Экскретируемый антибиотик
Наружная сторона
Бактериальная мембрана
Пориновый канал
Внутренняя сторона
Насос выброса
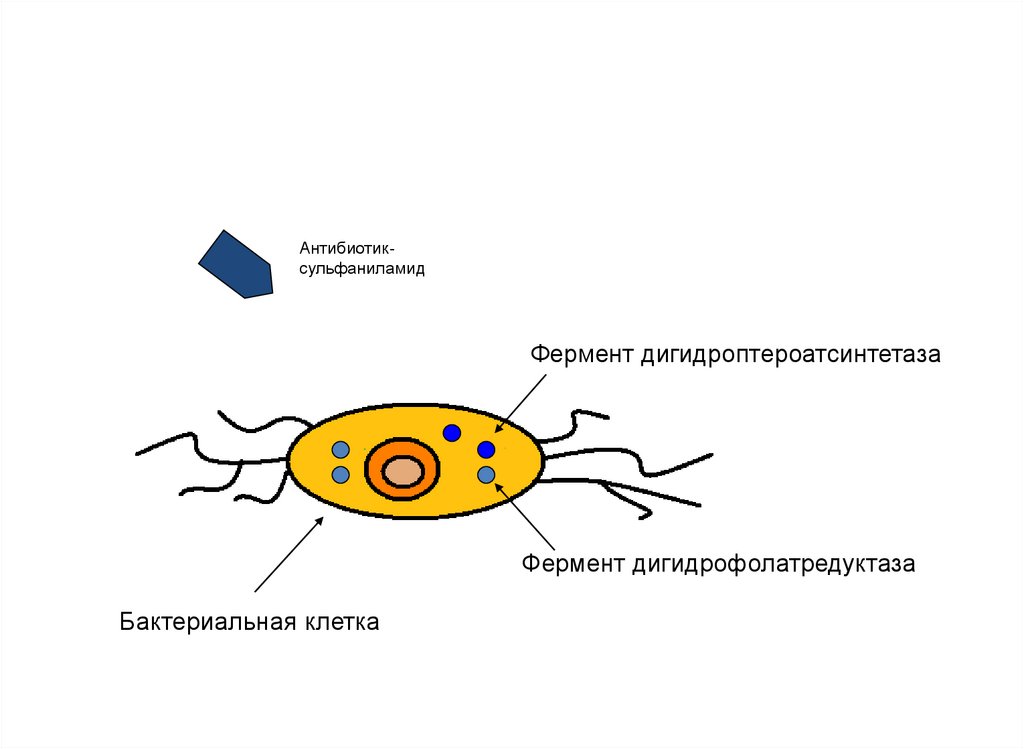
119. 5. Альтернативные пути метаболизма
• Этотмеханизм
связан
с
развитием
микроорганизмом
ферментативных
путей
метаболизма,
которые
не
блокируются
антибиотиками.
• Формируется к сульфаниламидам, триметоприму
120.
АнтибиотиксульфаниламидФермент дигидроптероатсинтетаза
Фермент дигидрофолатредуктаза
Бактериальная клетка
121.
Спасибо за внимание!122.
Для микробиологической диагностики используют различныеметоды, которые имеют преимущества и недостатки. Главное для
врача-стоматолога выбрать тот метод, который будет отвечать его
целям, экономическим и техническим возможностям.
1. Цитологический метод (бактериоскроскопический, в том числе
конфокальная микроскопия - это оптический метод получения
трёхмерных изображений текстур поверхностей и объектов)
2. Бактериологический метод
3. ПЦР диагностика
Для ПЦР сбор мягкого зубного налета производят методом смыва из
пародонтального кармана (в случае патологии) или из десневой
бороздки (в случае нормы) с помощью стерильных бумажных
эндодонтических штифтов.
Сбор твёрдого зубного налета производят следующим образом. После
предварительного полоскания ротовой полости водой проводят
обработку ватным тампоном зуба с целью полного удаления мягкого
налета и соскабливают поддесневой твердый налет, используя кюрету
Грейси.
123.
Выбор метода определяется преимуществами и недостаткамикаждого из них. Цитологический метод позволяет определить
только наличие микрофлоры без возможности определить вид
возбудителя и чувствительность к противомикробным средствам.
Метод жидкостной цитологии является более информативным,
однако
также
не
дает
возможности
определения
чувствительности к противомикробным средствам и является
более дорогим. Бактериологический метод позволяет установить
видовой состав микрофлоры, определить чувствительность
микроорганизмов к антибактериальным препаратам, но является
долгим, еще более дорогим и чувствительным к забору и
транспортировке материала. Метод ПЦР позволяет с высокой
точностью определить видовой состав микрофлоры, не
требователен к забору и транспортировке материала, дает
возможность
определения
чувствительности
к
антибактериальным препаратам, однако имеет высокую
стоимость и возможны ложные результаты.




































































































 Биология
Биология








