Похожие презентации:
Диссоциация кислот, оснований, солей. Сильные и слабые электролиты
1.
«Ум заключается не только в знании,но и в умении прилагать
знания на деле» (Аристотель)
2. Тест. Диссоциация кислот, оснований, солей. Сильные и слабые электролиты.
1. К электролитам не относится:1) MgCl2 2) Ba(OH)2 3) Na3PO4
4) СaCO3
2. К электролитам относится:
1) BaO
2) СaCO3
3) K3PO4
4) Al(OH)3
3. Слабая кислота – это:
1) HNO3 2) H2SiO3
3) H2SO4
4)HСlO4
4. Сильная кислота – это:
1) H2SO3 2) H2SiO3
3) H2S
4) H2SO4
5.Вещество,
которое
при
растворении
в
воде
диссоциирует с образованием карбонат – ионов, - это:
1) Na2CO3 2) CO2
3) H2CO3
4) MgCO3
6.Слабое основание – это:
1) Mg(OH)2
2) Ba(OH)2 3) KOH
4) NaOH
3.
7.Ионы
металла
и
гидроксид-ионы
электролитической диссоциации образует:
1) гидроксид меди (II) 3) азотная кислота
2) гидроксид калия
4) нитрат кальция
8. Ионы водорода и кислотного остатка
электролитической диссоциации образует:
1) серная кислота
3) аммиак
2) хлорид аммония
4) сульфат калия
при
при
4.
Ответ:1.(4)
2.(3)
3.(2)
4.(4)
5.(1)
6.(1)
7.(2)
8.(1)
5. Эксперимент
1. Слить растворы хлорида магния и сульфата натрия.2. Слить растворы хлорида железа (III) и гидроксида
натрия.
6. ТЕМА УРОКА
Реакцииионного
обмена
7.
Основные понятия:полное и сокращённое ионные уравнения,
реакции ионного обмена
Цель урока:
изучить реакции ионного
обмена, продолжить формирование умения
записывать уравнения и предвидеть продукты
реакции ионного обмена. Дать первоначальное
понятие об условиях течения реакций между
растворами до конца.
8. Реакции ионного обмена
Реакции между ионами называют ионнымиреакциями, а уравнения таких реакций ионными уравнениями.
Правила составления ионных уравнений:
вещества,
выпадающие
в
осадок,
малодиссоциирующие вещества, газообразные
записываются в молекулярном виде.
↓- осадок, ↑- газ.
Сильные электролиты записывают в виде
ионов.
9.
Реакции обмена протекают до конца:- если образуется осадок;
- выделяется газ;
- малодиссоциирующие вещества - (слабые
электролиты, например вода).
Правило: если в растворе нет таких ионов,
которые могут связываться между собой,
реакция обмена не протекает до конца, т.е.
является обратимой. При этом ставится
знак обратимости.
10.
11.
Молекулярное уравнениеFeCl3 + 3NaOH →Fe(OH)3↓ + 3NaCl
Полное ионное уравнение (ПИУ)
Fe3+ + 3Сl- + 3Na+ + 3OH-→ Fe(OH)3↓+ 3Na++ 3СlСокращенное ионное уравнение (СИУ)
Fe3+ + 3OH-→ Fe(OH)3↓
12. Реакции, идущие с образованием малодиссоциирующего вещества
Задание для группы № 1Если в результате реакции выделяется
малодиссоциирующее вещество – вода.
Проделайте реакцию между гидроксидом натрия
(добавьте фенолфталеин) и соляной кислотой до
исчезновения
окраски,
признак
реакции(вспомните – эта реакция обмена
называется
реакцией
нейтрализации)образование малодиссоциирующего веществаводы. Запишите молекулярное, полное и
сокращённое ионное уравнение.
13. Реакции, идущие с образованием осадка
Задание для группы № 2.Если в результате реакции выделяется
нерастворимое в воде вещество – осадок
Проделайте реакцию между сульфатом меди
(II) и гидроксидом натрия. Какой признак
этой реакции? Запишите молекулярное,
полное и сокращённое ионное уравнение.
14. Реакции, идущие с образованием газообразного вещества
Задание для группы № 3Если в результате реакции выделяется
газообразное вещество.
Проделайте реакцию между карбонатом
натрия и серной кислотой. Какой признак
этой реакции? Запишите молекулярное,
полное и сокращённое ионное уравнение.
15.
16. Одно из взятых исходных веществ практически нерастворимо
CuO, Fe2O3, Cu(OH)2, Zn(OH)2, CaCO3,Fe(OH)3 и др.
1группа – действие серной кислоты на гидроксид
меди (II)
2 группа – действие соляной кислоты на оксид
меди (II)
3группа – действие соляной кислоты на карбонат
кальция
17. Задание. Составьте молекулярные и полные ионные уравнения – по сокращенным ионным уравнениям.
1 группаSO32- + 2H+ →H2O + SO2↑
Fe2+ + 2OH- →Fe(OH)2↓
2 группа
CO32- + 2H+ → H2O + CO2↑
NH4+ + OH- →NH3↑ + H2O
3 группа
2PO43- + 3Ba2+ →Ba3(PO4)2
Al3+ + 3OH- →Al(OH)3↓
18.
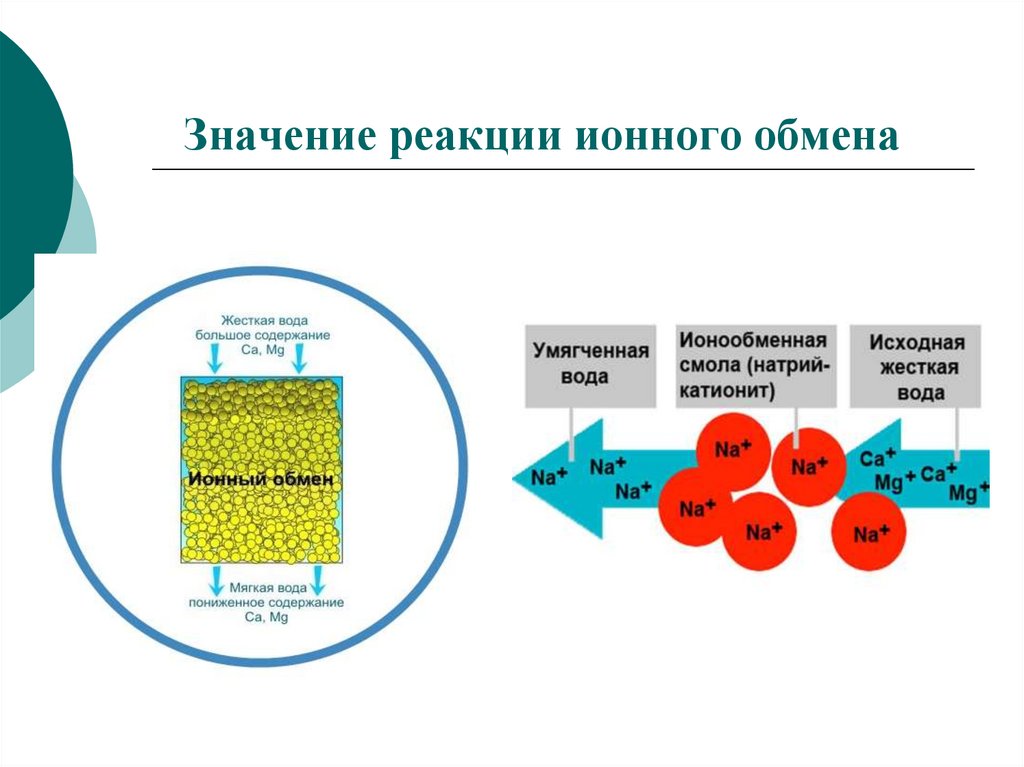
Значение реакции ионного обмена19.
Закончите предложениеМне больше всего удалось…
Сегодня я узнал…
Было сложно…
Было интересно…
Теперь я могу…
Я попробовал…
20.
Домашнее задание.Упр.1,2,3,4,5 стр. 39
Задания: №2-21, 2-25, 2-26 стр. 21
Творческое задание. Составьте кроссворд
по теме «Электролитическая
диссоциация».



















 Химия
Химия








