Похожие презентации:
Предмет химии. Вещества
1. Предмет химии. Вещества.
2.
Девиз урока:«Широко простирает химия руки
свои в дела человеческие»
М.В.Ломоносов
www.pmedia.ru
3. Химия – наука о веществах, их свойствах и превращениях.
ТелоВещество
Молекулы
Атомы
4. Вещество – это то, из чего состоят физические тела
ВеществаПриродные
(углекислый
газ)
Синтети
ческие
(полиэтилен)
Вещества
Простые
(водород,
кислород)
Сложные
(вода, сахар)
5. Вещества, которые образованы атомами одного химического элемента, называют простыми
6. Вещества, которые образованы атомами двух и более разных химических элементов, называют сложными
7. Рассмотрите модели молекул. В чём между ними сходство и различие? Какое из веществ простое, а какое - сложное? Почему?
• ВеществаВодород
Вещество
Кислород
Вода
8.
СвойстваСостав
Химия
Применение
• Свойства веществ – это признаки, по
которым вещества отличаются друг
от друга, либо сходны между собой
9. Упражнение №1
• Определите, какое из предложенныхвеществ простое, а какое – сложное.
10. Что объединяет эти объекты?
11. Основные понятия химии
1.Атом – электронейтральная частица,cостоящая из положительно
заряжённого ядра и отрицательно
заряжённых электронов.
2.Молекула - наименьшая
частица вещества, обладающая
всеми его свойствами.
12.
3.Химическийэлемент
–
это
совокупность атомов с одинаковым зарядом
ядра.
Один и тот же химический элемент может
образовывать несколько простых веществ.
Это явление называют
4.Аллотропия
способность
химического элемента образовывать
несколько простых веществ.
13. Аллотропия.
• Среди неметаллов распространено явлениеаллотропии. Один элемент может
образовывать несколько простых веществ.
Причины аллотропии:
• Разные типы кристаллических решеток
(белый фосфор Р4 – молекулярная,
красный фосфор Р – атомная).
• Разная структура кристаллической решетки
(алмаз – тетраэдрическая, графит – слоистая).
• Разный состав молекул аллотропных
модификаций (О2 и О3).
14. Кислород О2 и озон О3
Кислород- газ, без цвета, вкуса изапаха, плохо растворим в воде, в
жидком состоянии светло-голубой, в
твердом – синий.
Озон- светло-синий газ, темно-голубая
жидкость, в твердом состоянии
темно-фиолетовый, имеет сильный
запах, в 10 раз лучше, чем кислород,
растворим в воде.
15.
5.Качественныйсостав
–
это
совокупность химических элементов,
составляющих
данное
химическое
вещество. (из чего?)
6.Количественный состав – это
количество или число атомов того или
иного
химического
элемента,
образующих
данное
химическое
вещество. (сколько?)
16.
7. Валентность - это способностьатомов одного химического элемента
соединяться со строго определённым
числом атомов другого химического
элемента.
+2 +6 -2
BaSO4
17.
8.Химическая формула – это способотображения
химического
состава
вещества.
СaSO4
HNO3
9.Графическая
формула
отражает
порядок соединения атомов, т. е. связи
между ними
O
Н
Н
Н О N
O
18.
10. Относительная атомная масса:атомная масса химического элемента
Аr(О) =16
11. Относительная молекулярная масса или
(молярная масса М):
( сумма относительных атомных масс всех
атомов, образующих молекулу вещества
Mr(СаО) = Аr(Са)+ Аr(О)=40+16=56 г/моль
19.
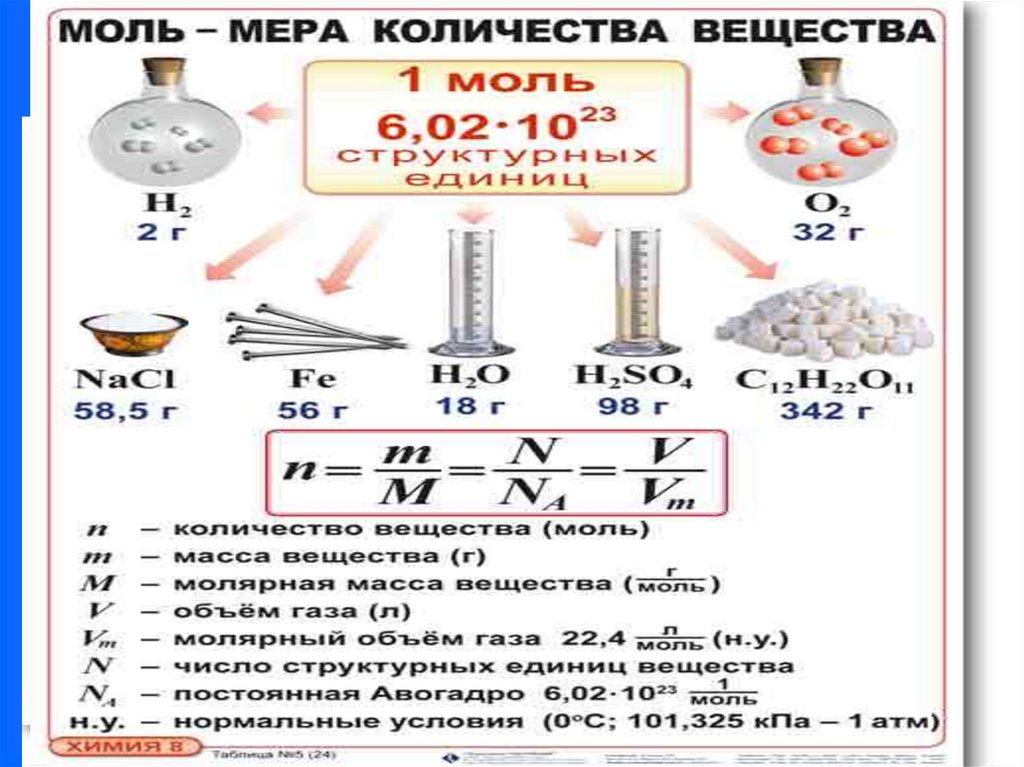
12. КОЛИЧЕСТВО ВЕЩЕСТВА – числоатомов, молекул или других формульных
единиц вещества
n = m/M
(моль)
20.
13. Молярный объем – объем 1 моль газапри н.у.
Vm = 22,4 л/моль
14. Постоянная Авогадро ( N A) – число
атомов или молекул, содержащихся в
одном моле вещества, она всегда
23
1
N A 6,022 *10 моль
равна:
21.
• оА. Авогадро
1811
о
Итальянский ученый Амадео Авогадро сформулировал
закон (для газов) :
в равных объемах различных газов при одинаковых
условиях содержится одинаковое число молекул
При н.у. 1 моль любого газа занимает
объем 22,4 л.
22.
15. Следствия закона Авогадро (длягазов)
Отношение массы определённого
объёма одного газа к массе такого же
объёма другого газа, взятого при тех же
условиях, называется относительной
плотностью первого газа по второму:
23.
24.
Методика решения задач по химииПри решении задач необходимо руководствоваться
несколькими простыми правилами:
1) Внимательно прочитать условие задачи и записать;
2) Записать, что дано, что найти.
3) Перевести, если это необходимо, единицы
физических величин в единицы системы СИ
4) Записать, если это необходимо, уравнение реакции
и расставить коэффициенты;
5) Решать задачу, используя понятие о количестве
вещества или метод составления пропорций;
6) Записать ответ.
25. Задачи:
1. Рассчитать относительную плотность поазоту и по воздуху: серного газа SO3?
2. Рассчитать относительную плотность по
водороду и азоту: углекислого газа?
26.
Задачи (закрепление)1. Найдите число молекул в 2 молях
водорода (H2)
2. Найдите массу 3 моль углекислого
газа (СО2)
3. Рассчитайте массу 112 л водорода
(н.у.)
4. Что тяжелее: 2 моль NО2 или 2 моль
СаО ?
5. Найдите массовую долю серы в
серной кислоте (H2SO4)?
6. Какой объем займет сернистый газ
(SO2) , масса которого равна 3,2 г?

























 Химия
Химия








