Похожие презентации:
Электрический ток в металлах и в жидкостях. Электрический ток в различных средах
1.
Электрический ток в различных средах2.
Электрический ток в металлах – это упорядоченноедвижение электронов под действием электрического
поля.
Опыты показывают, что при протекании тока по
металлическому проводнику не происходит переноса
вещества, следовательно, ионы металла не принимают
участия в переносе электрического заряда.
Опыт Э. Рикке:
Вывод: свободными носителями
заряда в металлах являются не
ионы. Заряд, прошедший через
цилиндры, был перенесён,
очевидно, такими частицами,
которые одинаковы и в меди, и в
алюминии - это электроны.
Естественно предположить, что
ток в металлах осуществляют
именно свободные электроны.
3.
Опыт Т. Стюарта и Р. ТолменаКатушка с большим числом витков тонкой
проволоки приводилась в быстрое вращение вокруг
своей оси. Концы катушки с помощью гибких
проводов были присоединены к чувствительному
баллистическому гальванометру . Раскрученная
катушка резко тормозилась, и в цепи возникал
кратковременных ток, обусловленный инерцией
носителей заряда. Полный заряд, протекающий по
цепи, измерялся по отбросу стрелки гальванометра
Р. Толмен
4.
ВВ начале 20 века немецкий физик П. Друде и голландский физик Х. Лоренц создаликлассическую теорию электропроводности металлов.
Основные положения теории:
1.Хорошая проводимость металлов
объясняется наличием в них большого
числа электронов.
2.Под действием внешнего
электрического поля на беспорядочное
движение электронов накладывается
упорядоченное движение, т.е.
возникает ток.
5.
Сверхпроводимость – свойство некоторых материалов резко(скачкообразно) понижать сопротивление практически до нуля при
достижении ими температуры ниже определённого значения (т.е.
критической температуры).
По критической температуре
сверхпроводники
разделяются на
низкотемпературные, если
критическая температура
ниже 77K (-196оС), и
высокотемпературные.
6.
Задачи:1. Плотность тока в никелированном проводнике длинной 25 м
равна 1 МА/м². Какова разность потенциалов на концах
проводника?
2. Какова средняя скорость направленного движения электронов
(дрейфовая скорость) в металлическом проводнике с сечением
0,5 см², если в проводнике существует ток силой 12 А, а в
каждом кубическом сантиметре проводника имеется 5•10²¹
электронов проводимости.
3. Найти скорость упорядоченного движения электронов v в
стальном проводнике, концентрация электронов проводимости в
котором n = 1028 м‾ ³, при напряженности поля Е = 96 мВ/м.
7.
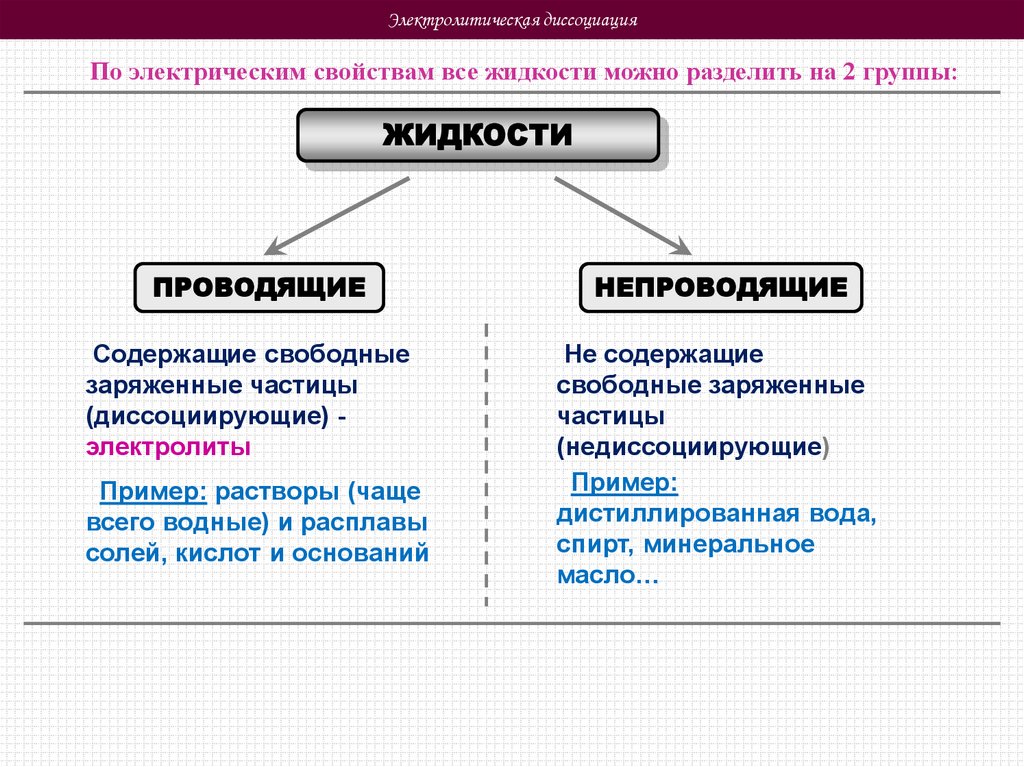
Электролитическая диссоциацияПо электрическим свойствам все жидкости можно разделить на 2 группы:
ЖИДКОСТИ
ПРОВОДЯЩИЕ
НЕПРОВОДЯЩИЕ
Содержащие свободные
заряженные частицы
(диссоциирующие) электролиты
Не содержащие
свободные заряженные
частицы
(недиссоциирующие)
Пример:
дистиллированная вода,
спирт, минеральное
масло…
Пример: растворы (чаще
всего водные) и расплавы
солей, кислот и оснований
8.
Электролитическая диссоциацияЭлектролитическая диссоциация - это распад
нейтральных молекул вещества в растворителе на
положительные и отрицательные ионы
Na Cl
Степень диссоциации – это доля в
растворённом веществе молекул,
распавшихся на ионы.
Степень диссоциации зависит:
- Температуры (чем выше
температура, тем больше степень
диссоциации);
- Концентрация раствора;
Na+
Cl-
- Электрические свойства
растворителя.
Рекомбинация – это объединение ионов разных знаков
в нейтральные молекулы.
9.
ЭлектролизЭлектрический ток в электролитах – это упорядоченное
движение положительных и отрицательных ионов.
Электролиз – это выделение вещества на электродах
вследствие окислительно – восстановительных реакций
при прохождении тока через электролит.
- (катод)
+ (анод)
+
+
+
+
-
-
В процессе протекания тока
через электролит на катоде
происходит оседание слоя
чистого вещества –
электролиз.
10.
Законы электролизаИсследовал электролиз и открыл его законы английский физик Майкл
Фарадей в 1834 году
Первый закон электролиза
Масса вещества, выделившегося на
электродах при электролизе, прямо
пропорциональна величине заряда,
прошедшего через электролит
m kq
Майкл Фарадей (1791 – 1867)
k – электрохимический эквивалент
вещества (равен массе вещества,
выделившегося при прохождении через
электролит заряда 1 Кл)
Открыл явление
электромагнитной индукции,
законы электролиза, ввел
представления об электрическом и
магнитном поле
Если учесть, что q = I*t, то
m k I t
11.
Законы электролизаВторой закон электролиза:
При одинаковом количестве электричества (электрическом
заряде, прошедшем через электролит) масса вещества,
выделившегося при электролизе, пропорциональна отношению
молярной массы вещества к валентности
m – масса выделившегося вещества
М – молярная масса вещества
k – электрохимический эквивалент
z – валентность вещества
Заряд, необходимый для выделения 1 моля вещества, одинаков для всех
электролитов. Он называется числом Фарадея (F)
F N A e 9.65 104 Кл / моль
Электрохимический эквивалент и
число Фарадея связаны
соотношением:
M
k
zF
12.
Применение электролизаПРИМЕНЕНИЕ ЭЛЕКТРОЛИЗА
Получение химически чистых веществ
Гальваностегия
Гальванопластика
13.
Применение электролизаПолучение химически чистых веществ:
Рафинирование меди:
- катод
+
При прохождении
тока через
анод электролит на катоде
оседает чистая медь,
анод расходуется и
истощается.
Примеси остаются в
электролите или
оседают на дно
При плотности тока
0,3А на 1дм2 процесс
идет несколько дней
Получение алюминия:
Алюминий получают
электролитическим способом из
глинозема (алюминий является
одним из самых распространенных
химических элементов земной коры
и содержится в любой глине)
Электролитическим способом
получают:
Магний, натрий, калий, кальций …
Соду, хлор, хлористый кальций …
Осуществив, например, электролиз
раствора поваренной соли NaCl, мы
можем получить сразу 3 полезных
CuSO4
химических вещества:
Катод – тонкая пластина чистой меди,
Газообразные водород и хлор, а также
анод – толстая пластина неочищенной меди раствор едкого натра NaOH
14.
Применение электролизаОснователем гальванотехники и ее широчайшего применения является
Б. С. Якоби, который изобрел в 1836 году гальванопластику
Борис Семенович Якоби
(1801 – 1874)
русский академик
Гальванотехника - это отрасль прикладной электрохимии, смысл
которой состоит в получении электролитическим путем
металлических копий каких-либо предметов (гальванопластика)
или же в нанесении этим же способом металлических покрытий на
какие-либо поверхности (гальваностегия).
Гальванопластика –
Гальваностегия – покрытие
получение отслаиваемых
предметов неокисляющимся
копий предмета, полученных
металлами для защиты от
путем осаждения металла на
коррозии
поверхности предмета
(Ni, Cr, Zn, Ag, Au, Cu …)
электролитическим способом
Применение:
- получение рельефных копий
барельефов, статуй
- изготовление клише, полиграфия
- выпуск ценных бумаг, денег
Копия барельефа,
полученная методом
гальванопластики
15.
Применение электролизаКроме указанных выше, электролиз нашел применение и в других
областях:
- получение оксидных защитных пленок на металлах (анодирование);
- электрохимическая обработка поверхности металлического изделия
(полировка);
- электрохимическое окрашивание металлов (например, меди, латуни, цинка,
хрома и др.);
- очистка воды - удаление из нее растворимых примесей. В результате
получается так называемая мягкая вода (по своим свойствам
приближающаяся к дистиллированной);
- электрохимическая заточка режущих инструментов (например,
хирургических ножей, бритв и т.д.).
16.
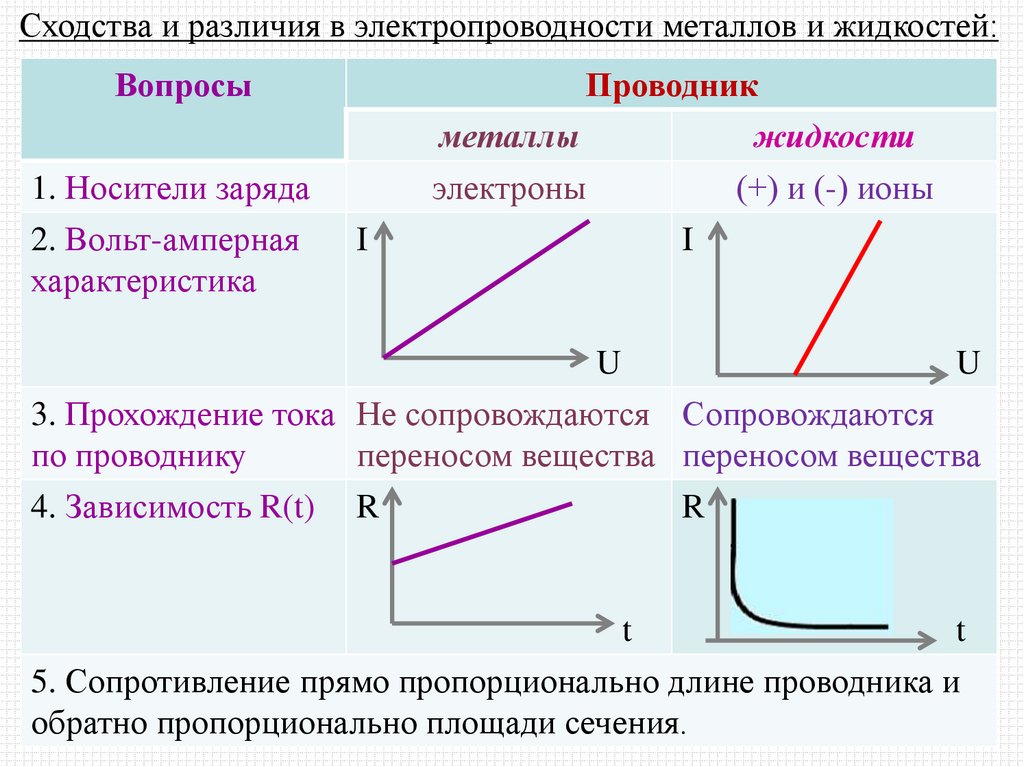
Сходства и различия в электропроводности металлов и жидкостей:Вопросы
1. Носители заряда
2. Вольт-амперная
характеристика
I
Проводник
металлы
жидкости
электроны
(+) и (-) ионы
I
U
U
3. Прохождение тока Не сопровождаются Сопровождаются
по проводнику
переносом вещества переносом вещества
4. Зависимость R(t) R
R
t
t
5. Сопротивление прямо пропорционально длине проводника и
обратно пропорционально площади сечения.














 Физика
Физика








