Похожие презентации:
Углерод и кремний. Физические свойства простых веществ углерода и кремния
1. Углерод и кремний
Углерод обозначается символом C (лат. Carbonium).Кремний обозначается символом Si (лат. Silicium, от лат. silex — кремень).
2. Углерод и кремний являются химическими элементами IVA-группы периодической системы. Находятся во 2 и 3 периоде соответственно.
Углерод и кремний – элементынеметаллы.
3. У углерода на внешнем энергетическом уровне 4 электрона – 2s22p2, как и у кремния – 3s23p2.
Вследствие этого, в соединениях с другими элементамиатомы углерода и кремния чаще всего проявляют степени
окисления -4, +2, +4. В простом веществе степень окисления
элементов равна 0.
4. Физические свойства простых веществ углерода и кремния.
Углерод существует во множестве аллотропных модификаций с оченьразнообразными физическими свойствами. Разнообразие модификаций
обусловлено способностью углерода образовывать химические связи разного
типа.
Известны следующие аллотропные модификации углерода: графит, алмаз, карбин
и фуллерены.
a) алмаз
b) графит
c) лонсдейлит
d) фуллерен — бакибол C60
e) фуллерен C540
f) фуллерен C70
g) аморфный углерод
h) углеродная нанотрубка
5. Алмаз –бесцветное (иногда желтоватое, коричневатое, зеленое, черное, синее, красноватое) прозрачное вещество, очень сильно
преломляющее лучи света.По твердости превосходит все известные природные вещества. Но обладает хрупкостью.
Химически инертен, плохо проводит тепло и электрический ток.
Плотность 3,5 г/см3.
Каждый атом углерода в структуре алмаза расположен в центре тетраэдра, вершинами
которого служат четыре ближайших атома. Именно прочная связь атомов углерода
объясняет высокую твердость алмаза.
Графит –наиболее распространенная форма.
Это очень мягкое черное вещество с металлическим блеском, хорошо проводит
электрический ток и тепло. Жирный на ощупь, при трении расслаивается на отдельные
чешуйки.
tплавл = 3750 °С (плавится при давлении 10 МПа, при обычном давлении возгоняется).
Плотность 2,22 г/см3.
Структура графита образована параллельными слоями сеток, состоящих из
шестиугольников с атомами углерода в вершинах. Атомы в каждом отдельно взятом
слое связаны достаточно прочно, а между слоями связь слабая.
6. Карбин –синтетическая модификация углерода. Черный мелкокристаллический порошок. Плотность 1,9–2 г/см3. Полупроводник.
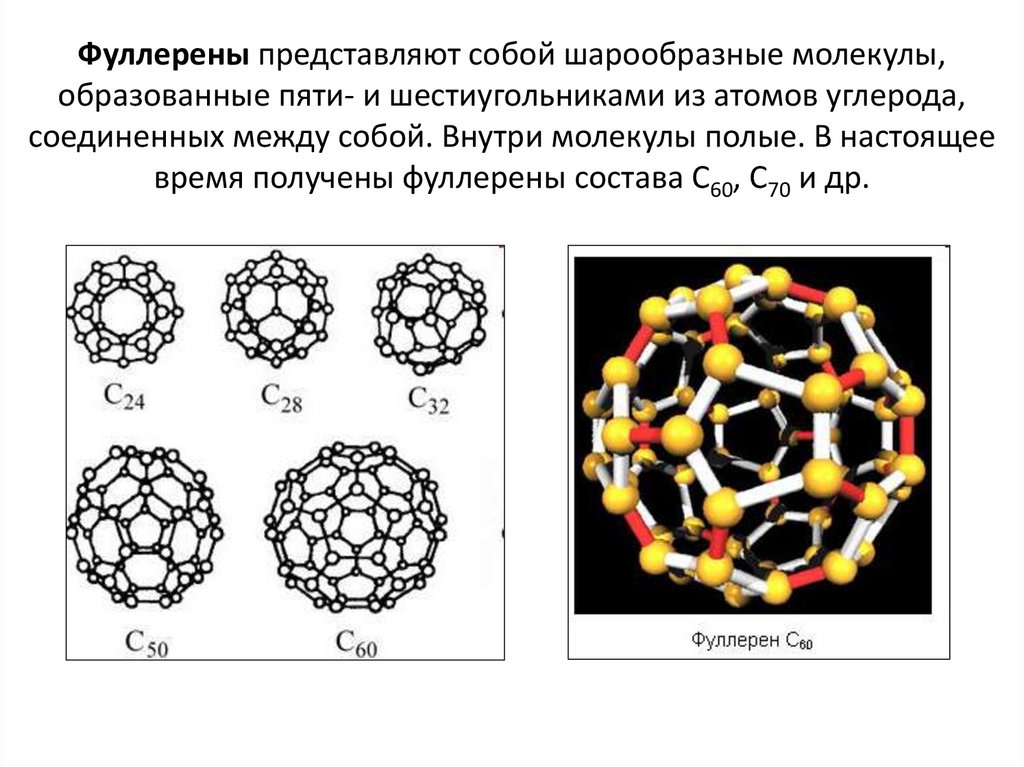
7. Фуллерены представляют собой шарообразные молекулы, образованные пяти- и шестиугольниками из атомов углерода, соединенных между
собой. Внутри молекулы полые. В настоящеевремя получены фуллерены состава С60, С70 и др.
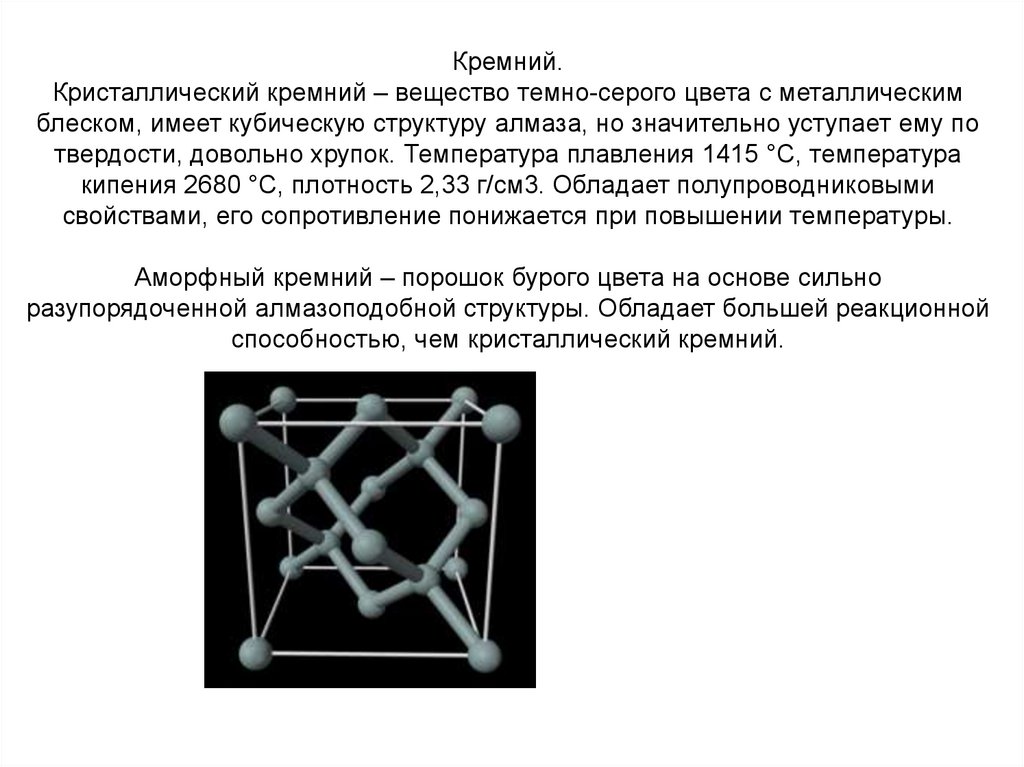
8. Кремний. Кристаллический кремний – вещество темно-серого цвета с металлическим блеском, имеет кубическую структуру алмаза, но
значительно уступает ему потвердости, довольно хрупок. Температура плавления 1415 °C, температура
кипения 2680 °C, плотность 2,33 г/см3. Обладает полупроводниковыми
свойствами, его сопротивление понижается при повышении температуры.
Аморфный кремний – порошок бурого цвета на основе сильно
разупорядоченной алмазоподобной структуры. Обладает большей реакционной
способностью, чем кристаллический кремний.
9. Химические свойства
СВзаимодействие с неметаллами
С + 2S = CS2. С + О2 = СО2, С + 2F2 = CF4. C + 2H2 = CH4.
не взаимодействует с азотом и фосфором.
Взаимодействие с металлами
Способен взаимодействовать с металлами, образуя
карбиды:
Ca + 2C = CaC2.
Взаимодействие с водой
C + H2O = CO + H2.
Углерод способен восстанавливать многие металлы из их
оксидов:
2ZnO + C = 2Zn + CO2.
Концентрированные серная и азотная кислоты при
нагревании окисляют углерод до оксида углерода (IV):
C + 2H2SO4 = CO2 + 2SO2 + 2H2O;
10.
SiВзаимодействие с неметаллами
Si + 2F2 = SiF4. Si + 2Cl2 = SiCl4. Si + O2 = SiO2.
= SiC Si + 3B = B3Si. 3Si + 2N2 = Si3N4.
С водородом не взаимодействует.
Взаимодействие с галогеноводородами
Si + 4HF = SiF4 + 2H2,
Взаимодействие с металлами
2Ca + Si = Ca2Si.
Взаимодействие с кислотами
3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4NO + 8H2O.
Взаимодействие со щелочами
Si + 2NaOH + H2O = Na2SiO3 + H2.
Si + C
11. Нахождение в природе В виде углекислого газа углерод входит в состав атмосферы (0,03% по объему). Уголь, торф, нефть и
природный газ - продукты разложения растительного мираЗемли древнейших времен.
12.
Природные неорганические соединенияуглерода – карбонаты. Минерал кальцит
CaCO3 является основой осадочных
горных пород – известняков. Другие
модификации карбоната кальция
известны как мрамор и мел
13. Кремний в природе
Он широко распространен в виде кремнезема SiO2 и различных силикатов.Например, гранит содержит более 60% кремнезема, а кристаллический кварц
является самым чистым из природных соединений кремния с кислородом.
Листья крапивы покрыты колючими волосками из чистого оксида
кремния(IV), которые представляют собой полые трубочки длинной 1-2 мм.
Трубочки заполнены жидкостью, содержащей муравьиную кислоту.
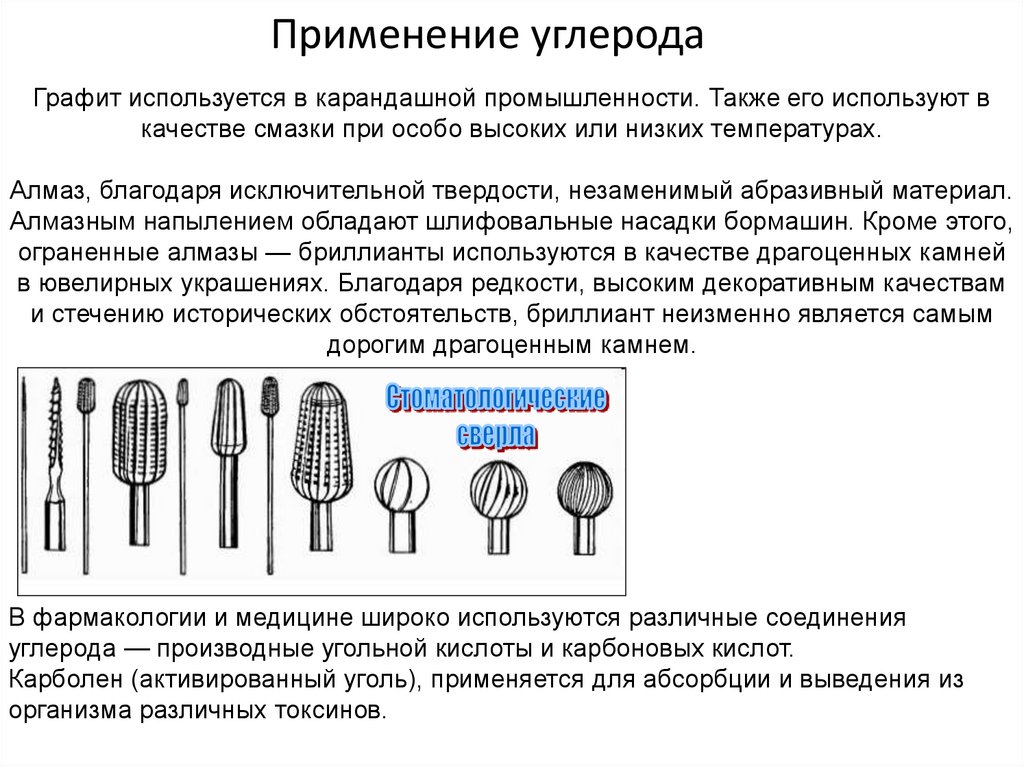
14. Применение углерода
Графит используется в карандашной промышленности. Также его используют вкачестве смазки при особо высоких или низких температурах.
Алмаз, благодаря исключительной твердости, незаменимый абразивный материал.
Алмазным напылением обладают шлифовальные насадки бормашин. Кроме этого,
ограненные алмазы — бриллианты используются в качестве драгоценных камней
в ювелирных украшениях. Благодаря редкости, высоким декоративным качествам
и стечению исторических обстоятельств, бриллиант неизменно является самым
дорогим драгоценным камнем.
В фармакологии и медицине широко используются различные соединения
углерода — производные угольной кислоты и карбоновых кислот.
Карболен (активированный уголь), применяется для абсорбции и выведения из
организма различных токсинов.
15. Применение кремния
Кремний находит применение в полупроводниковой техникеи микроэлектронике, в металлургии в качестве добавки к
сталям и в производстве сплавов.
Соединения кремния служат основой для производства стекла
и цемента. Производством стекла и цемента занимается
силикатная промышленность. Она также выпускает
силикатную керамику — кирпич, фарфор, фаянс и изделия из
них.
Широко известен силикатный клей, применяемый в
строительстве как сиккатив, а в пиротехнике и в быту для
склеивания бумаги.












 Химия
Химия








